猪圆环病毒2型ORF3基因的克隆及原核表达
2012-07-10杨晓燕杨顺利尹双辉尚佑军田永强
杨晓燕,刘 航,杨顺利,尹双辉,尚佑军,田永强
(1.兰州交通大学化学与生物工程学院,甘肃 兰州 730070;2.中国农业科学院兰州兽医研究所,家畜疫病病原学国家重点实验室,甘肃 兰州 730046)
猪圆环病毒(Porcine circovirus,PCV)是目前发现的最小的动物病毒[1],属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),病毒基因组为无囊膜的单股环状DNA病毒。病毒颗粒平均直径为17nm,呈20面体对称[2]。根据PCV的致病性、抗原性及核苷酸序列,将PCV分为PCV1和PCV2两个基因型,基因组大小约为1.7kb,其中PCV1对猪为非致病性,但广泛存在猪体内及猪源代细胞系。PCV2感染常常被认为可引起断奶仔猪多系统衰竭综合征(PMWS)、皮炎肾病综合征、增生性坏死性肺炎、猪繁殖与呼吸综合征、仔猪传染性先天性震颤等多种疾病,但临床上以PMWS最为常见[3-5]。
PCV2的ORF3基因是除ORF1、ORF2外较大的阅读框[6],位于基因组671~357 bp位碱基(复制起始点作为序列起始),大小为314 bp,编码104个氨基酸。ORF3对应着ORF1(Rep蛋白氨基酸103~207 aa)的反向互补序列和Cap蛋白B淋巴细胞抗原表位(185~211 aa),与ORF2蛋白的一个 T淋巴细胞抗原表位共用201~211 aa,功能尚不完全清楚[8]。而其他阅读框编码产物的功能和特性目前尚不清楚。为了探讨ORF3基因结构及其与功能的关系,研究以实验室分离的PCV2菌株为材料,对ORF3基因进行完整克隆,并在大肠杆菌中克隆表达。
1 材料与方法
1.1 病毒、菌株与基因
实验室保存的从临床表现为PMWS仔猪脾脏中分离的PCV2毒株;大肠杆菌 JM109,BL21(DE3)菌株,载体 pGEX-6p-1(Invitrogen公司)。
1.2 酶与试剂
引物、PCR试剂、DNA片段回收试剂盒、质粒提取试剂盒(大连宝生物有限公司);T4 DNA连接酶、BamH I、Sal I限制性内切酶,Taq酶(promega公司);核酸 Makers,蛋白 Makers,TMB,辣根过氧化物酶标记兔抗猪IgG抗体(Sigma公司),其他试剂均为国产分析纯试剂。
1.3 引物设计与目的基因的PCR扩增
按照Genbank中PCV2 ORF3的序列,设计一对特异性引物,引物序列如下:
P1:5′-TTCGGATCCATGGTAACCGTCCCACCACT-3′
P2: 5′-CTGGTCGACCCTGATGGAATGTGGAGC-3′
为了便于克隆,在引物P1中加入了BamH I酶切位点,在P2中加入了Sal I酶切位点,同时为了方便表达及表达产物的纯化,删去了终止密码子,引物由上海生工合成。PCR扩增反应条件:95℃5 min,94℃变性 1 min,55℃退火 40 s,72℃延伸 50 s,循环30次后,最后72℃延伸10 min。扩增产物进行1.5%琼脂糖凝胶电泳分析,用DNA回收试剂盒回收PCR产物。
1.4 原核表达载体的构建
将回收的PCV2 ORF3基因片段与载体pGEX-6p-1分别用BamH I+Sal I双酶切,用T4 DNA连接酶将ORF3克隆到载体pGEX-6p-1中。连接产物转化入大肠杆菌JM109感受态细胞,经BamH I+Sal I双酶切及PCR鉴定,筛选出重组质粒,命名为pGEX-6p-1-ORF3。将重组质粒pGEX-6p-1-ORF3送上海生工进行测序。
1.5 ORF3基因的诱导表达及其可溶性分析
将重组质粒pGEX-6p-1-ORF3转化大肠杆菌BL21(DE3)菌株中,将含有重组质粒的单菌落在新鲜的 5mL LB 培养基(含 100 μg/mL,Amp+),37℃振荡培养过夜(180 r/min),阴性对照为含空白载体pGEX-6p-1的受体菌。次日按1%的接种量将重组菌pGEX-6p-1-ORF3接种到新鲜的含Amp+的LB培养基中,37℃培养至OD600值约为0.6~0.8左右时,取1 mL作为未诱导样品,加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG)至终浓度1 mmol/L,37℃诱导表达8 h,收集1 mL菌液,用120 g/L分离胶进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
将BL21转化菌进行诱导表达后,收获菌体进行超声波破碎,离心分离后分别取上清和沉淀进行SDS-PAGE电泳,检测目的蛋白的可溶性。
1.6 Western-blot鉴定
将SDS-PAGE凝胶的蛋白带电转移至硝酸纤维素膜,以封闭液(TBST+1%BSA)封闭过夜,与PCV2阳性猪多抗血清37℃温浴1 h,经充分洗涤后,再转入封闭液稀释的HRP标记羊抗猪IgG中,37℃温浴1 h,DAB显色。
2 结果与分析
2.1 ORF3的扩增及重组质粒鉴定
用P1/P2引物进行扩增,得到大小约为314 bp的片段(如图1)。大小与预期结果相符。将该片段与经双酶切作用后的原核载体pGEX-6p-1连接后,连接产物转化入大肠杆菌JM109感受态细胞,经BamH I+Sal I双酶切及PCR鉴定,出现约314 bp大小的片段(图2、图3)。经测序,结果表明所连序列即为目的序列。

图1 ORF3基因的PCR扩增

图2 重组质粒pGEX-6p-1-ORF3的PCR鉴定

图3 重组质粒pGEX-6p-1-ORF3的酶切鉴定
2.2 PCV2 pGEX-6p-1-ORF3的诱导表达、分析
通过SDS-PAGE电泳分析在E.coli中重组蛋白pGEX-6p-1-ORF3大小约为37 kD(pGEX-6p-1载体所带的GST标签大小为26 kD)(如图4),在37℃条件下表达的pGEX-6p-1-ORF3主要以包涵体形式存在。进一步调整诱导条件,降低诱导温度、IPTG浓度、延长诱导表达的时间,但仍是大部分以包涵体形式存在,对包涵体进行纯化,如图5所示。
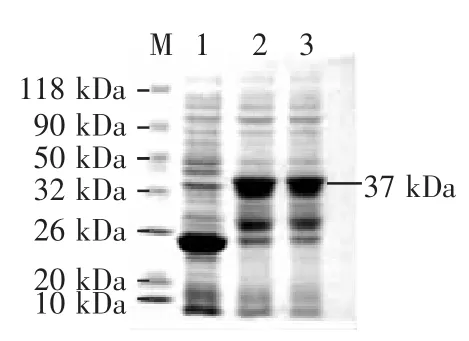
图4 pGEX-6p-1-ORF3表达产物的SDS-PAGE检测
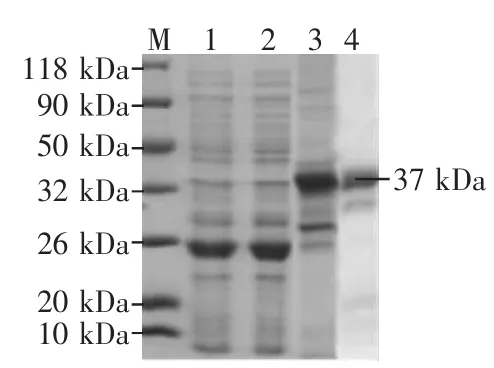
图5 pGEX-6p-1-ORF3表达产物可溶性鉴定和纯化
2.3 pGEX-6p-1-ORF3表达产物的Western blot鉴定
重组蛋白pGEX-6p-1-ORF3与抗PCV2的猪血清相互作用后,利用化学底物进行显色,可以观察到明显的特异性蛋白条带(图6),重组蛋白pGEX-6p-1-ORF3能够和PCV2阳性血清发生特异性相互作用,说明其与天然的ORF3蛋白一样,具有作为候选抗原应该具有两种特征之一,即反应原性。

图6 重组蛋白pGEX-6p-1-ORF3的Western blot检测
3 讨 论
ORF3蛋白是新发现的PCV2非结构蛋白,是近年来的研究热点。位于基因组互补链上,ORF1基因的内部,方向与ORF1基因相反[6]。Liu等采用点突变技术使PCV2 ORF3基因功能缺失,并用缺失ORF3功能的PCV2进行 PK-15细胞的感染试验以验证ORF3的功能,表明ORF3编码蛋白是在病毒复制中属非必需的蛋白,它是通过诱导细胞凋亡从而在致病性方面发挥作用。其他试验也表明,ORF3编码蛋白与 PCV2的致病性也有一定的关系,由ORF3编码的蛋白可以影响病毒衣壳蛋白在机体内的免疫效果[9]。ORF3蛋白的缺失或变异均能减弱PCV2的致病。
研究成功构建了重组质粒pGEX-6p-1-ORF3,并在大肠杆菌中诱导表达,但重组蛋白以包涵体的形式存在,需要变性、浓缩并复性。为此,本研究用Ni2N TA蛋白纯化试剂盒(QIA GEN公司),对目的蛋白进行了纯化、浓缩,浓缩后的蛋白浓度可达6.11 mg/mL,该质量浓度完全能满足后续试验需要。为了恢复重组蛋白的免疫学活性,研究利用蛋白复性试剂盒proteinrefolding kit(Novagen公司)对其进行透析复性,Western blot检测结果表明,经纯化复性的重组蛋白能够特异性的结合PCV2多克隆抗体,表明目的蛋白具有与PCV2相同的抗原性,可用于PCV2 ORF3单克隆抗体及PCV2的ELISA检测方法研究。试验通过PCR扩增得到了ORF3基因,并将其连接到了表达载体pGEX-6p-1上,得到了阳性表达质粒pGEX-6p-1-ORF3,将其转化入大肠杆菌BL21(DE3)中,但未获大量融合表达,重组蛋白以包涵体形式存在,免疫印记试验均证实重组表达蛋白具有良好的反应原性,命名为pGEX-6p-1-ORF3,为进一步研究ORF3蛋白的生物活性、功能及对PCV2致病机理的影响奠定了基础。
[1]Wu J Y,Tian H,Shang Y J,et al.Identification and pathogen characteristics analysis of a co-infection with CSFV,PRRSV and PCV2[J].Agricultural Science&Technology,2010,11(2):19-22,108.
[2]李增魁,陈婷飞.猪圆环病毒2型ORF4基因编码蛋白的体外表达[J].中国兽医科学,2008,38(10):837-841.
[3]敬晓棋,吴发兴,丛丽媛,等,猪圆环病毒2型ORF2基因的原核表达[J].西北农林科技大学学报(自然科学版),2010,38(5):8-12.
[4]陈金山,吴玉苹,陈俊杰,等.猪圆环病毒病临床表现类型及其防治[J].贵州农业科学,2010,38(9):127-128.
[5]李增魁.猪圆环病毒2型ORF3编码蛋白的体外表达[J].畜牧与兽医,2008,(9):25-30.
[6]Hamel L,Lin L L,Sachvie C,et al.PCR detection and characterization of type-2 porcine circovirus[J].Can J Vet Res.2000,64(1):44-52.
[7]杨晓农.猪圆环病毒Ⅱ型ORF1、ORF3及ORF5基因部分功能的研究[D].四川农业大学,2007.
[8]王忠田,杨汉春,郭 鑫,等.猪圆环病毒研究进展[J].中国兽医杂志,2004,40(3):33-35.
[9]蒋智勇,宋长绪,高向阳,等.猪2型圆环病毒ORF1基因的克隆及表达[J].中国兽医科技,2004,34(5):18-21.
