高活性铝基复合材料制氢技术
2012-07-05兰晓芬焦庆祝孙立贤
兰晓芬,徐 芬,焦庆祝,孙立贤,张 箭,王 爽
(1.辽宁师范大学化学化工学院,辽宁 大连 116029;2.中国科学院大连化学物理研究所,辽宁 大连 116023)
发展氢经济,离不开氢气。但氢气易燃、易爆,其在储存、运输上存在很大的安全隐患。而对于金属制氢,其原料是金属和水,它们易于保存和运输;并且可以实现氢气的即需即供,所以,金属制氢技术在为移动氢源供氢方面展现出强大的优势。在已报道的众多金属制氢技术中,铝金属因其资源丰富、价格低廉、易保存、与水反应可产生大量的氢气(25℃,1 359 mL/g),且其副产物A l(OH)3/AlOOH对环境友好、可循环利用,铝水制氢技术已引起了各国科学家的研究兴趣。但铝表面易形成致密的氧化膜,从而阻止了铝与水持续反应,因此,如何破除铝的氧化膜成为铝水制氢技术的关键。
金属Al是两性金属,碱能有效破除其表面的氧化膜。利用此性质,人们对金属铝在碱性溶液(NaOH[1]、KOH[2]、Na2SnO3[3]、NaAlO2[4])中产氢进行了研究。但碱对仪器设备具有腐蚀性,科学工作者寻求铝在中性水中产氢的可能性。Kravchenko等人[5]研究表明:通过添加其它金属(如Ga、Sn、In、Zn等),可以实现A l在中性热水中反应,产生氢气。我们采用机械球磨法制备了系列A l-Bi[6-8]、A l-Sn[9-10]合金,实现了在室温下A l与水的反应。最近的研究表明,A l与盐或金属氧化物形成复合制氢材料也可达到中性条件下制氢的目的。Mahmoodi等人[11]对A l-NaCl二元复合材料与A l-NaCl-Si/石墨/Bi三元复合材料与水反应制氢进行了研究,结果发现,70℃时,Al-NaCl-质量分数7%Bi的复合物的产氢速率达713 mL/(g·min),产率可达到100%。Dupiano等人[12]研究发现A l与Bi2O3形成的复合物与80℃的热水反应产率可以达到 100%,平均反应速率为164.2 mL/(g·min)。
就目前的研究状况看,多数铝水制氢方法的氢气产量可接近理论值,但其产氢速率还有待进一步提高,目前文献中报道的最大产氢速率,室温下为1 500mL/(g·min)、60℃时为2 000 mL/(g·min)[13]。最大产氢速率也是铝水制氢技术的一项重要指标,为了提高产氢速率,本文探讨了CuCl和SnCl2对Al水反应产氢性能的影响,研制出具有高产氢速率的铝基制氢材料。
1 实验
1.1 铝基复合材料的制备
本文采用铝粉、锌粉、钛粉、铋粉、镁粉、铬粉、镓,添加剂无水氯化亚锡,无水CuCl为原料。将各种原料粉末按一定比例放入球磨罐中混合均匀,钢球和原料粉总质量比为30∶1,取直径为10 mm的不锈钢球约磨球总质量为150 g,在充满氩气的手套箱中,将球与粉一并放入球磨罐中。采用QM-3SP2行星式球磨机,以450 r/min的转速球磨2~4 h。
1.2 产氢性能测试
在该项测试中,固定铝基复合材料粉(g)与水的体积(mL)比为1∶100,称取铝基复合材料粉末约0.1 g,放入反应器中;在注射器中装入大约10 mL的去离子水,密封反应器。然后将反应器和注射器在25℃下恒温,待温度恒定后,将注射器中的水注入反应器。产生的氢气先后经过冷凝管和干燥管,然后采用排水法收集到刻度为0.1 mL的量筒中。实验重复两次,取平均值。铝基复合材料与水反应产生氢气的体积为排出的水体积,产氢速率为单位时间内排出水的体积,而氢气产率为单位质量复合材料与水反应产生的氢气实际体积与理论体积之比。
1.3 气体产物的成分分析
在德国的GAM 200型质谱仪上进行气体产物的成分分析,将铝基复合材料与水反应所产生的气体直接导入质谱仪中,测量气体的离子峰,通过出现的各种离子峰来对气体进行定性分析。
1.4 X射线衍射(XRD)分析
在荷兰的PANalytical型X射线衍射仪上进行XRD分析。采集条件为:Cu Ka靶线,管压40 kV,管流40 mA,扫描范围分别为5°~80°和5°~90°,扫描速度为5(°)/min。
1.5 Al水反应过程中的温度和pH值的测量
将直径为1 mm的k型热电偶放入装有约50 mL去离子水的烧杯中、固定好,用来测量铝基复合材料与水反应过程中溶液温度的变化情况,用Agilent 34970A进行数据采集,每十秒记录一个数据。同时用PHS-3E型pH计监测其pH值在反应过程中的变化情况。pH计在测量前用pH缓冲剂(邻苯二甲酸氢钾25℃时pH为4.00,混合磷酸盐25℃时pH为6.86)进行校正。待仪器稳定后,将称取好的约0.5 g的复合材料粉倒入烧杯,记录溶液温度和pH的变化。
2 结果和讨论
2.1 CuCl和SnCl2的影响
文献报道了A l与NaCl[14-15]、A l与KCl[15-16]所形成的复合材料可与热水反应。本文考察了具有氧化还原性的CuCl和SnCl2分别与Al粉一起球磨所制得的Al-CuCl和A l-SnCl2复合制氢材料室温下(T=25℃)与水反应的产氢性能,结果列于表1。
由表1可知,在Al粉中掺杂等量的CuCl或SnCl2一起进行球磨,得到的Al-20%CuCl复合物的最大产氢速率和产氢率分别为174 mL/(g·min)和6.2%;而Al-20%SnCl2复合物的最大产氢速率和氢气产率分别为1 642 mL/(g·min)和50.4%。表明Al-SnCl2复合物的产氢性能均明显优于A l-CuCl复合物,且A l-SnCl2复合物与水反应产生氢气的最大速率超过文献报道的1 500 mL/(g·min)。因此,在Al中加入SnCl2有望研制出具有快速产氢性能的铝基复合制氢材料。

?
由于Al-SnCl2复合物中含有Cl元素,为验证所产生的气体中是否含有HCl或Cl2,将A l-SnCl2复合物与水反应所产生的气体直接导入到质谱仪中进行分析,结果表明:除少量水蒸气外,其余为氢气,无HCl或Cl2气体存在。这表明A l-SnCl2复合物可产生高纯氢气,可为移动氢源提供氢气。
2.2 球磨时间对Al-SnCl2复合材料产氢性能的影响
选取A l-质量分数22%SnCl2复合材料为研究对象,当球磨时间分别为1、2、3 h和4 h时,所制得的复合材料的产氢性能见图1。由图1可知,虽球磨2 h的复合物最大产氢速率可超过2 000 mL/(g·min),但其产氢率只有39.6%;而球磨3 h的复合物的产氢率可达55.9%,其最大产氢速率为1 986 mL/(g·min)。1 h和4 h的复合材料的产氢性能均不佳。综合考虑,球磨3 h的时的复合制氢材料的产氢性能最佳。
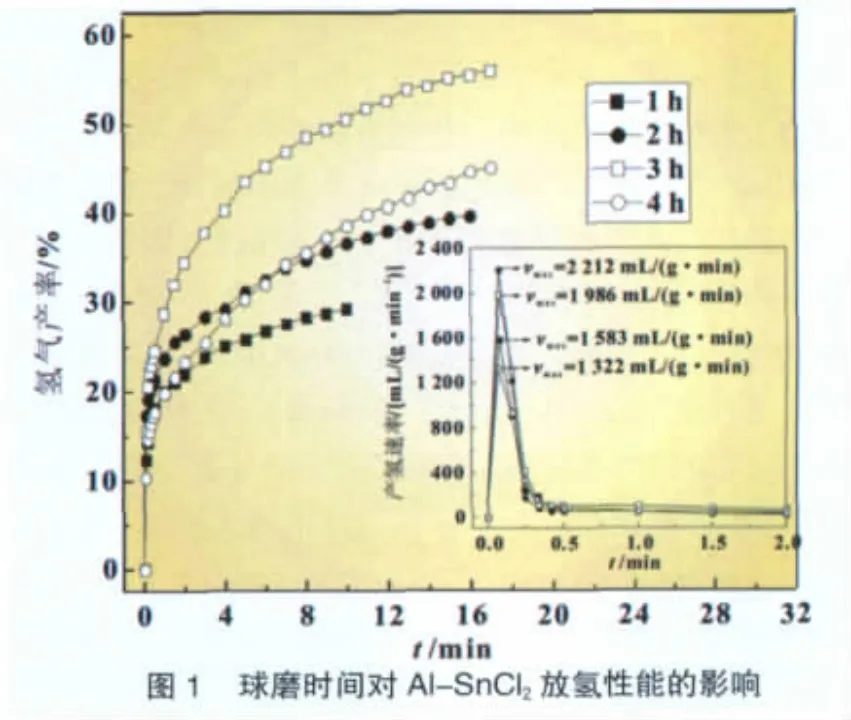
2.3 不同金属添加剂对Al-SnCl2复合材料产氢性能的影响
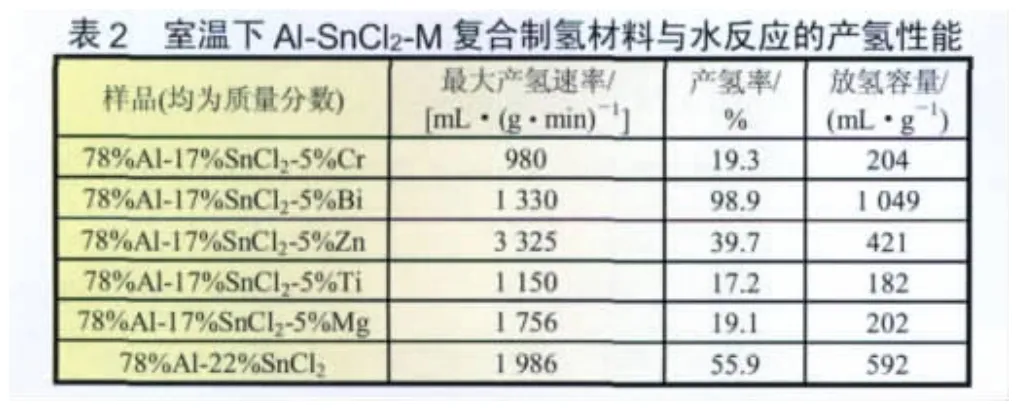
上述研究表明A l-SnCl2复合材料具有较高的产氢速率,但产氢率尚有待进一步提高。为提高该材料的产氢率,用金属(Zn、Ti、Mg、Bi、Cr)部分替代SnCl2,制成Al-SnCl2-M 三元复合材料,测试其在室温下与水反应的产氢性能(见表2)。由表2可知,在Al-SnCl2中掺杂Zn使最大产氢速率由原来的1 986 mL/(g·min)增加到3 325 mL/(g·min),但其产氢率却由原来的55.9%降到39.7%、放氢容量由原来的592 mL/g降至421 mL/g;而Cr、Ti和Mg的加入使其产氢速率由原来的1 986 mL/(g·min)分别降低到980、1 150 mL/(g·min)和1 756 mL/(g·min),氢气产率也由原来的55.9%分别降低到19.3%、17.2%和19.1%。而Bi的掺杂虽使其最大氢气产率由原来的1 986 mL/(g·min)降低到1 330 mL/(g·min),但其产氢率和放氢容量却大幅提高,其产氢率接近100%、放氢容量高达1 049 mL/(g·min)。可见,金属Bi可显著提高A l的活性,而其他金属对A l活化的作用均不明显。
?
采用质谱仪分析了A l-SnCl2-Bi复合材料所产生的气体纯度。由图2可知,所产生的气体,除少量水蒸气外,其余为氢气。
上述结果表明,Al-SnCl2-Bi复合材料与水反应可迅速产生大量纯度较高的氢气,是较理想的具有高活性的铝基复合制氢材料。
本文,同时还考察了将金属Ga掺杂到上述三元复合材料中所制得的Al-SnCl2-Bi-Ga四元复合材料的放氢性能,结果表明:在Al-SnCl2-Bi体系中增加金属Ga,所得四元铝基复合材料的放氢性能下降;且随Ga含量的增加,放氢性能降低;当Ga的含量增加至质量分数6%时,所得材料常温下几乎不与水反应。
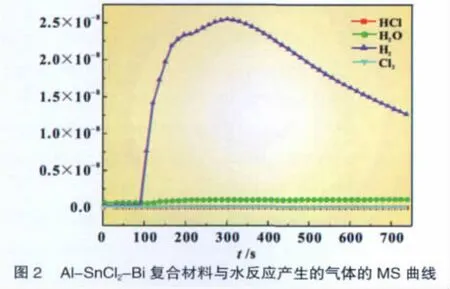
2.4 Al水反应过程中温度和pH的变化
由图3可看出,A l-SnCl2和Al-SnCl2-Bi两个体系与水反应均为放热反应,A l-SnCl2反应后温度升高8℃,Al-SnCl2-Bi反应后温度升高14℃。表明Bi的加入可使Al水反应放出的热量增加,因为A l水反应是放热反应,放的热量越多,则参加反应的A l越多;因此,这个结果与A l-SnCl2-Bi复合材料的产氢率为98.9%、A l-SnCl2的产氢率55.9%的结果相符。
从Al-SnCl2和A l-SnCl2-Bi两个体系的pH值的变化情况可知,A l-SnCl2与水(pH为4.5左右)反应过程中溶液的pH值变小,反应结束后其pH值在4.5左右。而A l-SnCl2-Bi与水反应过程中溶液的pH值变大,反应结束后其pH值在6.1左右。这表明加入Bi使溶液的pH值略有增加,即使溶液的OH-离子的浓度略有增加,导致Al-SnCl2-Bi的产氢率大于Al-SnCl2的产氢率。
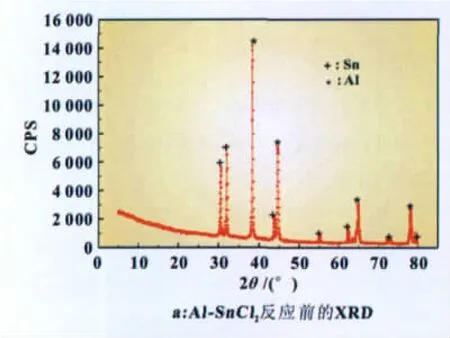
2.5 Al-SnCl2及Al-SnCl2-Bi复合材料的物相分析
本文对Al-SnCl2与A l-SnCl2-Bi复合材料与水反应前后进行了XRD分析(如图4)。对比这两个体系与水反应前后的XRD曲线,发现反应后仅Al峰消失,表明只有A l与水发生了反应;Sn和Bi反应过程中没有发生变化,它们与A l形成微型腐蚀电池,有利于A l与水的反应。

3 结论
本文研究了具有氧化还原性的CuCl和SnCl2对A l水反应产氢性能的影响。结果表明Al-SnCl2体系的产氢性能较好,其最大产氢速率可达1 986 mL/(g·min),但其产氢率不高。研究发现,可通过在A l-SnCl2体系中掺杂金属Bi来提高该体系的产氢率。实验结果表明本文所研制的制氢材料是一种具有高活性的铝基复合制氢材料,它可为移动氢源提供氢气。
[1]HIRAKI T,TAKEUCHI M,HISA M,et al.Hydrogen production from waste aluminum at different temperatures with LCA[J].Mater Trans,2005,46(5):1052-1057.
[2]SOLER L,MACANAS J,MUNOZ M,et al.Hydrogen generation from aluminum in a non-consumable potassium hydroxide solution[C]//Proceedings International Hydrogen Energy Congress and Exhibition IHEC 2005.Istanbul Turkey:2005,7:13-15.
[3]SOLER L,CANDELA A M,MACANASJ,et al.Hydrogen generation from water and aluminum promoted by sodium stannate[J].Int J Hydrogen Energ,2010,35(3):1038-1048.
[4]SOLER L,CANDELA A M,MACANAS J,et al.Hydrogen generation by aluminum corrosion in seawater promoted by suspensions of aluminum hydroxide[J].Int JHydrogen Energ,2009,34(20):8511-8518.
[5]KRAVCHENKO O V,SEMENENKO K N,BULYCHEV B M,et al.Activation of aluminum metal and its reaction with water[J].J Alloy Compd,2005,397(1):58-62.
[6]FAN M Q,XU F,SUN L X.Studies on hydrogen generation characteristics of hydrolysis of the ball milling Al-based materials in pure water[J].Int JHydrogen Energ,2007,32(14):2809-2815.
[7]FAN M Q,XU F,SUN L X.Hydrogen generation by hydrolysis reaction of Ball-Milled Al-Bialloys[J].Energ Fuel,2007,21(4):2294-2298.
[8]FAN M Q,XU F,SUN L X,et al.Hydrolysis of ball milling A l-Bi-hydride and Al-Bi-salt mixture for hydrogen generation[J].J Alloy Compd,2008,460(1/2):125-129.
[9]范美强,刘颖雅,杨黎妮,等.铝锡合金制氢技术研究[J].高等学校化学学报,2008,29(2):356-359.
[10]FAN M Q,SUN L X,XU F.Hydrogen production for microfuel-cell from activated A l-Sn-Zn-X(X:hydride or halide)mixture in water[J].Renew Energ,2011,36(2):519-524.
[11]MAHMOODIK,ALINEJAD B.Enhancement of hydrogen generation rate in reaction of aluminum with water[J].Int JHydrogen Energ,2010,35(11):5227-5232.
[12]DUPIANO P,STAMATISD,DREIZIN E L.Hydrogen production by reacting water with mechanically milled composite aluminummetal oxide powders[J].Int J Hydrogen Energ,2011,36(8):4781-4791.
[13]ILYUKHINA A V,KRAVCHENKOO V,BULYCHEV B M,et al.Mechanochemical activation of aluminum with gallams for hydrogen evolution from water[J].Int J Hydrogen Energ,2010,35(5):1905-1910.
[14]ALINEJAD B,MAHMOODIK.A novel method for generating hydrogen by hydrolysis of highly activated aluminum nanoparticles in pure water[J].Int JHydrogen Energ,2009,34(19):7934-7938.
[15]CZECH E,TROCZYNSKIT.Hydrogen generation through massive corrosion of deformed aluminum in water[J].Int J Hydrogen Energy,2010,35(3):1029-1037.
[16]OVAN J,ALFANTAZIA,TROCZYNSKIT.Enhancing aluminum corrosion in water[J].J Appl Electrochem,2009,39(10):1695-1702.
