甘精胰岛素、地特胰岛素、人胰岛素对3T3-L1脂肪细胞PPARγ2mRNA表达的影响
2012-07-05姬海涛
姬海涛,杨 静
糖尿病及其并发症对靶器官(心、脑、肾等)的损伤,严重威胁着人类的健康和生活质量。良好的血糖控制能够显著减少和延缓糖尿病并发症的发生和发展。长效胰岛素类似物延长了作用时间,无明显峰值,个体内变异小,更好的模拟了正常胰岛素的分泌。胰岛素可以提高前脂肪细胞的分化率,在前脂肪细胞转化中起着相当重要的作用。脂肪细胞的体积增大、数量增多或两者同时存在可引起脂肪组织增加。研究表明,仅少量的体重降低即可能降低糖尿病患者罹患心血管疾病的风险。目前,对胰岛素类似物的对比研究大多以临床研究为主,而基础研究甚少。胰岛素与其类似物对脂肪细胞的影响是否相同呢?本研究采用甘精、地特两种长效胰岛素类似物和人胰岛素分别诱导体外3T3-L1前脂肪细胞分化,检测PPARγ2mRNA表达的变化,探讨胰岛素对PPARγ2mRNA调节的机制。
1 材料与方法
1.1 主要实验用品与化学试剂 DMEM/F12(1∶1)培养基、胰蛋白酶购自Gibco公司;胎牛血清(FCS)购自杭州四季青生物有限公司;青霉素、链霉素购自华北制药股份有限公司;人胰岛素、3-异丁基-1-甲基-黄嘌呤(IBMX)、三碘甲状腺原氨酸(T3)、地塞米松、二甲基亚砜(DMSO)均购自Sigma公司;地特胰岛素由诺和诺德公司提供;甘精胰岛素由甘李药业有限公司提供;细胞培养板购自Corning公司;Trizol试剂购自Invitrogen公司;RT-PCR试剂盒购自Fermentas公司;Fast Start U-niversal SYBR Green Master(ROX)购自Roche公司;引物由上海生工生物工程技术服务公司合成。
1.2 实验方法
1.2.1 3T3-L1前脂肪细胞的培养和诱导分化 将3T3-L1前脂肪细胞接种于培养瓶中,用含有10%FCS的DMEM/F12培养基,置于37℃、5%CO2孵箱中培养,48h换液一次,待细胞融合生长后按1∶2传代,取同代的对数生长期细胞,将细胞按照5×104/mL接种于6孔培养板。待细胞达到90%贴壁后加入分化培养基,其中含胰岛素(每组分别含有人胰岛素、甘精胰岛素、地特胰岛素100nmol/L、500nmol/L、1 000nmol/L,另设对照组为10nmol/L人胰岛素),地塞米松250nmol/L、T3 0.2nmol/L、IBMX 0.5mmol/L,前4d用含IBMX的分化培养基,后6d用不含IBMX的分化培养基。每天观察,隔48h换液。10d后超过90%的细胞成脂肪细胞表达。
1.2.2 RT-PCR方法检测PPARγ2mRNA的表达 用Trizol试剂裂解细胞提取总RNA逆转录为cDNA,逆转录反应条件参照试剂说明。PPARγ2上游引物:5′-CTCCTGTTGACCCAGAT-3′,下游引物:5′-AATGCGAGTGGTCTTCCATC-3′,扩增片段长度:120bp;内参基因GAPDH 上游引物:5′-TGAACGGGAAGCTCACTGG-3′,下游引物:5′-TCCACCACCCTGTTGCTGGA-3′,扩增片段长度:307bp。PCR反应体系:cDNA 5.0μL,FastStart Universal SYBR Green Master(ROX)25.0μL,上下游引物各0.5μL,用DEPC-H2O补足至50μL体积。PCR反应条件:PPARγ2 95℃预变性30s,95℃变性5s,55℃退火30s,72℃延伸1min,40个循环。用Ct值表示目的基因的扩增长度,用2-△△Ct对mRNA水平进行相对定量分析。△△Ct=(△Ct目的基因-△Ct标准值),其中△Ct目的基因=Ct目的基因-Ct内参基因。实验重复3次,每组设3孔重复(N=3,n=3)。
1.3 统计学处理 采用SPSS13.0统计软件,所有数据以均数±标准差(x±s)表示,多组定量资料比较采用单因素方差分析,两两之间比较采用LSD-t检验。
2 结 果
2.1 相同胰岛素不同浓度对3T3-L1脂肪细胞PPARγ2mRNA表达的影响 以对照组(10nmol/L)mRNA表达值为1。与对照组相比,三组PPARγ2mRNA表达随胰岛素浓度的升高而增加,差异有统计学意义(P<0.05)。结果表明,人胰岛素、甘精胰岛素、地特胰岛素均可促进PPARγ2mRNA的表达,在该实验浓度范围内,基因的表达随着浓度的增加而增加。详见表1。
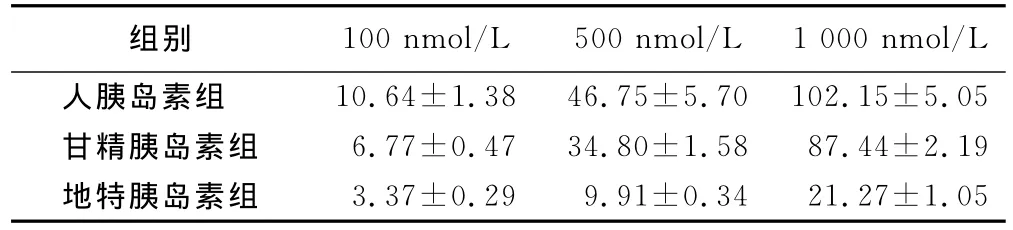
表1 相同胰岛素不同浓度对3T3-L1脂肪细胞PPARγ2mRNA表达的影响(x±s)
2.2 相同浓度下不同胰岛素对3T3-L1脂肪细胞PPARγ2 mRNA表达的影响 三组胰岛素间差异均有统计学意义(P<0.05)。相同浓度的三种胰岛素均促进PPARγ2mRNA的表达,其中人胰岛素对PPARγ2mRNA表达促进的作用最强,而地特胰岛素最弱。详见表2。
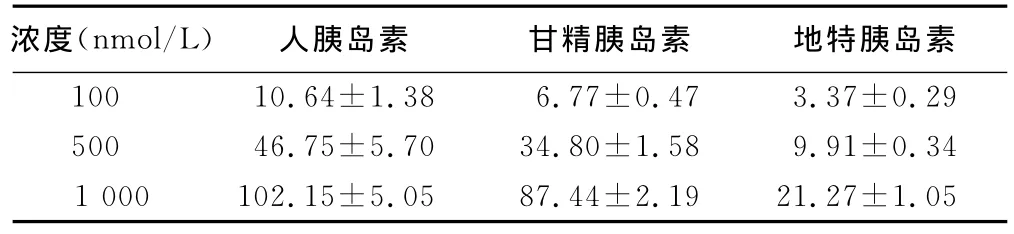
表2 相同浓度下不同胰岛素对3T3-L1脂肪细胞PPARγ2mRNA表达的影响(x±s)
3 讨 论
糖尿病治疗中胰岛素发挥着重要的作用。它能够有效地控制血糖,以预防糖尿病并发症的发生。以甘精胰岛素和地特胰岛素为代表的长效胰岛素类似物已经广泛应用于临床。他们共同的特点是通过基因工程方法产生,缓慢稳定吸收,无明显波峰波谷,变异性小,模拟了基础胰岛素的分泌。但他们在分子结构、长效机制等方面又有诸多不同。甘精胰岛素是在天然人胰岛素A链21位以甘氨酸代替天冬酰胺,B链的C末端添加了两分子精氨酸;地特胰岛素去掉了天然人胰岛素30位的苏氨酸残基,并在B链29位赖氨酸的残基上以共价键连接一个肉豆蔻酸侧链。脂肪组织可通过调节能量利用、发挥内分泌功能等在代谢调节中起重要作用。由于脂肪细胞的体积增大、数量增多或两者同时存在可引起脂肪组织增加,从而影响代谢的调节[1]。在前脂肪细胞转化成脂肪细胞中胰岛素的作用相当重要。胰岛素可以提高前脂肪细胞的分化率,促进脂肪的积聚[2]。
前脂肪细胞分化成为脂肪细胞,其过程有三个关键转录因子 PPARγ、SREBP-1C/ADD1、C/EBPs 进 行 调 控[3],其 中PPARγ最具有脂肪组织特性,并先于大多数脂肪基因而表达,是诱导脂肪分化的特异性转录因子。PPARγ的表达可以引起对数生长期成纤维细胞系的生长停滞,并且开启脂质形成,是脂肪细胞分化的必要条件[4,5],它在前脂肪细胞中不表达,其表达随脂肪细胞的分化而增加,至成熟脂肪细胞达到最高,在前脂肪细胞-脂肪细胞分化的过程中发挥重要的调控作用。PPARγ基因转录时由于启动子和拼接方式的不同而分成PPARγ1、2、3,3种亚型,其中PPARγ2主要在脂肪组织表达,因此在脂肪细胞分化过程中PPARγ2的作用尤其重要。
考虑到在脂肪细胞分化过程中胰岛素是必备条件,在本项研究中,选用加入10nmol/L的人胰岛素的分化培养基作为对照组。分别选用了100nmol/L、500nmol/L、1 000nmol/L的人胰岛素、甘精胰岛素、地特胰岛素做比较。在本实验中发现,3T3-L1前脂肪细胞分化为成熟的脂肪细胞过程中,PPARγ2 mRNA的表达随着胰岛素浓度的增高而增多,这说明了人胰岛素、甘精胰岛素、地特胰岛素均促进前脂肪细胞的分化,且分化程度随着胰岛素浓度的增加而提升;通过同浓度不同胰岛素的比较得知,人胰岛素促进前脂肪细胞分化的作用强于甘精胰岛素,而甘精胰岛素又强于地特胰岛素。Anja等[6]采用人胰岛素、地特胰岛素诱导3T3-L1前脂肪细胞,发现人胰岛素干预下的甘油-3磷酸脱氢酶活性增加了200倍,地特胰岛素对前脂肪细胞PPARγ2表达的影响弱于人胰岛素;García-Escobar等[7]的实验得出地特胰岛素对前脂肪细胞PPARγ的影响弱于甘精胰岛素及其他胰岛素类似物,表明脂肪细胞对地特的敏感性弱于其他胰岛素类似物,这些结论与本实验结果基本一致。而多项临床试验也已证实地特胰岛素可以减轻糖尿病患者胰岛素治疗引起的体重增加[8-10],考虑可能与成熟脂肪形成减少进而降低了外周脂肪含量有关。García-Escobar还认为甘精胰岛素提高了激素敏感脂肪酶(hormone senstive lipase,HSL)基因表达从而使分化增强;固醇调节元件结合蛋白1c(sterol regulatory element binding protein-1c,SREBP-1c)诱导3T3-L1细胞系表达PPAR,胰岛素可能通过影响SREBP-1c从而影响PPARγ的表达[7];脂肪细胞的分化成熟需要葡萄糖,Wada等[11]发现地特胰岛素对葡萄糖的摄取会减少用于脂肪细胞的葡萄糖;Kurtzhals等[12]实验得出人胰岛素与胰岛素受体的亲和力强于甘精胰岛素,地特胰岛素亲和力最弱。以上的观点均为胰岛素影响细胞分化的可能机制,仍有待进一步研究。
本实验通过使用不同胰岛素上调了PPARγ2基因的表达从而促进前脂肪细胞分化成为成熟的脂肪细胞,表明不同胰岛素对脂肪细胞分化的影响不尽相同,有助于结合临床根据个体差异选择胰岛素治疗。
[1] Camp HS,Ren D,Leff T.Adipogenesis and fat-cell function in obesity and diabetes[J].Trends Mol Med,2002,8(9):442-447.
[2] Sato K,Nakanishi N,Mitsumoto M.Culture condition supporting adipocyte conversion of stromal-vascular cells from bovine intramuscullar adipocyte tissues[J].J Vet Med Sci,1996,58:1073-1078.
[3] Mansen A,Guardio-Diaz H,Rafter J,etal.Expression of the peroxisome proliferator-activated receptor(PPAR)in the mouse colonic mucosa[J].Biochem Biophys Res Commun,1996,222(3):844-851.
[4] Altiok S,Xu M,Spiegelman BM.PPARgamma induces cell cycle withdrawal:Inhibition of E2F/DP DNA-binding activity via downregulation of PP2A[J].Genes Dev,1997,11:1987-1998.
[5] Berger JP,Akiyama TE,Meinke PT.PPARs:Therapeutic targets for metabolic disease[J].Trends Pharmacol Sci,2005,26(5):244-251.
[6] Anja B,Harald S,Anita MH,etal.Effect of insulin detemir,compared to human insulin,on 3T3-L1adipogenesis[J].Regulatory Peptides,2008,151:160-163.
[7] García-Escobar E,Rodríguez-Pacheco F,Haro-Mora JJ,etal.Effect of insulin analogues on 3t3-11adipogenesis and lipolysis[J].Eur J Clin Invest,2011,41(9):979-986.
[8] RašlováK,Bogoev M,Raz I,etal.Insulin detemir and insulinaspart:A promising basal-bolus regimen for type 2diabetes[J].Diabetes Res Clin Pract,2004,66:193-201.
[9] Haak T,Tiengo A,Draeger E,etal.Lower within-subject variability of fasting blood glucose and reduced weight gain with insulin detemir compared to NPH insulin in patients with type 2diabetes[J].Diabetes Obes Metab,2005,7(1):56-64.
[10] Hollander P,Cooper J,Bregnhoj J.A 52-week,multinational,open-label,parallel-group,noninferiority,treat-to-target trial comparing insulin detemir with insulin glargine in a basalbolus regimen with mealtime insulin aspart in patients with type 2diabetes[J].Clin Ther,2008,30(11):1976-1987.
[11] Wada T,Azegami M,Sugiyama M,etal.Characteristics of signalling properties mediated by long-acting insulin analogue glargine and detemir in target cells of insulin[J].Diabetes Res Clin Pract,2008,81:269-277.
[12] Kurtzhals P,Schaffer L,Sorensen A,etal.Correlations of receptor binding and metabolic and mitogenic potencies of insulin analogs designed for clinical use[J].Diabetes,2000,49:999-1005.
