新型卤酚化合物3’,4’-二羟基-3-氯二苯甲酮对大鼠缺血/再灌注心肌的保护作用
2012-07-05冯秀娥李青山
王 义,冯秀娥,赵 雷,李青山
心肌缺血/再灌注损伤(MIRI)时迅速产生的活性氧类物质会使血管内皮细胞的完整性遭到破坏,造成通透性增加,而导致水肿的发生,同时细胞核DNA被自由基攻击造成氧化伤害,这是MIRI病理过程的重要触发因素[1-3]。从海藻中提取得到的多种卤酚化合物均表现出很好的抗氧化活性。本课题组以天然来源的卤酚化合物为先导化合物,进行了结构优化和修饰,合成了系列卤酚衍生物,体外活性筛选结果显示,全新结构化合物3’,4’-二羟基-3-氯二苯甲酮(LM46)对过氧化氢损伤的人脐静脉内皮细胞具保护活性[4,5]。本实验利用在体大鼠 MIRI研究LM46可能具有的药物后处理心肌保护作用。
1 材料与方法
1.1 材料 雄性健康SD大鼠,体重230g~260g,由山西医科大学实验动物中心。HX-200动物呼吸机(成都泰盟科技有限公司);RM6240B生物信号采集处理系统,YPJO1型压力换能器(成都医疗仪器厂)。
LM46注射液由本课题组提供,Even’s blue染液购自Sigma公司;2,3,5-氯化三苯基四氮唑(TTC)染液购自 AMRESCO公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、肌酸激酶(CK)检测试剂盒均购自南京建成生物工程研究所。
1.2 方法 将实验动物随机分为6组,每组8只。即假手术组、模型组、溶剂对照组及LM46低、中、高剂量组(5mg/kg、10 mg/kg、15mg/kg)。大鼠 MIRI建立参照文献[6,7],记录正常Ⅱ导联心电图(ECG)。在动脉圆锥与左心耳之间冠状动脉左前降支(LAD)处穿线,除假手术组外,其余各组在LAD下拉紧结扎线使硅胶管压迫LAD造成血流阻断(以ECGⅡ导联ST段抬高0.1mV或T波高耸,心肌颜色变为暗红色,作为LAD结扎成功的标志)。LAD供血区域左心室左前壁缺血40min后,松开结扎线,恢复血液LAD再灌流。假手术组只穿过不结扎。再灌注过程开始1min内,模型组和假手术组静脉注射生理盐水1mL/kg,溶剂组静脉注射空白溶剂1mL/kg作为对照,LM46分别经股静脉推注相应组别实验用药物,再灌注3h。
1.3 指标检测 测定各组大鼠心脏梗死面积[8]。血清酶学指标检测,TAB法测得血清中MDA含量。LDH、CK活力测定均按照试剂盒说明书规范操作[9]。
1.4 统计学处理 计量资料以均数±标准差(x±s)表示。应用SPSS15.0软件组间单因素方差分析。
2 结 果
2.1 不同计量LM46对缺血/再灌注心肌梗死面积的影响(见表1) 危险区面积占左心室面积的百分比(AAR/LV)在各组间无统计学意义,表明在造模过程中,结扎LAD的手法稳定,各组模型的缺血程度大体相当。LM46不同剂量组心肌梗死面积占危险区面积的百分比(AN/AAR),显著小于模型组和溶剂对照组,且呈现明确的量效关系。

表1 LM46后处理对心肌梗死面积的影响(x±s)
2.2 大鼠血清SOD活力及 MDA含量的测定(见表2) 各不同给药组血清中SOD活力显著高于模型组和溶剂对照组,MDA含量显著低于模型组和溶剂对照组,且呈现明确的量效关系。

表2 LM46后处理对SOD活力、MDA的影响(x±s)
2.3 大鼠血清LDH、CK活力测定(见表3) 给药组血清中CK、LDH活力显著低于模型组和溶剂对照组,且呈现明确的量效关系。
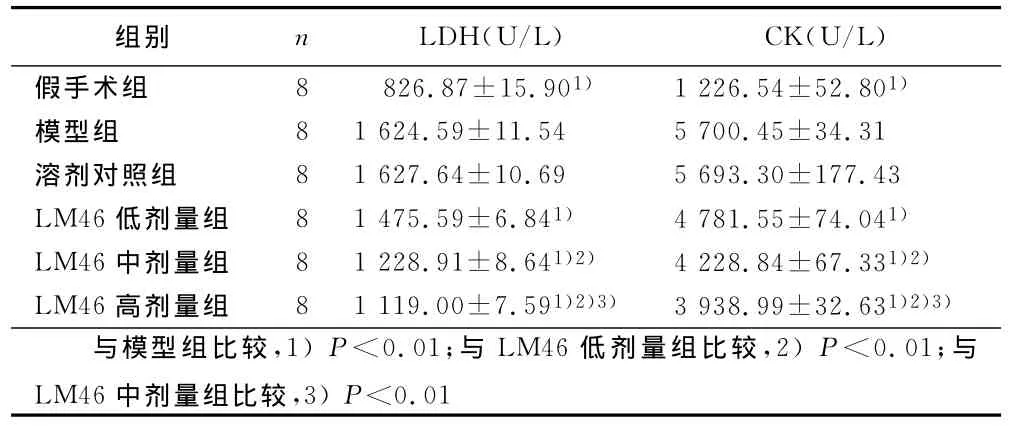
表3 LM46后处理对LDH、CK活力的影响(x±s)
3 讨 论
本研究结果显示,与模型组相比,在5mg/kg~15mg/kg剂量范围内,不同剂量LM46对大鼠MIRI具有明显的保护作用。
脂质过氧化作用及能量代谢异常是导致MIRI的重要因素。心肌缺血时,由于心肌内源性氧自由基清除剂减少。再灌注以后,分子氧再次进入心肌组织中,氧自由基水平继续上升。自由基会使血管内皮细胞的完整性遭破坏,造成通透性增加,而导致水肿的发生,同时细胞核中的DNA会被自由基攻击造成氧化伤害,甚至细胞死亡[10,11]。
心肌缺血再灌注损伤后SOD活力下降,氧自由基增多,导致氧自由基氧化不饱和脂肪酸释放的降解产物MDA含量升高,丙二醛可引起大分子物质如蛋白质、脂类等相互交联、聚合,从而破坏了细胞膜的结构和功能,使胞浆酶如CK和LDH释放增加,加速心肌细胞损害程度[12]。
本研究将本课题组首次合成的海洋卤酚化合物LM46应用于大鼠MIRI保护作用的研究。结果显示,缺血/再灌注发生时,SOD的活力明显降低,MDA含量明显升高,证明存在自由基代谢紊乱。经过LM46干预后,SOD活力升高,MDA含量下降,LDH和CK的活力明显下降,表明LM46有显著抗氧化能力,从而减轻缺血/再灌注损伤[13]。本研究针对海洋卤酚化合物应用于心血管系统疾病进行了初步探讨,为以后海洋卤酚化合物在该领域的研究打下基础。
[1] Maximilian B.Myocardial ischemia and reperfusion injury[J].Cardiovascu Pathol,2005,14(4):170-175.
[2] Dinender K,Kumar,Bodh IJ.Apoptosis and oxidants in the heart[J].J Lab Clin Med,2003,142(5):288-297.
[3] John LF.Mechanisms of cell injury by activated oxygen species[J].Environ Health Persp,1994,102(Suppl 10):17-24.
[4] Zhao Wanyi,Feng Xiue,Li Qingshan,etal.Synthesis and biological activity of halophenols as potent antioxidant and cytoprotective agents[J].Bioorg Me Che Lett,2010,20(14):4132-4134.
[5] 赵万一,冯秀娥,李青山,等.新型卤酚类化合物的合成及其体外抗氧化活性[J].中国药物化学杂志,2010,20(4):264-268.
[6] Ensheng J.Effects of phytoestrogen genistein on myocardial ischemia/reperfusion injury and apoptosis in rabbits[J].Acta Pharmacol Sin,2004,25(3):306-312.
[7] Zhang Y.Protective effect of GSTT preconditioning on myocardial ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(6):714-718.
[8] 燕炯,孔临萍,刘慧,等.Genistein后处理对大鼠缺血/再灌注心肌的保护作用[J].中西医结合心脑血管病杂志,2010,8(7):825-827.
[9] Si Kaiwei,Liu Jun,He Langchong,et al.Caulophine protects cardiomyocytes from oxidative and ischemic injury[J].J Pharmacol Sci,2010,113(4):368-377.
[10] Liang Xiaoqing,Xie Pei,Zhang Yong,et al.Effects of salidroside on myocardial ischemia/reperfusion injury in rats[J].Chin J Nat Med,2010,8(2):0127-0131.
[11] Zhou Hua,Hou Shaozhen,Luo Pei,et al.Ginseng protects rodent hearts from acute myocardial ischemia-reperfusion injury through GR/ER-activated RISK pathway in an endothelial NOS-dependent mechanism[J].J Ethnopharmacol,2011,135(2):287-298.
[12] 龚明玉,闫凤霞,刘永平,等.黄芩茎叶总黄酮对大鼠心肌缺血再灌注损伤的实验研究[J].中国中医基础医学杂志,2010,16(4):306-307.
[13] Hu Xiaorong,Zhou Xiaoya,He Bo,et al.Minocycline protects against myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1protein in rats[J].Eur J Pharmacol,2010,638(1-3):84-89.
