不同植物对矿区土壤重金属的吸收1)
2012-07-02李庚飞
李庚飞
(渭南师范学院,渭南,714000)
土壤是人类赖以生存的主要自然资源之一,也是人类生态环境的重要组成部分。但近年来,随着我国工业化的迅速发展,土壤重金属污染日益严重。粗略统计,排放到全球环境中的Cd达到2.2万t、Cu93.9 万 t、Pb78.3 万 t、Zn13.5 万 t[1]。其中,Pb、Cd、Zn的污染比较突出[2-3]。如,重庆蔬菜重金属污染程度为Cd>Pb>Hg,近郊蔬菜基地土壤重金属Cd超标率为36.7%[4]。保定市污灌区土壤中 Pb、Cd、Zn的检出超标率分别为 50%、87.5%和100%[5]。长期以来国内外学者对重金属污染治理进行了大量研究,取得了一定的治理效果,但目前传统的物理化学方法投资昂贵,修复成本极高,很难大面积推广应用[6-7]。在这种背景下重金属污染人工生态修复技术应运而生,为重金属污染土壤的治理提供了新途径[8]。本研究在对矿区排水沟附近植物全面调查的基础上,对各种植物体内所含不同重金属进行测定分析,比较矿区植物对不同重金属的富集效果,进而筛选出重金属超富集植物,为重金属污染植物修复技术的应用及矿区环境风险评估提供科学依据。
1 材料与方法
1.1 样品采集
植物样品:于2011年10月,在潼关县桐峪镇金矿废水沟周围选取生长期接近的白草(Pennisetum centrasiaticum Tzvel.)、酸模叶蓼(Polygonum lapathifolium L.)、虎尾草(Chloris virgata Swartz)和金盏银盘(Bidens pilosa L.)4种植物样品。
土壤样品:在所选植物的根系处及周围附近挖取与根系同深度的土壤,混合搅拌均匀,经四分法保留0.5 kg,装入PE塑料袋内作为待测土样。
1.2 样品处理
植物样品:将采集的植物标本按照种分类,并将每种植物的根、茎、叶分别用蒸馏水洗干净,置于恒温箱中105℃烘2 h,用FW80—微型高速万能试样粉碎机粉碎成粉,将其置于干净的袋子里并贴上标签。分别称取粉碎后的每种植物的根、茎、叶1.0 g,分别将其转至50 mL的锥形瓶中,并分别加入30 mL的消解液,过夜。第2天将加入消解液的锥形瓶置于可调电炉上恒温加热,至锥形瓶内的液体剩余3.0 mL,再加入5.0 mL 的浓HNO3,继续加热直至锥形瓶内出现白色黏稠状固体时停止加热。待其冷却后,用蒸馏水将其分别定溶至25mL,定溶后溶液为待测液,以(1+99)HNO3为对照。
土壤样品:将土壤样品在室内常温风干,去除动植物残体、石块等杂物,用玛瑙研钵将其粉碎,过100目的尼龙筛,称取1.0 g进行消解,消解处理过程同植物样品的处理。其余土壤样品装入PE塑料袋中保存。
1.3 样品测定
仪器工作条件:各处理样品均采用WFX—120型原子分光光度计进行测定。
标准曲线的绘制:配制质量浓度分别为2、4、6、8、10 mg/L的Cu标准溶液。配制质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/L Zn 和 Cd 待测标准溶液。标准曲线方程见表1。

表1 重金属元素质量浓度与吸光度的线性方程
1.4 单项元素污染指数及富集系数的计算
单项元素污染指数:Pi=Ci/Si,式中:Ci为土壤中污染元素i的实测值;Si为土壤中污染元素i的评价标准,所有元素均采用中国土壤元素平均含量为评价标准[9]。P≤0.7 表示清洁,0.7<P≤1.0 表示尚清洁,1.0<P≤2.0 表示轻污染,2.0<P≤3.0 表示中污染,P>3.0表示重污染。
富集系数(Ki)是指植物中某污染物含量占土壤中该污染物含量的比例,计算公式为Ki=Coi/Cei。式中:Coi为受检植物体内某种重金属元素的残留量;Cei为受检植物所在土壤环境中重金属的富集能力[10]。富集系数越大,则植物越易从土壤中吸收该元素,即该元素的迁移性越强[11]。
2 结果与分析
2.1 不同植物根际土壤污染程度
由表2可知,不同植物根际的3种重金属相对于背景值来说都处于污染状态,除了虎尾草和酸模叶蓼根际土壤的Zn元素处于中度污染程度外所有元素的单项污染指数都超过了严重污染的最低限度,特别是Cd污染非常严重。在4种植物的测定样区内,Cd的污染均超过了单项污染指数所规定的严重污染的100倍以上。另外,该地区的土壤中除了生长杂草之外,还种植玉米、黄豆、小麦等农作物,杂草及各种农作物产品中含有的重金属通过各级食物链在人体内富集严重威胁人类的健康,所以该地区土壤已经达到必须治理的程度。
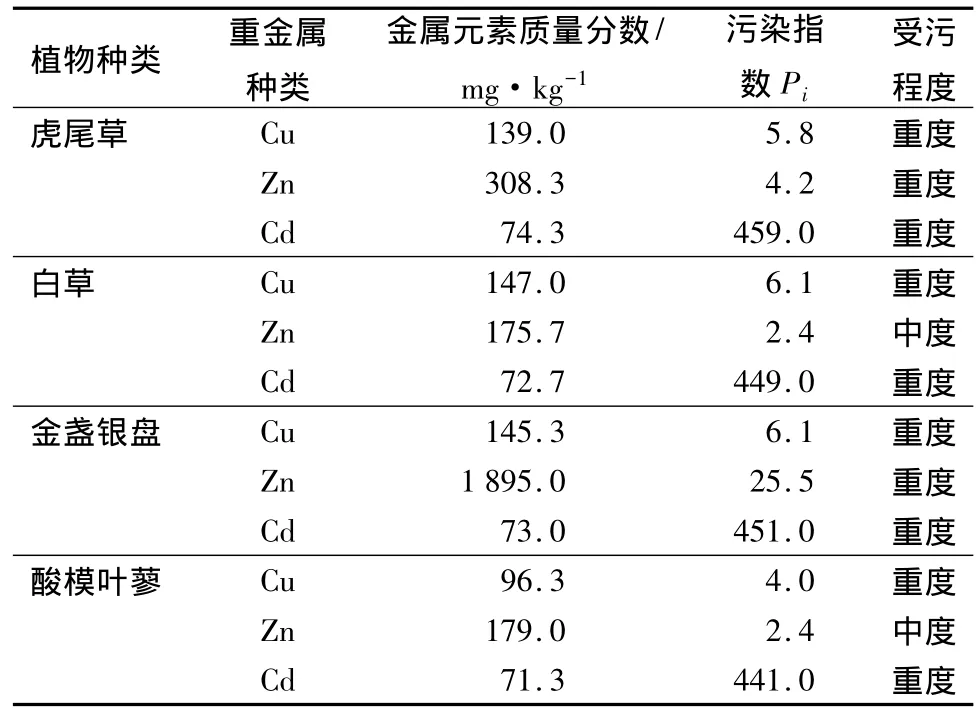
表2 矿区不同植物根际土壤重金属的污染程度
2.2 不同植物富集系数的差异
由表3可知,不同植物的富集系数不同。4种植物对Zn的富集能力均大于1。其中,白草对Zn的富集系数最大(14.77);金盏银盘对Cu的富集能力较其它3种强,富集系数(1.10)大于1;而其它几种植物对Cu的富集系数均小于1。金盏银盘和虎尾草对Cd的富集能力强于白草(0.25)和酸模叶蓼(0.12),且均大于1,特别是金盏银盘的富集系数为5.9。
2.3 不同植物重金属元素转移系数的差异
不同植物对重金属的转移能力强弱,可用根/根际、地上部分/根和Ki来表示。根/根际表示植物根系将土壤中的重金属转移并储藏在根系中的能力,地上部分/根表示根系中的重金属转移并储藏在地上部分的能力,由转移能力可知金属元素主要在植物体内的那个部位富集。
2.3.1 对Cd转移系数的差异
由表2可知,4种植物所在土壤中的Cd质量分数均已经达到了非常严重的污染程度,白草、酸模叶蓼、虎尾草和金盏银盘的Pi值分别为449.0、441.0、459.0、451.0,均在严重污染最低限值的 400 倍以上。由表3可知,金盏银盘和虎尾草的Ki值分别为5.90和1.07,相对于Cd高污染的土壤而言,这2种植物不但能够适应高Cd的逆境,且其根系对Cd的转移能力都很强。4种植物中只有金盏银盘的地上部分/根的值较高,说明金盏银盘吸收的Cd被植物根系由地下转移到了地上部分,并且主要集中在地上部分。本试验所选植物均为正常生长植物,并由表3可知,4种植物中,金盏银盘的地上部分对Cd的富集能力达到406 mg·kg-1。根据文献[12]超富集植物应该具备的3个基本特征可得,金盏银盘为对Cd的超富集植物,而其它3种植物的Cd质量分数远低于这一标准,为非超富集植物。所以,4种植物中金盏银盘是建立人工生态系统吸收Cd的首选植物。由于虎尾草体内Cd质量分数也相对较高(80.0 mg·kg-1),虽然不能作为吸收Cd的主要植物,但可以作为建立人工生态系统的伴生种,以增加生态系统的多样性,保持生态系统稳定。
2.3.2 对Zn转移系数的差异
由表3可知,白草的根/根际值和Ki均最高,且根中Zn质量分数高达1 624.6 mg·kg-1,是4种植物根系从土壤转移Zn的能力最高的,但白草的地上部分/根为4种植物中最低的,说明植物从土壤中吸收的Zn主要集中于根系,白草根系向地上部分的转移能力很弱,这可能成为限制根系吸收Zn的主要因素,如果提高根系向地上部分的转移能力,总体植株吸收Zn的能力将进一步提高。白草、酸模叶蓼、虎尾草和金盏银盘的Ki值呈降低趋势,Ki值由14.77降至1.10。就Ki值而言,白草是首选建立人工生态系统吸收Zn的植物。虽然虎尾草体内的Zn质量分数(2 720.6 mg·kg-1)略高于白草,但由表2可知,虎尾草根际土壤的污染程度Pi值为4.2,明显高于白草根际中Zn的污染(Pi值为2.4),虎尾草中较高的Zn质量分数可能是由于土壤因素造成的。所以,就植物体内的Zn质量分数而言,白草也是建立人工生态系统吸收Zn主要考虑的植物。
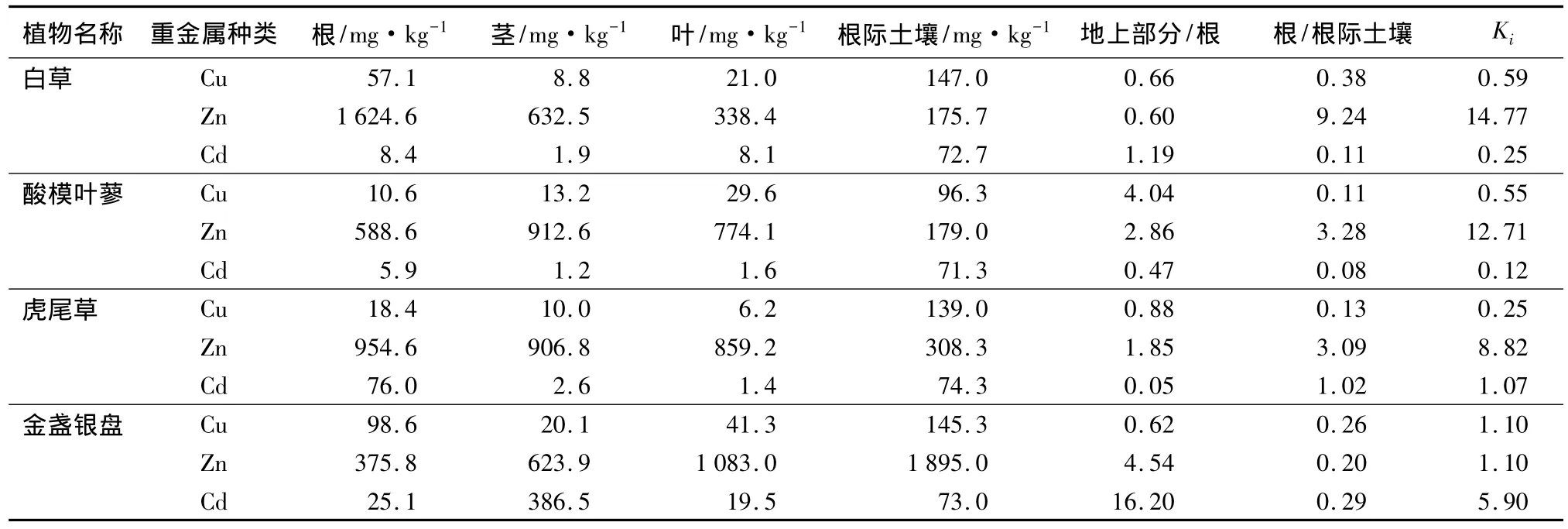
表3 植物各部分及根际土壤重金属的质量分数
2.3.3 对Cu转移系数的差异
由表2可知,4种植物根际土壤中Cu均较高,白草、酸模叶蓼、虎尾草和金盏银盘的Pi值分别为6.1、4.0、5.8、6.1,均大于 3,已经达到了重度污染的程度。又由表3可知,金盏银盘体内有相对较高的Cu(160 mg·kg-1),地上部分/根值较低,根系向地上部分的转移能力较弱,Cu主要分布于植物根系。酸模叶蓼中Cu质量分数的地上部分/根大于其他3种植物,地上部分的含Cu量甚至高达根系中的4倍,说明酸模叶蓼根系对Cu向地上部分的转移能力很强,但植物体内的总体Cu质量分数较低,仅为53.4 mg·kg-1,且4种植物的 Ki值非常低,最大值为1.10(金盏银盘),最小值仅为0.25(虎尾草),说明所选的4种植物都不是理想的建立人工生态系统吸收Cu的植物,还需要到污染基地进一步调查其它植物。
3 结论与讨论
植物对重金属的抗性,即植物能生存于某一特定的含量较高的重金属环境中,而不会出现生长率下降或死亡等毒害症状[13]。植物对重金属抗性的获得有避性和耐性2种途径。一些植物可通过某种内部机制保护自己,使其生长在高含量的重金属环境中,但并不吸收或很少吸收重金属,此为避性。由于避性的存在使一些植物能够在较高质量浓度的重金属逆境中生长良好。所以,研究中有一些植物体内的重金属质量分数并不高,但也被列入试验范围,主要是为了建立人工生态系统治理重金属污染时,这些植物可以在高污染条件下正常生长,对于增加生态系统多样性,并保持生态系统稳定性具有重要意义。
试验中的4种植物是在金属矿区沿排水沟周围选取的,因此,不同植物根系周围重金属含量存在差异。由表2可知,虎尾草的根际土壤中Zn质量分数高于白草的,且由表3可得,虎尾草体内的Zn质量分数为2 720.6 mg·kg-1,高于白草体内的Zn质量分数(2 595.5 mg·kg-1),与潘春龙等[14]研究相符,即植物生长在不同重金属含量的土壤或水体中,只要不超过植物的吸收限值,植物体内的重金属质量分数有随着土壤中重金属质量浓度的增加也相应增加的趋势。
4种植物体内的Zn质量分数均较高,且Ki值也很高,特别是白草的Ki值高达14.77,但由于白草体内的Zn主要分布在植物根系,很少一部分向地上部分转移,地上部分都没有达到超富集植物对Zn要求的 10 000 mg·kg-1[12],所以都不是超富集植物(对Zn)。白草只能作为建立人工生态系统的伴生种,而不能筛选为吸收Zn的主要植物种类。就4种植物对Cu的吸收来说,均远低于超富集植物对Cu的要求(1 000 mg·kg-1)[12],都不是建立人工生态系统对Cu吸收的植物。
[1]Singh O V,Labana S,Pandey G,et al.Phytoremediation:an overview of metallic ion decontamination from soil[J].Appl Microbol Biotechnol,2003,61:405-412.
[2]杨科璧.中国农田土壤重金属污染与其植物修复研究[J].世界农业,2007(8):58-61.
[3]黄勇强,厉晶晶.高速公路路域土壤重金属污染及植物修复研究进展[J].安徽农业科学,2009,37(7):3216-3218.
[4]唐书源,李传义,张鹏程,等.重庆蔬菜的重金属污染调查[J].安全与环境学报,2003,3(6):74-75.
[5]谢建治,刘树庆,王立敏,等.保定市郊土壤重金属污染现状调查及其评价[J].河北农业大学学报,2002,25(1):38-41.
[6]韩照祥.植物修复污染水体和土壤的研究进展[J].水资源保护,2007,23(1):9-12,21.
[7]张建梅.植物修复技术在环境污染治理中的应用[J].环境科学技术,2003,26(6):55-57.
[8]魏树和,周启星.重金属污染土壤植物修复基本原理及强化措施探讨[J].生态学杂志,2004,23(1):65-72.
[9]中国环境检测总站.中国土壤元素背景值[M].北京:中国环境出版社,1990.
[10]Mattina M I,Lannucci-Berger W,Mussante C,et al.Concurrent plant uptake of heavy metals and persistent organic pollutants from soil[J].Environmental Pollution,2003,124(3):375-378.
[11]Salt D E,Blaylock M,Kumar N P B A,et al.Phytoremediation:a novel strategy for the removal of toxic metals from the environment using plants[J].Nat Biotechnol,1995,13(5):468-474.
[12]Channy R L,Malik M,Li Y M,et al.Phytoremediation of soil metals[J].Current Opimons in Biotechnology,1997,8:279-284.
[13]Tomsett A B,Thurman D A.Molecular biology of metal tolerances of plants[J].Plant Cell Environ,1988,11:383-394.
[14]潘春龙,何谨.水生植物在含Cr废水处理中的作用[J].云南环境科学,2006,25(3):34-35.
