甘草酸二铵对人肝癌细胞SMMC-7721增殖和p53表达的影响*
2012-06-29张剑锋李超乾赵春菱唐华民严若谷
张剑锋,李 浩,李超乾△,赵春菱,唐华民,严若谷
(广西医科大学第一附属医院:1.急诊科;2.研究生院,南宁530007)
甘草酸二铵(diammonium glycyrrhizinate,DG)是从中药甘草(glycyrrhiza)中提取的一种有效活性单体化合物[1],具有较强的抗炎、抑制肝纤维化和肝炎病毒增殖的作用[2-6]。据国内外文献报道,长期使用复方甘草酸苷能预防肝硬化的发生,且明显减少肝癌的发病率[7-8],但DG对肿瘤是否具有抑制增殖作用,目前尚缺乏相关研究。本实验拟通过体外实验,探讨DG对人肝癌细胞株SMMC-7721细胞体外增殖的抑制作用,以及其对抑癌基因p53表达的影响。
1 材料与方法
1.1材料 人肝癌细胞SMMC-7721购自中国科学院上海细胞库,DG注射液购自江苏正大天晴制药有限公司;RIPM1640培养液购自Thermo Scientific公司,胎牛血清购自杭州四季青生物工程材料技术有限公司,琼脂糖购自上海生工生物工程技术服务有限公司,Trizol购自美国Invitrogen公司,PCR扩增引物购自上海生工生物工程技术服务有限公司,逆转录试剂盒购自美国Promega公司,蛋白提取试剂购自上海碧云天生物技术研究所,鼠抗-p53单克隆抗体购自美国Santa Cruz公司,辣根过氧化物酶(HRP)标记抗小鼠IgG购自北京中杉金桥试剂公司。CO2培养箱购自美国Forma scientific Inc公司,超净工作台购自苏州净化设备厂,酶联免疫检测仪Model-450购自美国Bio-Rad公司,倒置相差显微镜购自日本Olympus公司,Gel doc 2000凝胶成像分析系统购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养及分组 肝癌细胞用含10%胎牛血清的RPMI1640培养基培养,并加入青霉素100U/mL,链霉素100 μg/L,置于37℃含5%CO2孵箱中培养。实验用细胞均处于对数生长期,常规苔盼蓝计数活细胞大于95%。实验细胞分为对照组及DG干预组,其中对照组(DG 0)未采用任何药物干预,而DG干预组则加入DG终浓度分别为0.50、1.00、2.00、4.00、8.00、16.00mg/L进行共同孵育。
1.2.2MTT法测定细胞增殖抑制率 取处于对数生长期的细胞用胰蛋白酶消化后,离心,接种于96孔板,培养12h,分别加入不同浓度DG,孵育48h后加入10μL MTT(5mg/mL),继续培养4h后加入二甲基亚砜(DMSO)150微升/孔,酶标仪570nm/630nm测定吸光度值(OD值),计算细胞存活率。存活率(%)=用药组OD值/对照组OD值×100%。用软件B1iss计算IC50。
1.2.3实时荧光定量PCR测定p53基因的表达
1.2.3.1引物设计与合成 从Gene Bank中查找p53及内参GAPDH基因的全长序列,采用软件Primer5.0和oligo 6.0设计上、下游引物。p53 上游:5′-GGC CCA CTT CAC CGT ACT AA-3′,下游:5′-GTG GTT TCA AGG CCA GAT GT-3′;GAPDH 上游:5′-AAC GGA TTT GGT CGT ATT G-3′,下游:5′-CTG GAA GAT GGT GAT GGG-3′,并通过 Gene Bank进行blast比对。
1.2.3.2样品制备 收集 DG 0.00(对照组)、2.00(低浓度组)、4.00(中浓度组)、8.00(高浓度组)mg/L处理48h后的SMMC-7721细胞,采用总RNA提取试剂盒提取细胞总RNA,然后逆转录成cDNA,得到的样品作为PCR模板。
1.2.3.3RT-PCR法检测p53mRNA表达 RT-PCR反应体系反应条件为:95℃5min,95℃30s,59℃45s,72℃30s,共40个循环。测定样品p53和GAPDH的Ct值,△Ct=Ct目的基因-Ct内参基因。根据△△Ct=△Ct干预组-△C对照组,计算
1.2.4Western blot测定p53蛋白表达 收集经DG预处理的细胞,加入0.20mL蛋白裂解液冰上裂解30min,4℃12 000r/min离心30min,取上清液,测定蛋白样品浓度,取60 μg总蛋白上样,100℃5min,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)2h,加入鼠抗人p53单克隆抗体,4℃孵育过夜,加入HRP标记抗鼠IgG,同时加入HRP标记鼠抗GAPDH的单克隆抗体作为内参。室温孵育1h,暗房进行压片、显影、定影,底片经LEICA Q2550IW图像处理系统分析,测定各条带的光密度值,进行定量分析[9]。
1.3统计学处理 采用SPSS13.0统计软件进行分析,实验数据用s表示,运用t检验,以P<0.05为差异有统计意义。
2 结 果
2.1DG对SMMC-7721细胞增殖的影响 DG对SMMC-772l细胞具有明显的增殖抑制作用。DG呈浓度依赖性降低细胞的存活率(图1)。DG剂量为4.00、8.00、16.00mg/L时其抑制率分别为44.52%、66.78%、91.24%。倒置显微镜下观察,与对照组比较,DG作用后,细胞形态逐渐变得不规则,细胞质内出现空泡,大部分细胞贴壁不良,细胞膜出现皱缩、细胞变圆、脱落凋亡,且此现象随着DG浓度增大而更为明显,DG 0、2.0、4.0、8.0mg/L作用细胞48h显微镜观察图片见图2。DG作用SMMC-772l细胞48h的IC50值为(4.31±0.21)mg/L。
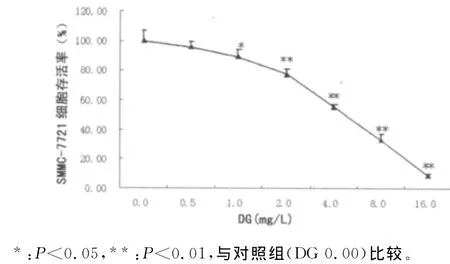
图1 DG对SMMC-7721细胞增殖的抑制作用
2.2p53mRNA表达水平的变化 DG 2.00、4.00、8.00mg/L预处理48h后,p53mRNA表达明显上调,分别为2.12±0.186、2.56±0.102、2.68±0.211,与对照组(1.08±0.211)比较,差异均有统计学意义(P<0.01)。
2.3p53蛋白表达的变化 与对照组比较,DG (2.00、4.00、8.00mg/L)预处理SMMC-7721细胞48h后,p53蛋白表达明显提高,见图3。

图2 各组SMMC-7721细胞显微镜观察图像(10×10)
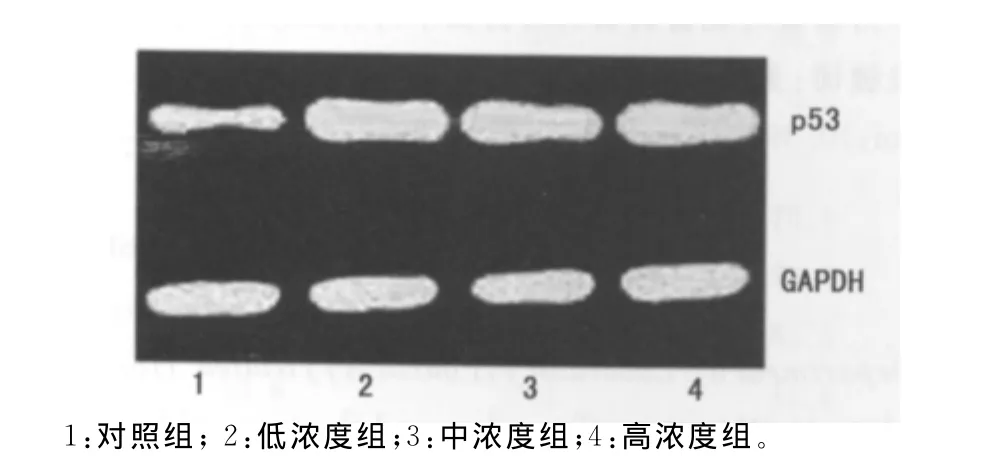
图3 Western blot检测p53蛋白表达
3 讨 论
肝癌为世界上恶性程度极高的恶性肿瘤之一,其预后极差。每年全球约有125万人患病,而在我国肝癌处于恶性肿瘤病死率的第2位,广西尤其为肝癌高发地区,对人民群众健康造成极大威胁。近年来,肝癌的病因学研究已取得很大进展,认为肝癌的发生是在遗传易感性的基础上,各种环境致癌因子的作用,以致体细胞多种原癌基因激活及抑癌基因的失活,最终导致细胞生长、增殖、分化发生紊乱的结果[10]。如能寻找有效药物抑制原癌基因激活或者抑癌基因的失活,则可能对肝癌的治疗效果有显著提高。
DG是从中药甘草中提取的一种有效成分,现代研究表明,DG具有抗炎,抗病毒(肝炎病毒、艾滋病病毒等),防治肿瘤和保护肝细胞等多方面作用[11-13],临床应用广泛。但其对肝癌细胞增殖是否有抑制作用,目前未见相关报道。本实验采用不同浓度的DG作用于肝癌细胞SMMC-7721,MTT法测定结果显示细胞生长受到明显的抑制,作用细胞48h后的IC50值为(4.31±0.21)mg/L,表明DG具有较强抑制肿瘤细胞增殖作用,且这种抑制作用具有浓度依赖性。
为了进一步阐明DG抑制肝癌细胞增殖的作用机制,本实验选取了与肝癌发生过程有着密切联系的p53基因进行分子水平研究。p53基因与肿瘤发生有很高的相关性[14]。本研究结果显示,DG上调了p53基因及其蛋白的表达,但其具体调节机制尚未明确。p53是细胞凋亡反应和细胞周期调控的重要因子,在人类多种肿瘤中均具有较高的突变率,将p53用于肿瘤基因治疗可能具有潜在应用价值。不少证据表明p53与肝癌发生的过程有着密切的联系[15-16]。本研究小组将对DG调控p53的具体调节机制进一步研究,下一步将建立肝癌在体动物模型,以证实DG对肝癌作用的特异性与有效性,以期尽早明确DG对肝癌的可能治疗作用及其机制。
综上所述,DG能明显抑制肝癌细胞的过度增殖,其可能通过上调p53基因和蛋白表达,加速细胞凋亡,从而达到抑制肿瘤细胞恶性增殖的效果,但其对p53的具体调控机制尚待进一步研究明确。
[1]Wu P,Zhang Y,Liu Y,et al.Effects of glycyrrhizin on production of vascular aldosterone and corticosterone[J].Horm Res,1999,51(4):189-192.
[2]万军,何基德.甘草酸二铵注射液联合肝炎灵注射液治疗慢性乙型肝炎的疗效[J].浙江中医药大学学报,2007,31(3):319-321.
[3]观晓辉.甘草酸二铵联合丹参治疗高原地区慢性乙型肝炎的疗效观察[J].现代中西医结合杂志,2005,14(12):1541-1542.
[4]苏菡.甘草酸二铵注射液联合多烯磷脂酰胆碱治疗脂肪肝临床观察[J].中外健康文摘,2007,4(8):128-130.
[5]刘思纯,马博.甘草酸二铵治疗急性药物性肝损伤的疗效观察[J].中国处方药,2006,55(10):62-64.
[6]许伟华,刘斌,林森,等.甘草酸二铵治疗肝纤维化的动态观察[J].中国新药与临床杂志,2003,22(6):352-354.
[7]余细球,程芳洲,何小飞.甘草酸二铵三七总苷等联合治疗活动性肝硬化[J].医药导报,2002,21(4):210-212.
[8]Arase Y,Ikeda K,Murashima N,et al.The long term efficacy of glycyrrhizin in chronic hepatitis C patients[J].Cancer,1997,79(8):1494-1500.
[9]Kettritz R,Choi M,Rolle S,et al.Integrins and cytokines activate nuclear transcription factor-kappa B in human neutrophils[J].J Biol Chem,2004,279(4):2657-2665.
[10]肖文华,刘为纹,房殿春,等.重庆地区肝细胞癌p53基因突变模式的研究[J].重庆医学,2001,30(5):392-393.
[11]Takei M,Kobayashi M,Li XD,et al.Glycyrrhizin inhibits R5HIV replication in peripheral blood monocytes treated with 1-methyladenosine[J].Pathobiology,2005,72(3):117-123.
[12]Cinatl J,Morgenstern B,Bauer G,et al.Glycyrrhizin,an active component of liquorice roots,and replication of SARS-associated coronavirus[J].Lancet,2003,361(9374):2045-2046.
[13]Sato H,Goto W,Yamamura J,et al.Therapeutic basis of glycyrrhizin on chronic hepatitis B[J].Antiviral Res,1996,30(2/3):171-177.
[14]Melissa RJ,Anthony NK,Daniel G,et al.Selective activation of p53-mediated tumour suppression in high-grade tumors[J].Nature,2010,468(7323):567-571.
[15]陈漫霞,陈思东,陈漫容,等.原发性肝细胞癌拓扑异构酶Ⅱα表达及其与p53和AFP之间的关系[J].重庆医学,2011,40(26):2625-2628.
[16]余舒亮,王东,张沁宏,等.重组人p53腺病毒增强肝癌放疗敏感性的实验研究[J].第三军医大学学报,2009,31(9):784-786.
