辛基酚对成年雄性小鼠血浆和脾脏抗氧化功能的影响
2012-06-29司丽芳位志国薛帮群李梦云陈树林
李 健,司丽芳,位志国,薛帮群,李 翔,位 兰,李梦云,陈树林
(1.河南科技大学动物科技学院,河南 洛阳 471003;2.西北农林科技大学动物医学院,陕西 杨凌 712100)
随着工业化的发展,环境雌激素的污染对人畜健康构成极大的威胁,关系着人类的健康、生存与繁衍。辛基酚(octylphenols,OP)是一种具有较强雌激素活性的精细烷基酚类化合物,广泛应用于生产非离子表面活性剂、增塑剂、热稳定剂、石油添加剂等;存在于环境中的水体、淤泥、土壤、食物如鱼类、贝类及饮用水中;还可生产油溶性酚醛树脂、橡胶、硫化剂、印刷油墨、涂料以及配制防锈剂等[1-2]。研究发现OP具有雌、雄性生殖毒性、细胞毒性、致癌、发育毒性作用[3],生殖损伤常伴随抗氧化酶的活性异常[4-5]。在生理情况下,生物体内产生的少量活性氧(ROS)和一氧化氮(NO),在细胞生长调节、信号传递以及抗微生物防御和免疫监视方面具有重要作用,但当ROS和NO产生过多时,则可诱导细胞凋亡[6-8]。脂质过氧化物通过促进线粒体和内质网中Ca2+释放,激活钙依赖的内源性核酸酶,导致DNA断裂、染色质浓缩,引起细胞凋亡,线粒体产生的ROS又可以作用到线粒体,使细胞色素C释放,激活caspase-9,引起细胞凋亡级联反应[9]。多种因素能够造成组织ROS增加,环境雌激素引起的ROS蓄积受到人们的广泛关注。辛基酚对小鼠抗氧化功能的影响的相关报道很少。本试验通过采用辛基酚处理成年小鼠,研究体内抗氧化系统的变化,探讨辛基酚与ROS的关系,为阐明环境雌激素辛基酚的毒性作用机理提供依据。
1 材料与方法
1.1 材料
辛基酚(OP),Sigma产品。超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒,谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒,总抗氧化能力(total antioxide capacity,TAOC)测定试剂盒,丙二醛(malondialdehyde,MDA)测定试剂盒,考马斯亮蓝蛋白测定试剂盒等,均为南京建成生物工程研究所产品;20只成年雄性昆明小鼠,平均体重30g±2g,郑州大学实验动物中心。
1.2 方法
1.2.1 动物处理 小鼠自由采食、饮水,每天14h光照,10h黑暗的条件下进行饲喂。经7d适应饲养后。辛基酚处理:随机分为4组,每组5只,分别灌胃0、1、10、100mg/kg辛基酚,对照组灌胃橄榄油50μL/只,每天1次,连续1周。
1.2.2 样品测定 动物处理结束后,将小鼠麻醉处死。采血,3500r/min离心10min,分离血浆,分装,置-20℃保存。取脾在冷生理盐水中漂洗,除去血液,滤纸拭干,放入小烧杯内,尽快用眼科剪剪碎,加入9倍冷生理盐水(先加2/3的量),倒入玻璃匀浆器中,用剩余1/3的生理盐水冲洗烧杯,倒入匀浆器,上下研磨4min左右,使组织匀浆化。然后倒入离心管,3000r/min离心10min~15min,取上清分装后于-20℃保存。
本试验分别测定血浆和脾组织中SOD、GSHPx、T-AOC、MDA、NO的含量,操作步骤严格按照试剂盒说明书进行。
1.2.3 数据统计 使用SPSS12软件包进行单因素方差分析,最小显著极差法(LSD法),对差异显著的数据进行多重比较,数据以均值±标准差(Mean±SD)表示。
2 结果
2.1 血浆和脾组织中SOD含量
辛基酚显著降低了血浆中SOD的水平,10、100 mg/kg组比对照组分别下降30.3%(P<0.05)、55.6%(P<0.01)(图1A)。高剂量辛基酚组脾中SOD含量均显著下降(P<0.05),1、10、100mg/kg组比对照组分别下降16.4%(P>0.05)、33.3%(P<0.01)、31.5%差异极显著(P<0.05)(图1B)。
2.2 血浆和脾组织中GSH-Px含量
辛基酚显著降低了血浆中GSH-Px的水平,10、100mg/kg组比对照组分别下降17%(P<0.01)、28.4%(P<0.01)(图2A)。10、100mg/kg剂量辛基酚组脾中GSH-Px含量均显著下降26.4%(P<0.05)、39.3%(P<0.01)(图2B)。
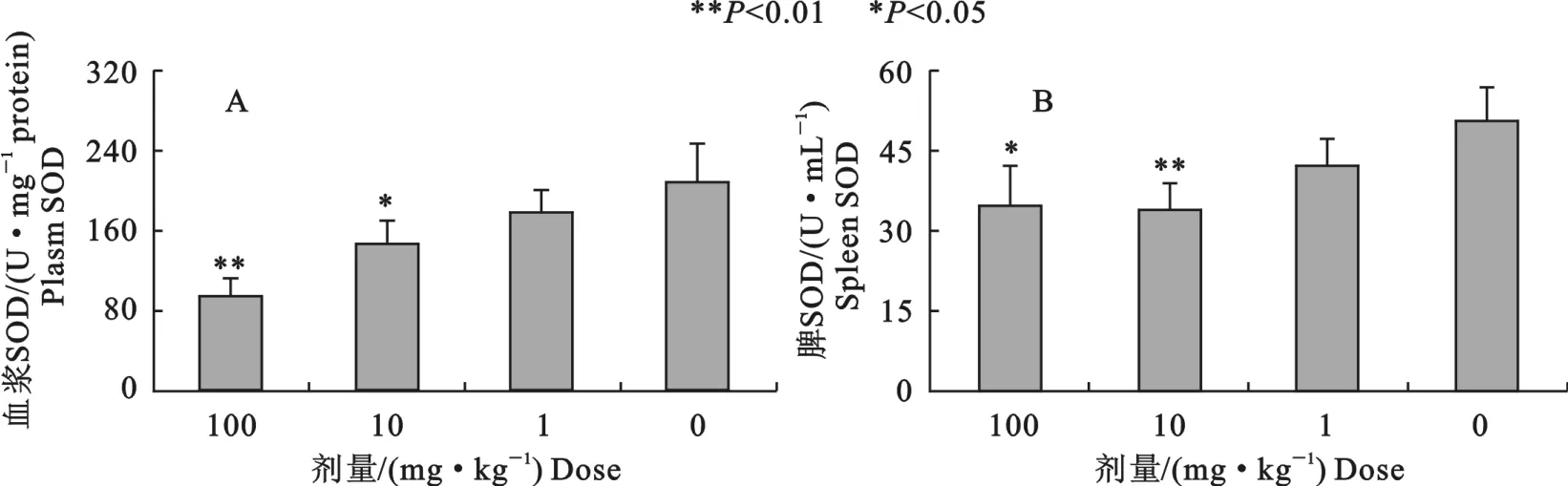
图1 不同剂量辛基酚对小鼠血浆和脾组织中SOD含量的影响Fig.1 Effects of octylphenol on SOD content in plasma and spleen of mice
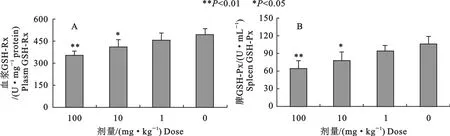
图2 不同剂量辛基酚对小鼠血浆和脾组织中GSH-Px含量的影响Fig.2 Effects of octylphenol on GSH-Px content in plasma and spleen of mice
2.3 血浆和脾组织中T-AOC含量
10、100mg/kg辛基酚组显著降低了血浆中TAOC的水平,比对照组分别下降29.3%(P<0.01)、37.8%(P<0.01)(图3A)。不同剂量辛基酚组脾中 T-AOC含量均显著下降,10、100mg/kg组比对照组分别下降39.9%、41.3%,差异均极显著(P<0.01)(图3B)。
2.4 血浆和脾组织中MDA含量
辛基酚显著升高了血浆中MDA的水平,10、100mg/kg组比对照组分别升高14.8%(P>0.05)、40.7%(P<0.01)(图4A)。10、100mg/kg剂量辛基酚组脾中MDA含量也有一定的升高,比对照组分别升高46%(P>0.05)、48.7%(P<0.05)(图4B)。
2.5 辛基酚对血浆和脾组织中NO含量的影响
如图5所示,辛基酚显著升高了血浆中NO的水平,10、100mg/kg组比对照组分别升高75%(P<0.05)、82.1%(P<0.05)(图5A)。高剂量辛基酚组脾中NO含量均显著升高,10、100mg/kg组比对照组分别升高118%、123%,差异均极显著(P<0.01)(图5B)。
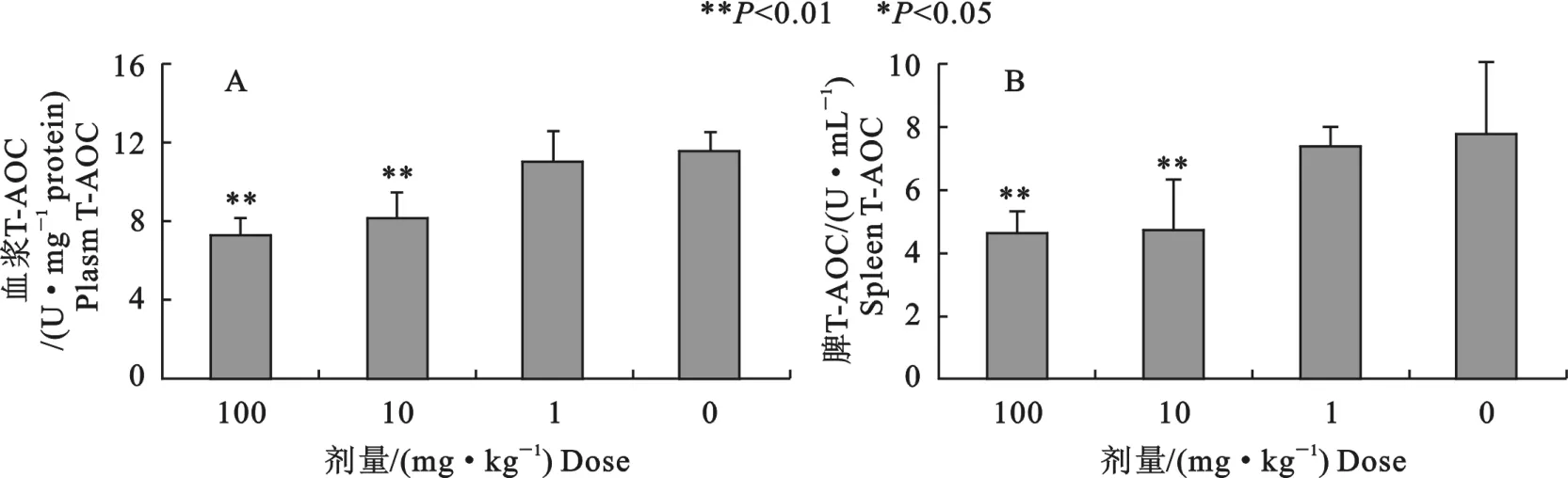
图3 不同剂量辛基酚对小鼠血浆和脾组织中T-AOC含量的影响Fig.3 Effects of octylphenol on T-AOC content in plasma and spleen of mice

图4 不同剂量辛基酚对小鼠血浆和脾组织中MDA含量的影响Fig.4 Effects of octylphenol on MDA content in plasma and spleen of mice
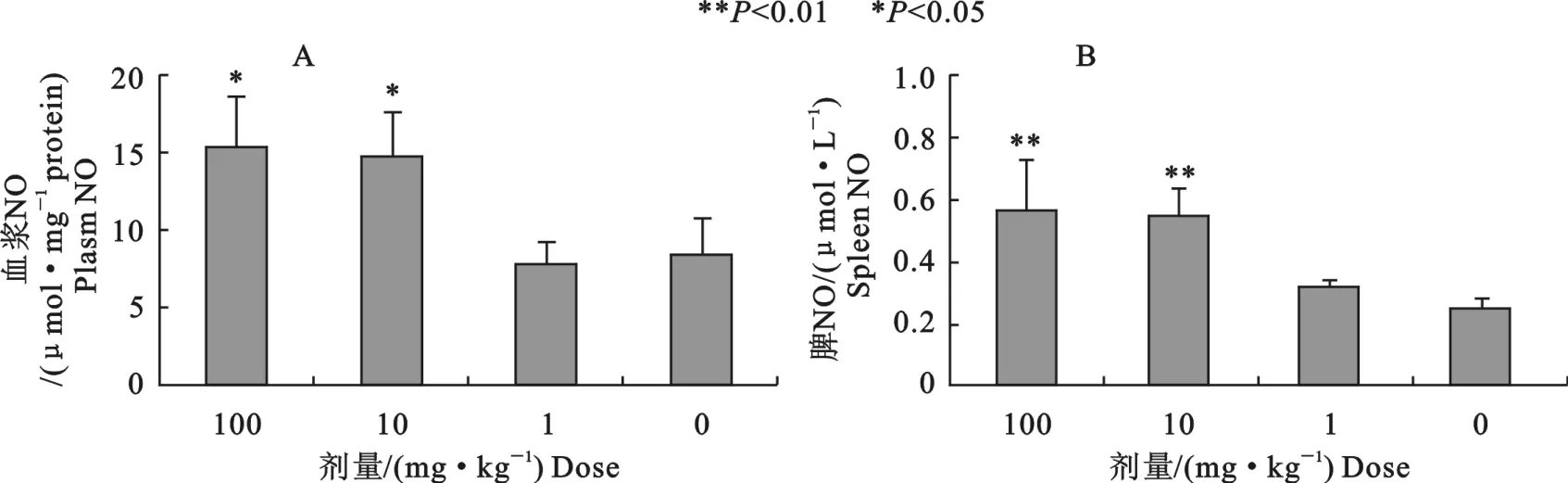
图5 不同剂量辛基酚对小鼠血浆和脾组织中NO含量的影响Fig.5 Effects of octylphenol on NO content in plasma and spleen of mice
3 讨论
活性氧(reactive oxygen species,ROS)是体内一类氧的单电子还原产物,与一些可以产生氧自由基的化合物如醌类化合物直接作用与细胞,打破细胞内环境的稳态,导致细胞代谢平衡遭到彻底破坏,造成细胞坏死或凋亡,进而导致器官发育异常。有研究报道,不同浓度的活性氧对细胞的作用不同,纳摩尔水平的ROS可促进细胞增殖,微摩尔水平的ROS可导致细胞凋亡,毫摩尔水平的ROS引起细胞的损伤死亡[10]。王鲜忠等[11]利用 H2O2模拟细胞内的 ROS环境,发现H2O2通过不依赖于微丝途径和降低细胞内抗氧化能力使细胞内ROS处于较高水平,并通过ERK级联,使细胞中微丝发生多聚化,破坏微丝的结构。清除ROS的抗氧化防御体系分为酶系和非酶系,如SOD、CAT、GPx、GSH-Px和维生素C和E、还原型谷胱甘肽(GSH)等[12]。Mishra D P等[13]证实,环境雌激素引起ROS大量增加,从而造成严重的生殖损伤。马爱团等[14]用乙烯雌酚处理仓鼠发现通过降低抗氧化酶SOD、GSH、GSH-Px活性,增加ROS含量,干扰生精细胞正常功能,导致细胞死亡。多氯联苯处理大鼠导致脾支持细胞的活性氧显著增加,而抗氧化维生素E和C能够增强抗氧化功能,减轻支持细胞的氧化损伤[15]。
辛基酚导致体内抗氧化系统的明显受损,随剂量的增加而明显降低抗氧化酶活性。血浆和脾NO含量显著升高,SOD、GSH-Px抗氧化酶活性显著下降。SOD是清除氧自由基最重要的酶之一,由于SOD的下降造成产生的过量ROS不能及时清除,从而损伤细胞的正常功能。辛基酚引起GSH-Px活性下降后,不能及时清除代谢产生的H2O2和脂质过氧化物。T-AOC代表体内酶类和非酶类抗氧化物的总体水平,是反映机体抗氧化作用的重要指标。T-AOC明显降低与抗氧化酶活性降低的结果相一致。MDA是细胞膜上的不饱和脂肪酸受到自由基攻击后形成的一种脂质过氧化物,MDA的含量常被用来反映体内脂质过氧化的程度,从而反映细胞损伤的程度。高浓度NO具有很强的氧化自由基特性,损害细胞膜脂质,抑制呼吸链,造成组织的损伤。应用辛基酚后,组织中MDA、NO含量显著升高(P<0.05或P<0.01)。说明辛基酚导致血浆和脾组织氧化与抗氧化系统的破坏,产生大量ROS,使机体处于氧化应激状态,升高MDA和NO含量,造成氧化损伤。
[1]Vázquez G R,Meijide F J,Da Cua R H,et al.Exposure to waterborne 4-tert-octylphenol induces vitellogenin synthesis and disrupts testis morphology in the South American freshwater fish Cichlasoma dimerus(Teleostei,Perciformes)[J].Comp Biochem Physiol,2009,150(2):298-306.
[2]Croteau M C,Davidson M,Duarte-Guterman P,et al.Assessment of thyroid system dismption in Rana pipiens tadpoles chronically exposed to UVB radiation and 4-tert-octylphenol[J].Aquatic Toxicol,2009,95(2):81-92.
[3]洪燕燕,张育辉.辛基酚对中国林蛙蝌蚪生长发育的毒性效应[J].生态毒理学报,2010,5(3):343-350。
[4]Ma A,Yang X,Wang Z,et al.Adult exposure to diethylstilbestrol induces spermatogenic cell apoptosis in vivo through increased oxidative stress in male hamster[J].Reprod Toxicol,2008,25 (3):367-373.
[5]Li J,Wang Z X,Shi D Z,et al.Adult exposure to sasanguasaponin induces spermatogenic apoptosis in vivo through increased oxidative stress in male mice [J].Toxicol Industrial Health,2010,26(10):691-700.
[6]李桂玲,孙小娜,张殿新,等.己烯雌酚对体外培养仓鼠生精细胞毒性作用的研究[J].动物医学进展,2010,31(5):36-4.
[7]肖 鹏,高 洪,严玉霖,等.内源性一氧化碳研究进展[J].动物医学进展.2009,30(5):94-98.
[8]王 萧,林传权,许庆文,等.新西兰兔心衰模型心肌损伤与一氧化氮的关系探讨[J].动物医学进展,2008,29(12):5-10.
[9]Kim J Y,Park J H.ROS-dependent caspase-9activation in hypoxic cell death[J].FEBS Lett,2003,549(3):94-98.
[10]Scherz-Shouval R,Elazar Z.ROS,mitochondria and the regulation of autophagy[J].Trends Cell Biol,2007,17(9):422-427.
[11]王鲜忠,袁小丽,吴建云,等.活性氧对仔猪睾丸支持细胞微丝的影响[J].畜牧兽医学报,2009,40(9):1297-1302.
[12]Covarrubias L,Hernández-García D,Schnabel D,et al.Function of reactive oxygen species during animal development:Passive or active[J].Develop Biol,2008,320(1):1-11.
[13]Mishra D P,Shaha C.Estrogen-induced spermatogenic cell apoptosis occurs via the mitochondrial pathway:role of superoxide and nitric oxide[J].J Biol Chem,2005,280 (7):6181-6196.
[14]马爱团,陈耀星,王子旭.己烯雌酚对成年雄性金色中仓鼠的生殖毒性与氧化损伤的关系[J].动物学报,2007,53(6):1076-1082.
[15]Kumar J S,Banudevi S,Sharmila M,et al.Effects of vitamin C and E on PCB(Aroclor 1245)induced oxidative stress,androgen binding protein and lactate in rat Sertoli cells[J].Reprod Toxicol,2004,19(2):201-208.
