镉对泥鳅肝脏及其过氧化氢酶的影响
2012-06-29王杨科路宏朝
王杨科,路宏朝,王 琦
(陕西理工学院生物科学与工程学院,陕西 汉中 723000)
镉(cadmium,Cd)广泛分布于自然界中,是世界自然基金会(World wide fund for nature,WWF)确认的水生生态环境中最重要的重金属污染物[1-2]。具有污染范围广、持续时间长、毒性强、难以降解以及能沿食物链转移富集、污染后不易被发现等特点,对水生生物和人体产生严重的危害[3-5]。低浓度的镉对鱼类产生较强的毒性效应,导致各组织器官如鳃、肝、肾、脑等出现广泛的损害,引起生长和繁殖异常,甚至死亡[6]。有研究显示,肝脏是体内最初镉积累和产生毒性的主要部位[7]。
泥鳅(Misgurnus anguillicadatus)是一种良好的土壤与水域环境污染的监测动物,属鲤形目(Cypriniformes),鳅科(Cobitidae)泥鳅属,分布极为广泛,取材方便,不受季节限制,抗病能力较强,食性广。因此,近年来常被用来检测水体的污染情况,评价污染物对水生生物的遗传损害及毒理效应等[8-9]。本研究以泥鳅为实验动物,采用生物毒性试验,研究镉对泥鳅肝脏的损伤和过氧化氢酶活性的影响,从而探讨镉对鱼类的毒害机制,间接检测环境的污染情况,并对泥鳅的抗逆机制作初步研究,为发展渔业生产和水体中金属污染防治提供依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 泥鳅购自陕西省汉中市水产市场,体长13.0cm±1.8cm,体重13.4g±1.4g。动物在曝气2d的自来水中暂养5d后,挑选体格健壮、体表无损伤、个体差异较小的泥鳅作为试验泥鳅。
1.1.2 试剂和仪器 氯化镉(CdCl2·2.5H2O,分析纯),天津市苏庄化学试剂厂产品;其它试剂均为化学分析纯试剂。生物研究显微镜(E600),尼康公司产品。
1.2 方法
1.2.1 染毒 采用静水养殖法[4],根据国家渔业水质标准(Cd2+:≤0.005mg/L),并结合文献[5],设置0.05、0.5、5.0mg/L 3个浓度的Cd2+染毒组,以曝气2d以上自来水为阴性对照组,每组取12尾,试验设立两个平行试验组。每组的染毒溶液15L,染毒时间分别为2、4、6、8、10d。
1.2.2 制作肝组织石蜡切片 染毒6d后,迅速采集肝组织,石蜡包埋,HE染色,光学显微镜观察[6]。
1.2.3 过氧化氢酶活性 参照文献[7],用滤纸吸干肝脏、称重,加入4℃的0.25mol/L蔗糖溶液10 mL/g,匀浆,以1500r/min离心5min,取上清液,用0.25mol/L蔗糖溶液将其稀释20倍,置于4℃待测。采用硫代硫酸钠(Na2S2O3)滴定法测定过氧化氢酶活性,各染毒组、对照组均加入0.01mol/L(pH6.8)H2O2磷酸缓冲液5mL;于25℃水浴中恒温1min;染毒组加入酶液1mL,对照组加1mL纯净水,混匀,25℃水浴中保温3min;加入0.5mol/L H2SO4溶液2mL,100g/L KI溶液0.5mL,10 g/L(NH4)2MoO4溶液1滴;混匀静置3min,用0.005mol/L Na2S2O3溶液滴定,达浅黄色时,加淀粉指示剂3滴,至蓝色消失,记录消耗的Na2S2O3溶液数。
1.2.4 统计学处理 原始数据通过SPSS11.0软件中的ANOVA程序处理。
2 结果
2.1 大体病理变化
染毒6d后,肉眼观察较高浓度染毒组(Cd2+:0.5、5mg/L)泥鳅脊椎出现弯曲(图1),体表有红色出血点(图2);解剖后发现,体腔内有大量的淡黄色液体渗出,肝(胰)脏和胆囊充盈肿大。

图1 脊椎弯曲、畸形Fig.1 Antisternum bend and malformaction

图2 体表出现血点Fig.2 Hemorrhage in body surface
2.2 肝脏病理组织学变化
泥鳅经不同浓度Cd2+暴露染毒后,随着染毒时间的延长,较高浓度染毒组(0.5、5mg/L)与对照组相比,肝组织结构出现异常变化(图3,图4)。主要表现为肝细胞肿胀,出现破裂现象,肝索间隙增大,部分细胞内出现小空泡,呈蜂窝状,核被挤向一侧(图5);肝细胞条索状消失,细胞内出现较大的空泡,核悬浮在细胞的中央,细胞破裂,胞质结构消失,细胞核出现浓缩、破裂、溶解,甚至消失(图6)。
2.3 过氧化氢酶活性的变化
随着镉染毒浓度的增加和同一浓度处理时间的延长,滴定所消耗的硫代硫酸钠量显著下降。染毒2d后,染毒组与对照组之间无显著差异(P>0.05);染毒4d后,0.05mg/L染毒组与对照组之间差异显著(P<0.05),其余两染毒组与对照组相比差异极显著(P <0.01);染毒6、8、10d后,染毒组与对照组之间相比都差异极显著(P<0.01)(表1)。

图3 对照组肝细胞结构正常(HE400×)Fig.3 Normal hepatic cell structure in control group(400×)
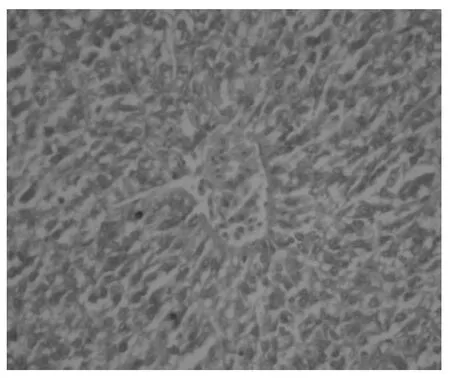
图4 0.05mg/L染毒组肝索较明显,细胞结构较完整(HE400×)Fig.4 Hepatic cord is more obvious and cell structure is complete in contaminated group of 0.05mg/L(400×)
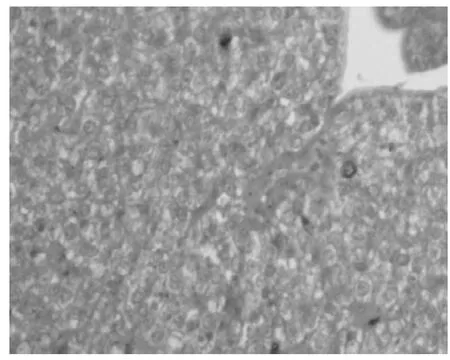
图5 0.5mg/L染毒组肝细胞弥散、破碎(HE400×)Fig.5 Hepatic cells are confused and broken in contaminated group of 0.5mg/L(400×)

图6 5mg/L染毒组肝细胞破裂,溶解(HE400×)Fig.6 Hepatic cells are ruptured and dissoved in contaminated group of 0.5mg/L(400×)
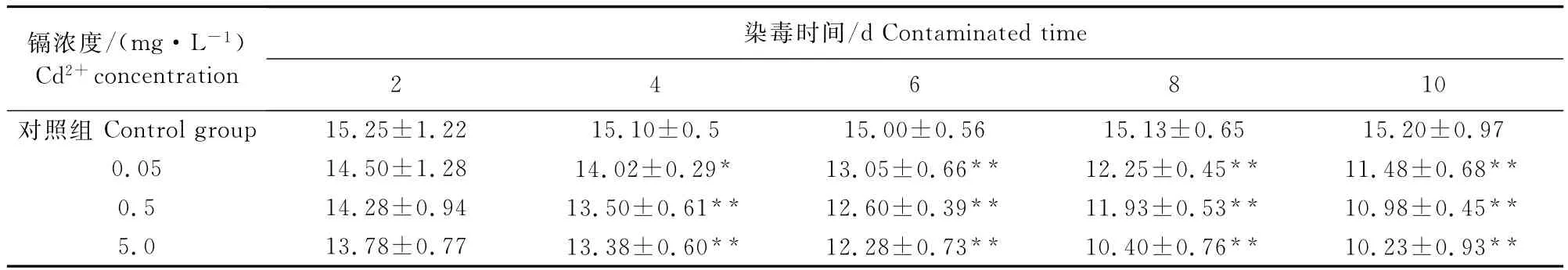
表1 镉对泥鳅过氧化氢酶活性的影响Table1 Effects of Cd2+on liver catalase activity in loach
3 讨论
细胞内的镉能取代钙与肌动蛋白、微管、微丝相结合,从而破坏细胞骨架的完整,损害细胞的功能;镉还能破坏细胞之间的连接。镉与磷质(骨质磷酸钙)发生亲和反应,将骨质磷酸钙中的钙置换出来,使骨骼严重缺钙而变得疏松、软化,继而发生萎缩、变形和骨折等[10]。本次研究发现,镉染毒组(0.5 mg/L、5mg/L)泥鳅在染毒6d后脊椎出现了弯曲,说明是由于钙的严重缺失才导致脊椎的变形。体表的红色出血点,可能是由于水环境中的镉被鱼体吸收后进入血液循环系统,一方面改变血管的通透性,使血管壁损伤,引起出血,另一方面导致血红蛋白降解产生大量血源性色素(含铁血黄素)所致[11]。
在环境胁迫等逆境情况下,生物体内广泛存在活性氧曝发现象,导致自由基增多,使细胞膜产生过氧化,引起细胞膜的破坏和损伤。过氧化氢酶在清除超氧自由基、H2O2和过氧化物及阻止或减少羟基自由基形成等方面发挥重要作用[12]。本试验中,随着染毒浓度的增加和同一浓度处理时间的延长,硫代硫酸钠所消耗的量越来越少,表明肝组织中过氧化氢酶的催化能力越来越弱,即Cd2+对过氧化氢酶的活性抑制作用越来越大。结合肝脏显微结构观察发现,当Cd2+的染毒剂量达到0.5mg/L时泥鳅肝脏出现了损伤,浓度越大肝损伤越严重。
综上所述,泥鳅对Cd2+反应较为灵敏,能反映水体中污染物的作用,是一种较有前途的生物检测指标和生物标志物。
[1]Colbom T.Developmental effects of endocrine disrupting chemical in wildlife and humans[J].Environ Health Perspect,1993(101):378-384.
[2]成 嘉,符贵红,刘 芳,等.重金属对鲫鱼乳酸脱氢酶和过氧化氢酶活性的影响[J].生命科学研究,2006,10(4):372-376.
[3]杨丽华,方展强,郑文彪,等.镉对鲫鱼鳃和肝脏超氧化物歧化酶活性的影响[J].安全与环境学报,2003,3(3):13-15.
[4]高 举,赵欣平,詹付凤,等.铅对鲫鱼碱性磷酸酶和酸性磷酸酶活性的影响[J].四川动物,2008,27(2):201-204.
[5]胡 蓉,唐正义.镉对鲫鱼肝胰脏CAT和SOD活性的影响[J].西南大学学报:自然科学版,2011,33(8):94-98.
[6]胡晓磐,周建华.镉对鱼类毒性作用的研究现状[J].水利渔业,2005,25(2):76-78.
[7]王莎莎,陈 龙,夏树开,等.镉诱发肝细胞毒性和胞内Ca2+变化及硒的保护作用研究[J].分子生物学学报,2006,39(4):350-356.
[8]宋志慧,陈天乙,马维琦.有机锡化合物对萝卜螺的毒性作用[J].环境科学,1997,18(4):83-84.
[9]于淑池,许丽敏,朱叶莲,等.对苯二胺对泥鳅的急性毒性及安全评价[J].水生态学杂志,2011,32(2):131-134.
[10]黄秋蝉,韦友欢,黎晓峰.镉对人体健康的危害效应及其机理研究进展[J].安徽农业科学,2007,35(9):2528-2531.
[11]汪开毓.鲤鱼细菌性败血症的病理学研究[J].四川农业大学学报,2004,22(3):257-262.
[12]Frank V,Eva V,James F D,et al.The role of active oxygen species in plant signal transduction[J].Plant Science,2001(161):405-414.
