T4噬菌体蛋白的分子改造及其应用前景
2012-06-29任慧英
逯 凯,颜 晨,任慧英
(青岛农业大学动物科技学院,山东 青岛 266109)
T4噬菌体是感染细菌的最大的病毒之一,也是目前为止研究得最透彻的噬菌体之一,因易于操作及一些技术上的优势使其成为分子生物学的主要工具。首先,用经典遗传学方法很容易操作T4噬菌体,如进行位点特异性诱变。同时也很容易增殖。虽然T4噬菌体是最复杂的病毒之一,但是利用X射线技术、冷冻电镜技术及3D图像再现技术可以很好地研究和描述它的结构[1-2]。
T4噬菌体可感染大肠埃希菌和与其关系紧密的志贺菌,属肌尾噬菌体科,是有尾噬菌体,包括扁长的二十面体的头部、带有须状物的颈部、可收缩的尾部和尾丝。在感染过程中,T4用噬菌体复制和表达因子控制细胞的代谢,这些尾丝参与宿主细胞表面的识别并与细菌发生连接。尾丝末端的基板结合于宿主表面的特异性受体,尾部带有的酶类降解细菌细胞壁,利于噬菌体核酸的注入。整个尾部就像注射器一样,通过收缩将核酸注入细菌中。感染的最后过程是装配和裂解[3]。基因组dsDNA紧紧包裹在蛋白质衣壳中。有些病毒的基因组只有5×103bp(如噬菌体 φX174),而 T4基因组庞大[4],包含1.69×105bp,有289个开放阅读框,8个tRNA基因和至少2个功能未知的小RNA。超过150个的基因已经被注释,其中的62种已经被定为最基本的基因。单分子光镊和荧光的研究表明T4以高达2000bp/s的速度进行DNA的组装,这是目前报道的DNA组装中最快的。病毒粒子由约50种蛋白组成,其中头部蛋白至少有12种。除了核酸之外在病毒粒子中有少量的非蛋白成分,如与DNA有关的多胺类物质(腐胺、亚精胺、尸胺),与尾鞘有关的ATP和Ca2+及与尾板有关的二氢蝶酰六谷氨酸。人们已经充分了解T4噬菌体的结构,并拥有大量的基因操作技术,可以按照意愿去改变它的性能。因此,T4噬菌体会成为生物技术的试验品,而且对其的改造可为分子生物学和医学生物学开辟新的道路。
1 T4噬菌体头部的蛋白结构
T4噬菌体头部的相对摩尔质量为1.94×108g/mol,长115nm,宽85nm,是由160个gp23(主要衣壳蛋白,48.4kg/mol)的六聚体,11个gp24五聚体(五聚顶角蛋白,46kg/mol)和1个gp20(构成在感染过程中DNA组装完成进入噬菌体的特殊的顶部入口)组成的二十面体。通过原子力显微镜(atomic force microscopy,AFM)可以更形象的观察T4噬菌体的结构,得到的图像与电子显微镜观察到的基本一致,而且可以相互补充。通过AFM观察无水分的含有DNA的头部大约有75nm长,60nm宽(在液体中观察时约100nm长,85nm宽)[5]。在头部前体形成的过程中,蛋白骨架和壳体蛋白要承受gp21(头部前体蛋白酶,T4PPase)的蛋白水解作用。gp23、gp24、IPⅠ、IPⅡ、IPⅢ及gpalt蛋白的氨基末端被裂解,同时gp22、gp21、gp67和gp68蛋白大部分被消化。gp23六聚体中心之间的距离约为14nm。两个gp23形成一个约3nm厚的壳体蛋白来保护内部的核酸。头部的顶角处由gp24构成,gp24形成五聚体和gp23六聚体边缘相接触。T4噬菌体衣壳有两个非必需的外部衣壳蛋白——Hoc和Soc,这两个蛋白被广泛应用在二肽展示文库中并用来展示HIV、脑膜炎双球菌、炭疽杆菌和FMDV[6]。Soc蛋白在gp23六聚体的表面形成一个几乎连续的网眼状结构。它可以将两个gp23亚单位结合在一起,但是不能将gp24之间或者gp23和gp24结合在一起。一些研究也显示Soc与gp23的相互作用比Soc与Soc的相互作用要有利。由gp-Soc形成的骨架环绕着每个不与gp24相邻的gp23六聚体。当gp23和gp24相邻时,Soc分子只占据其中的五个边,而不包含与gp24相连的一边。除了那些与gp24相连的gp23分子只与一个Soc分子相连外,大部分都与两个Soc蛋白相连。Soc分子的位置似乎证实它能够加强gp23亚单位之间的连接。当gpSoc位于gp23亚单位之间时,将形成三聚体结构,但是当从噬菌体中纯化或在体外表达时,gpSoc就以单体形式存在。虽然对Soc蛋白的功能尚未完全了解,普遍认为其在保护噬菌体衣壳对抗热变性、洗涤剂或者碱性pH方面有重要作用,从而保护噬菌体生命力。
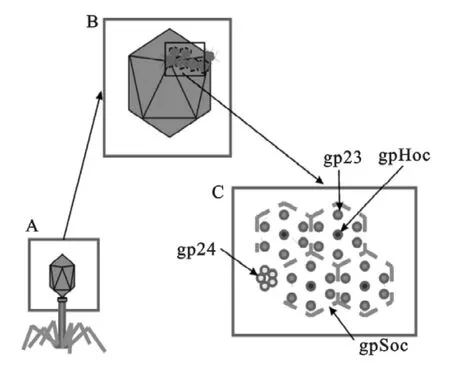
图1 T4噬菌体头部的蛋白结构Fig.1 Ther protein structure of bacteriophage T4head
gpHoc(高免疫原性的外部衣壳蛋白,39.1 kg/mol)很可能是T4噬菌体衣壳最具特征的蛋白,它在每个gp23六聚体的中心规则排列,而且很明显地从噬菌体的头部伸出来。突出的部分大约5nm长,相对分子质量约为12kg/mol。Hoc蛋白具有多结构域,由1个约0.19nm高的圆座,一个薄的颈部及一个约2nm宽、2.4nm高的球形头部组成[7]。gpHoc的功能未知。
2 尾部和尾丝的蛋白结构
在过去的10年里,通过电子显微照片的三维图像重建与X射线晶体学技术的应用,对T4噬菌体尾部结构的阐述已经取得了显著的进步。在20种尾部结构蛋白中,通过X射线晶体学技术确定了其中九种的部分和完整的结构,同时也得到了“伸展的”3D重组结构。“收缩的”尾部的3D结构也已明确。如果能够明确尾部收缩前后的原子分布,我们就能通过基板的亚单位蛋白相对位置的变化了解基板的总体构象变化[8]。尾部和尾丝是T4噬菌体与宿主细胞间相互作用的重要工具,决定了噬菌体感染的特异性。尾部由同轴的两种蛋白组成。外层圆柱状的蛋白具有收缩性,内层蛋白为头部核酸的通道,正是由于像注射器一样的尾部结构才使得DNA能够注入到细菌细胞中。内部圆柱体的外径为9 nm,内径为4nm,由144个gp19构成。尾部的外层部分叫做尾鞘,由144个gp18构成(和gp19的数目一致)。尾部的长度很可能由“标尺蛋白”gp29决定。未收缩的尾部长100nm、直径为21nm,与尾鞘的大小相当,收缩时尾鞘只有36nm长、直径27 nm。收缩时尾管的长度不变。任何一个圆柱体的末端都是基板和尾丝。基板是一个多聚蛋白,27nm高,最宽的部分有52nm。这些蛋白在2个三聚蛋白(gp9)3和(gp12)3的协助下环绕中心部分形成六聚体。gp11,gp10,gp7,gp8,gp6,gp53和gp25的按顺序结合构成楔状物。gp5,gp27,gp29,很可能还有gp26和gp28一起形成基板的中心[9]。gp5拥有一个溶菌酶区域,这对于噬菌体在感染过程中溶解细菌肽聚糖层是十分必要的。
T4噬菌体最有用的的结构之一就是尾丝:长尾丝(long tail fiber,LTF)和短尾丝(short tail fiber,STF),他们位于尾丝末端,从颈部向外像胡须一样延伸。LTF主要识别细菌表面的特异性受体,约145nm长,直径为4nm。每条尾丝由两部分构成:近侧由gp34组成,远侧由gp36和gp37组成。两部分间由gp35连接,gp35和gp34及gp36相互作用。连接STF和基板的是gp9。尾丝的近侧和gp9的联系需要gp63的协助。gp9在感染过程中起着非常重要的作用。在STF和细胞壁上的脂多糖结合之后,gp9就启动了基板向星状结构转变的过程,加之尾丝收缩使得噬菌体的DNA能够注入到细胞中。gp9与尾丝共同运动,避免对基板的无效触发。STF由gp12三聚体构成,由gp11将其连接到基板上。他们有34nm长,棒状结构,中间部分变窄,而且中间部分的尾丝可以弯曲90°。短尾丝将噬菌体颗粒固定到细菌表面。感染过程中,gp12的C末端紧密结合到脂多糖(lipopolysaccharides,LPS)的受体的核心区域。
3 T4噬菌体基因组的突变
T4噬菌体及其他T偶数噬菌体在早期的诱变研究中都被用作分子模型,由于诱变机制与高等生物相似,其研究结果也被用于更高等生物。在一个复制周期中,T4噬菌体基因组中每个碱基自发突变(通常是点突变)的概率是1/107,紫外线照射、热、亚硝酸等物理和化学因素均能够提高突变频率。
位点特异性突变可以对特定基因进行突变。用载体系统把在体外引发的突变导入到噬菌体基因组中,可以研究许多重要基因产物的功能和结构,例如T4噬菌体溶菌酶、DNA聚合酶等。系统性的定点诱变可以发现氨基酸替换敏感的蛋白质位点,这些敏感的位点包含蛋白质的关键氨基酸。有了这个方法,便可以研究单个酶解片段的作用,进一步验证先前对他们的功能和结构的假设。Karam J D和Konigsberg W H应用位点特异性诱变阐明T4噬菌体DNA聚合酶合成DNA过程中的蛋白质的作用和相互关系,并最终确定了reg蛋白是一种结合到mRNA上、至少调节12个基因翻译的阻抑蛋白[10]。位点特异性诱变成为一种研究蛋白质功能和结构的非常有价值的方法。
4 噬菌体展示系统
噬菌体展示系统是用于改造T4噬菌体及其他噬菌体特性的最先进、应用最广的方法之一。这种技术是将噬菌体编码基因和非噬菌体蛋白的基因进行融合,并在噬菌体表面进行蛋白表达,融合蛋白作为一种外来蛋白构建进噬菌体粒子中。噬菌体展示中具有里程碑意义的是史密斯的研究工作,他将编码限制性内切酶EcoRⅠ的基因序列导入F1代噬菌体基因组中,将噬菌体衣壳蛋白pⅢ和细菌限制性内切酶融合在一起。融合蛋白构建进病毒粒子,噬菌体仍保持部分感染性而免疫原性不变。随后,将克隆区域转移到编码pⅢ蛋白的N端的基因序列中,这样噬菌体就可以感染本来不能感染的细菌。噬菌体展示技术得到广泛应用,成为一种收集特定分子的有效工具。在大量单个噬菌体粒子上展示一系列蛋白(如抗体),构建噬菌体文库,主要用于发现不同分子的蛋白配体。噬菌体文库的建立方便了分子筛选,其步骤包括:增殖噬菌体文库,扩增目的分子;去除未结合的噬菌体粒子;在大肠埃希菌中对目的噬菌体增殖[11]。目前用于构建展示文库的噬菌体主要有丝状噬菌体、λ噬菌体、T4噬菌体和T7噬菌体[12];他们所展示的外源蛋白可以保持相对独立的空间结构和生物活性[13]。噬菌体展示技术已经应用于许多方面,如蛋白质和配体之间的相互关系、受体激动剂和颉颃剂的筛选、抗原表位的研究与筛选[13-14]、传染病的治疗及疫苗研究等。噬菌体展示技术能够展示大量的蛋白质,可以在体内和体外进行筛选,该技术高效、快速、廉价、过程容易控制,也不需要特殊的设备[15]。
T4噬菌体的许多特征利于在病毒衣壳表面进行蛋白分子的展示,尤其在多价疫苗的研制方面。T4噬菌体有两个非必需蛋白Hoc和Soc,他们对称地分布在衣壳表面。通过突变修饰或者去除这两种蛋白并不影响噬菌体的复制、稳定或者感染性。这两种蛋白在病毒表面大量展示,并且在衣壳组装完成之后、DNA包装进衣壳之前组装进头部。Hoc和Soc的高拷贝数利于在同一个衣壳上展示多个融合蛋白并控制他们的数量[16]。拷贝的数量可以通过改变结合条件来调节。许多大小、结构、生物学功能不同的蛋白质已经被成功的融合到T4噬菌体的衣壳上。目前的研究热点集中在展示某些致病菌的抗原,从而开发高效疫苗。T4噬菌体不仅可用于较大蛋白的展示,而且可同时展示多种蛋白。衣壳缺乏DNA,并且有大量的尾部蛋白,这些特性对开发噬菌体表面展示蛋白研制疫苗是极其重要的。尾部蛋白与免疫系统相互作用。当展示蛋白诱导的免疫反应受到尾部成分的干扰时,这种作用是理想的;相反,如果尾丝蛋白发挥很好的免疫辅助作用,就不可行了。王宪文等将猪圆环病毒2型(PCV-2)衣壳蛋白羧基端基因展示在T4噬菌体表面并成功表达,为检测 PCV-2阳性血清、测定疫苗免疫效果及PCV-2基因工程疫苗的研究提供了帮助[17],并同时建立了检测PCV-2抗体的ELISA方法,与试剂盒检测的符合率在90%以上,并初步应用于生产实践中血清样品的检测,有望在生产中得以推广[18]。
5 T4噬菌体衣壳作为治疗制剂的平台
噬菌体作为治疗性制剂有几大优势:噬菌体特异性强,只针对相应的病原菌,而不会破坏正常菌群。噬菌体的作用机制与抗生素完全不同,治疗效果不受细菌耐药性的影响;噬菌体的指数增殖能力是噬菌体治疗的一个显著优势;噬菌体治疗的副作用少,细菌不易对噬菌体产生抗性;不会在体内残留,噬菌体研发所需的时间短,成本低,常温下易保存、运输[19]。前期的研究表明,不仅能够在完整的病毒粒子表面展示多肽,还能在空衣壳上进行展示。将脑膜炎奈瑟菌36个氨基酸的PorA肽段克隆进载体,得到了Hoc和Soc的N末端融合肽,并在T4噬菌体衣壳上组装进了这种稳定的多肽。体内试验证实被展示的PorA具有免疫原性。这些研究表明,以T4噬菌体为基础的系统不仅能够调节被展示多肽的拷贝数量也能调节病毒粒子的大小和结构,从而诱导最佳的免疫应答。T4噬菌体的这些特性使其成为开发新型疫苗的有力工具。
T4噬菌体曾被用于研制疫苗预防超强毒力传染性法氏囊病病毒(vvIBDV)引起的传染性法氏囊病,将IBDV中主要免疫原性蛋白VP2融合到T4噬菌体衣壳表面的Soc中,诱导中和抗体产生的抗原表位具有高度的构象独立性。虽然缺乏有关展示蛋白及病毒粒子结构的信息,但是有理由相信,在T4噬菌体表面展示的VP2能够维持表位的构象稳定,并在雏鸡体内诱导高水平的体液免疫。另外,经T4-VP2免疫接种的雏鸡能抵抗vvIBDV的攻击。该项技术切实可行,生产成本低,噬菌体疫苗的保存及运输又十分方便。另外,这也是首次在噬菌体表面展示441个氨基酸的大蛋白[20]。
将炭疽杆菌保护性抗原PA与T4噬菌体衣壳上的Hoc相融合进行展示,表明被展示的抗原大小没有重要的限制。后来,应用相同的系统研制了多价炭疽疫苗,将炭疽杆菌毒素蛋白PA、致死因子(lethal factor,LF)及水肿因子(edema factor,EF)单独或同时融合进Hoc的N端进行噬菌体展示。在不加佐剂的条件下,这些蛋白在小鼠体内诱发了强烈的免疫应答(与PA单独展示相比,LF和EF抗原的存在增强了PA特异性免疫应答)。这些研究为多价疫苗的研制提供了可行性,因为病原体通常编码多种抗原表位,而大多数疫苗只针对一种抗原。
6 T4噬菌体突变在噬菌体治疗中的潜在影响
噬菌体工程的目标之一就是开展噬菌体治疗。噬菌体可作为抗生素的替代品用于治疗细菌病,将抗生素和噬菌体制剂联合使用可能会更好。Szczaurska-Nowak K 等[21]将 B16黑色素瘤接种到小鼠体内,先用常规抗肿瘤药如环磷酰胺(CY)、5-氟尿嘧啶治疗(5-FU),然后再使用T4噬菌体制剂,结果显示T4噬菌体制剂能够轻微加强环磷酰胺抑制癌细胞转移的作用。然而,噬菌体治疗受到诸多限制,例如,噬菌体具有高度特异性(甚至在形成活性菌株时产生问题),或由于免疫屏障及患者的免疫应答引起噬菌体从体内消失。对噬菌体衣壳结构进行相对简单的改造将可以解决这些问题。Merril等得到了来自λ噬菌体的突变株,这些突变株不仅可在小鼠循环系统中存留很长一段时间,而且比亲代毒株具有更好的抗菌效果,他们在λ样噬菌体的主要衣壳蛋白E上有一个谷氨酸→赖氨酸的点突变,虽然没有与T4噬菌体相关的相似数据,这一结果仍为构建能在体内长期存在的T4噬菌体提供新的思路。
有意思的是,已经构建出了T4噬菌体短循环的突变体。HAP1这个突变体在体外被选作T4噬菌体的亚系,可与哺乳动物细胞系发生较强作用。奇怪的是,体内试验显示,在小鼠器官里这种噬菌体被快速清除。在hoc基因中出现了无义突变,因此导致在噬菌体衣壳上缺少gpHoc,很可能会导致T4噬菌体衣壳上其他有活性的和有免疫原性的成分暴露,并引起机体的强烈的反应[22]。这些研究表明,在噬菌体治疗中针对噬菌体的清除而对噬菌体进行的改造,可以有多种方法,根据临床需要,可以延长或缩短噬菌体在体内的循环时间。
噬菌体治疗的一个问题就是噬菌体对细菌菌株的高度特异性。T4噬菌体的特异性由尾部蛋白gp37的末端来决定,负责与细菌的受体结合。人工诱变能够改变噬菌体的特异性。T4噬菌体感染大肠埃希菌及亲缘关系较近的志贺菌属。但也有一些突变株能够吸附假结核耶尔森菌,这种细菌与大肠埃希菌亲缘关系较远。这些突变体中的一种类型在gp37的C末端发生点突变,出现1个或2个氨基酸的替换。另一种突变类型是在相同区域中发生许多基序的不平等交换,这些突变会导致T4噬菌体吸附到假结核耶尔森菌的受体上。通过这种途径,或许能够获得感染新菌株的噬菌体突变株。
T2与T4噬菌体非常接近,具有高度基因同源性和结构相似性。Yoichi M等[23]将T2噬菌体的尾丝蛋白gp37及gp38通过同源重组替换成能特定侵染大肠埃希菌O157:H7的PP01噬菌体的相应蛋白,得到了能感染大肠埃希菌O157:H7的T2ppD1噬菌体。有意思的是,突变的T2噬菌体不再能感染T2噬菌体的天然宿主大肠埃希菌K12。Hashemolhosseini S等[24]研究了T4及其他的T4样的噬菌体TuIa和TuIb,研究了gp38在决定噬菌体特异性中的作用,确定gp38不是噬菌体衣壳的组成成分,为一种分子伴侣,对gp37形成二聚体是必需的,有助于尾丝形成正确的空间结构从而识别靶多肽。
诸多试验表明,通过噬菌体展示技术可以显著改变噬菌体的特异性。Di Giovine M等[25]将腺病毒五邻体的基因引入M13噬菌体的基因组中,这种蛋白有助于将腺病毒结合并内化进入宿主细胞。众所周知,噬菌体对真核细胞没有自然趋向性。M13噬菌体展示了全长的腺病毒五邻体蛋白,其107个氨基酸的中心区域可以结合宿主细胞的受体。改造了的M13噬菌体能够与哺乳动物的细胞发生相互作用,但是不能在细胞内增殖,也不能引起细胞裂解。
噬菌体治疗为应对广泛耐药的超级细菌提供了一项新的选择。这种方法的运用需要首先控制噬菌体活性,并了解其作用机制。噬菌体的特异性方面的研究是一大挑战,这是噬菌体疗法能否成功应用的关键。虽然很容易操作T4噬菌体,但对其进行的特异性改造仍处于试验阶段。目前,人们仍然不能随意改变噬菌体的特异性,但一些研究表明这些改变是可行的。关于T4噬菌体与哺乳类细胞相互作用的研究,提示操纵T4噬菌体基因组或许能导致噬菌体性能方面的重大改变。噬菌体的生活周期及其免疫性能决定了噬菌体治疗的应用。相信在未来的研究中,这些性能都会被提高及改善,从而使噬菌体在医学和生物学领域具有更广泛的应用。
[1]Fokine A ,Chipman P R,Leiman P G ,et al.Molecular architecture of the prolate head of bacteriophage T4[J].Proc Nat Acad Sci,2004,101(16):6003-6008.
[2]Olson N H,Gingery M,Eiserling F A,et al.The structure of isomeric capsids of bacteriophage T4[J].Virology,2001,279:385-391.
[3]Figura G,Budynek P,Dabrowska K.Bacteriophage T4:molecular aspects of bacterial cell infection and the role of capsid proteins[J].Postepy Hig Med Dosw,2010,64:251-261.
[4]Mesyanzhinov V V,Leiman P G,Kostyuchenko V A,et al.Molecular architecture of bacteriophage T4[J].Biochemistry,2004,69(11):1190-1202.
[5]Kuznetsov Y G,Chang S C,Mcpherson A.Investigation of bacteriophage T4by atomic force microscopy[J].Bacteriophage,2011,1(3):165-173.
[6]Rao V B,Black L W.Structure and assembly of bacteriophage T4head[J].Virol J,2010,7:356-370.
[7]Kurzepa A,Dabrowska K,Górski A,et al.Molecular modification of T4bacteriophage proteins and its potential application-Review[J].Folia Microbiol,2009,54(1):5-15.
[8]Leiman P G,Arisaka F,van Raaij M J,et al.Morphogenesis of the T4tail and tail fibers[J].Virol J,2010,7:355-383.
[9]Leiman P G ,Kanamaru S,Mesyanzhinov V V ,et al.Structure and morphogenesis of bacteriophage T4[J].Cel Mol Life Sci,2003,60(11):2356-2370.
[10]Karam J D,Konigsberg W H.DNA polymerase of the T4-related bacteriophages[J].Progr Nucl Acid Res Mol Biol,2000,64:65-96.
[11]Paschke M.Phage display systems and their applications[J].Appl Microbiol Biotechnol,2006,70:2-11.
[12]Meng F M,Zhang C H,Ai Y C.Advances of development of phage display systems[J].Yi Chuan,2011,33(10):1113-1120.
[13]刘相叶,邓洪宽,吴秀萍,等.噬菌体展示技术及其应用[J].动物医学进展,2008,29(1):60-63.
[14]于永忠,李集临,徐香玲,等.噬菌体展示技术与病毒抗原表位研究[J].中国预防兽医学报,2009,31(3):241-246.
[15]陈启伟,王永录.噬菌体展示技术及其在抗原表位筛选中的应用[J].畜牧与兽医,2009,41(6):96-98.
[16]Willats W G T.Phage display:practicalities and prospects[J].Plant Mol Biol,2002,50:837-854.
[17]Shivachandra S B,Li Q,Peachman K K,et al.Multicomponent anthrax toxin display and delivery using bacteriophage T4[J].Vaccine,2006,25:1225-1235.
[18]王宪文,曹永长,马静云,等.猪圆环病毒Ⅱ(PCV2)衣壳蛋白羧基端基因在T4噬菌体表面的展示[J].农业生物技术学报,2009,17(3):541-542.
[19]王宪文,曹永长,马静云,等.PCV2衣壳蛋白羧基端基因在T4噬菌体表面的展示及ELISA方法的建立[J].中国兽医学报,2011,31(8):1103-1106.
[20]Yongchang C,Quancheng S,Jingyun M ,et al.Vaccination against very virulent infectious bursal disease virus using recombinant T4bacteriophage displaying viral protein VP2[J].Acta Biochem Biophys Sinica,2005,37:657-664.
[21]Szczaurska-Nowak K,Dabrowska K,Celka M,et al.Antitumor effect of combined treatment of mice with cytostatic agents and bacteriophage T4[J].Anticancer Res,2009,29(6):2361-2370.
[22]Dabrowska K,Zembala M,Boratynski J,et al.Hoc protein regulates the biological effects of T4phage in mammals[J].Arch Microbiol,2007,187(6):489-498.
[23]Yoichi M,Abe M,Miyanaga K,et al.Alteration of tail fiber protein gp38enables T2phage to infect Escherichia coli O157:H7[J].Biotechnology,2005,115:101-107.
[24]Hashemolhosseini S,Montag D,Krämer L,et al.Determinants of receptor specificity of coliphages of the T4family[J].Mol Biol,1994,241:524-533.
[25]DI Giovine M,Salone B,Martina Y,et al.Binding proper-ties,cell delivery,and gene transfer of adenoviral penton base displaying bacteriophage[J].Virology,2001,282:102-112.
