猪源牛病毒性腹泻病毒SD0803株E2蛋白的表达及抗体制备
2012-06-29孙春清张宏彪龙进学文心田曹三杰童光志袁世山
邓 宇,蔺 涛,孙春清,张宏彪,张 荣,龙进学,黄 律,文心田,曹三杰,童光志,袁世山,郑 浩*
(1.四川农业大学动物医学院,四川 雅安 625014;2.中国农业科学院上海兽医研究所,上海 200241;3.西昌学院动物科学学院,四川 西昌 615000;4.南京农业大学动物医学院,江苏 南京 210095)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是单股正链RNA病毒,属于黄病毒科(Flaviridea)瘟病毒属(Pestivirus)成员,当前被分为2个种,BVDV-1和 BVDV-2[1]。BVDV 基因组全长约为12.3kb~12.5kb,由一个大的开放阅读框(open reading frame,ORF)和5′与3′非翻译区(untranslated region,UTR)所组成。该病毒ORF编码约4000个氨基酸残基组成的多聚蛋白,在病毒非结构蛋白与宿主细胞信号肽酶作用下,加工成BVDV结构蛋白和非结构蛋白,依次为p20(Npro)、C,gp48(Erns)、gp25(E1)、gp53(E2)、p7、p125(NS2-3(NS2,NS3))、p10 (NS4A)、p30 (NS4B)、p58(NS5A)、p75(NS5B)[2-3]。其中,E2(gp53)是 BVDVs亚型分类的依据之一,也是主要保护性抗原[4-5]。BVDV除引起牛感染外,还能引起野生反刍动物、兔、绵羊、山羊、猪等动物感染。猪感染BVDV会出现类似猪瘟的临床症状与病理变化[6],给养猪业带来危害。近3年来,流行病学调查结果表明,我国猪群中BVDV感染已经比较严重,送检的样品中,部分批次样品阳性率高达80.72%[7-9]。近4年来,我们实验室对来自我国11省份的猪病料样品进行BVDV检测,结果也发现,部分猪场BVDV感染很严重,高达79.3%。我们从这些阳性病料中分离鉴定出一株BVDV SD0803,基于此,我们根据此毒株E2基因表达蛋白免疫兔制备多克隆抗体,为猪源BVDV快速诊断提供一种参考方法,为猪源BVDV病原学研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株、细胞、实验动物 猪源BVDV SD0803株由本实验室分离鉴定;BVDV NADL标准毒株,购自中国兽医药监察所;MDBK细胞,购自美国ATCC,经本实验室建立的Nested-PCR与直接免疫荧光(Direct FA)检测均为BVDV阴性;实验兔,购自上海斯莱克实验动物有限责任公司。
1.1.2 主要试剂 马血清(经检测BVDV抗原抗体呈阴性),PBS购自 GIBCO公司;RPMI-1640培养基,购自Hyclone公司;FITC标记BVDVs抗体,购自美国 VMRD 公司;pGEX-4T-1、BL21、DH5α,购自康为世纪生物科技有限公司;EcoRⅠ和XhoⅠ,购自Thermo公司;QIAamp®Viral RNA Mini Kit,购自QIAGEN公司;AMV反转录酶、LA Taq聚合酶,购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计及合成 根据GenBank中公布的多个BVDV-1毒株的全长序列进行比对,用Primer Premier 6.0设计2对特异引物扩增SD0803株E2基因,预期扩增约1400bp,引物序列分别为:F1975,5′-CCC(TC)GG(GT)A(AG)(GA)TT(TC)GACACCAATGC-3′;R4014,5′-CTGTC ACATA(GA)CTA A(CT)CATCAG-3′;F2249,5′-GACCA(AG)ATTGGTGGCCTT ATGAGAC;R3640,5′-A(CT)T(GA)T(CT)ATG(TG)GTTA(GA)CAAGTTGCC-3′。
根据上述引物扩增SD0803E2基因序列,采用DNA Star软件预测分析,选择表达蛋白抗原性、亲水性较好的序列设计合成一对引物,用于扩增表达蛋白的靶基因(sE2),预期扩增约735bp,其引物序列 为 E2-F:5′-AGCGAATTCTTTGA ACAACT CTTCAATGGG-3′;E2-R:5′-AGCCTCGAGTT AGTACTCCCCTTTTAA CATA-3′,其中,在上下游引物分别引入EcoRⅠ和XhoⅠ限制性酶切位点(下划线标识)和3个保护性碱基,引物均由Invitrogen(上海)公司合成。
1.2.2 E2基因PCR扩增 用 QIAamp®Viral RNA Mini Kit按照操作说明书提取SD0803株MDBK细胞培养上清RNA。以R4014为反转录引物,参照AMV反转录酶操作说明书,进行反转录,合成cDNA。然后分别以 F1975/R4014,F2249/R3640为引物进行 RT-PCR、Nested-PCR扩增,方法按LA Taq聚合酶说明书进行。RT-PCR扩增条件为:94℃预变性5min;94℃30s,55℃30s,72℃2min 35个循环;72℃延伸10min。套式PCR扩增条件为:94℃预变性5min;94℃30s,58℃30s,72℃1min 30s35个循环;72℃延伸10min。扩增结束后取5μL Nested-PCR反应产物,用10g/L琼脂糖凝胶电泳检测。用DNA胶回收试剂盒纯化Nested-PCR产物,直接送纯化产物至Invitrogen(上海)公司测序,分析测序结果,确定SD0803E2基因。
1.2.3 sE2基因PCR扩增 以Nested-PCR纯化产物为模板,以E2-F与E2-R为PCR扩增引物,按LA Taq聚合酶说明书进行PCR扩增,反应条件为:95℃预变性3min;95℃30s,58℃45s,72℃45s35个循环;72℃延伸5min。反应结束后取5μL PCR反应产物,用10g/L琼脂糖凝胶电泳,鉴定扩增产物的大小正确后DNA胶回收试剂盒回收、纯化。
1.2.4 重组表达载体pGEX-4T-1-sE2的构建 纯化产物(sE2)用限制性内切酶EcoRⅠ与XhoⅠ双酶切后与用相应限制性内切酶处理的pGEX-4T-1载体连接,22℃连接过夜。65℃灭活10min后,转化至DH5α感受态细胞,37℃生长过夜,随机挑取克隆,提取质粒,用EcoRⅠ与XhoⅠ对质粒双酶切,鉴定正确的重组质粒送Invitrogen(上海)公司测序。
1.2.5 SD0803sE2基因诱导表达及表达产物纯化将重组质粒pGEX-4T-1-sE2接种至3mL TB培养基(含氨苄抗性)中37℃培养箱中振荡培养过夜,次日取该菌液按1∶100的比例加入300mL LB培养基(含氨苄抗性)中,37℃振荡培养至OD600为0.5~0.6时,加入1.5mmol IPTG进行诱导表达。37℃诱导4h后收菌,表达产物采用文献[10]所述方法,进行纯化,获得的产物命名为rsE2。采用SDS-PAGE对纯化蛋白进行分析。
1.2.6 抗rsE2蛋白多克隆抗体的制备及纯化 首次免疫,取rsE2蛋白与等体积的弗氏完全佐剂充分乳化,500μg/只的剂量多点皮下接种兔。间隔3周后,用rsE2蛋白加等体积弗氏不完全佐剂充分乳化后,加强免疫3次,按250μg/只剂量皮下接种兔。末次免疫后1周,兔心脏采血,分离血清,制备抗体,置-20℃保存。
利用5mg rsE2蛋白制备抗原交联柱,抗血清经过5000r/min离心15min,滤纸过滤后,用10倍柱体积的1×PBS平衡交联柱,然后抗血清过柱两次,再用含1mol/L NaCl的PBS缓冲液清洗柱子,然后用100mmol/L的1×Glycine-HCl(pH2.3)洗脱抗体,收集洗脱抗体用Tris缓冲液平衡至中性。随后在1×PBS溶液中透析2h,再在含550mL/L甘油的PBS溶液中透析4h~8h,收取抗体,置-70℃保存备用。
1.2.7 多克隆抗体的鉴定
1.2.7.1 间接ELISA抗体效价的测定 参照文献[11]所建立间接ELISA方法,以SD0803MDBK细胞培养上清作为包被抗原建立间接ELISA,检测兔抗血清的抗体效价及特异性。
1.2.7.2 Western blot抗体特异性检测 将rsE2蛋白进行SDS-PAGE电泳,然后以湿转法将蛋白转到NC膜上面;经50g/L脱脂奶粉室温封闭2h后,用兔抗rsE2纯化抗体为一抗,FITC标记的羊抗兔IgG作为二抗,按文献[10]所述方法进行 Western blot分析。
1.2.8 BVDV 抗原的检测 将SD0803、NADL分别接种基本长满单层的6孔板MDBK细胞,3d后,用甲酮固定,所制备的多抗为一抗,FITC标记的羊抗兔IgG为二抗,做间接免疫荧光试验。
2 结果
2.1 SD0803E2及sE2基因扩增
采用套式PCR扩增SD0803的E2基因,经琼脂糖凝胶电泳鉴定,得到约1400bp条带,与预期大小一致(图1),送其产物测序,得到的序列为SD0803 E2基因序列。PCR扩增sE2基因,获得预期的735 bp条带(图2)。
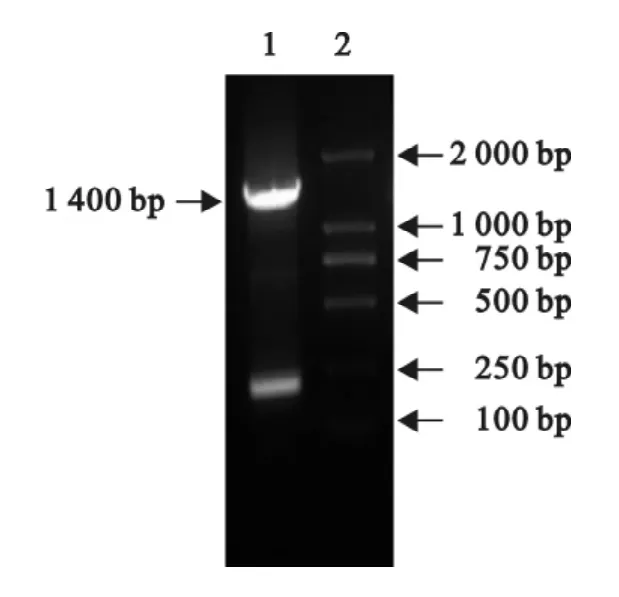
图1 SD0803E2基因扩增Fig.1 Amplification of E2gene of SD0803
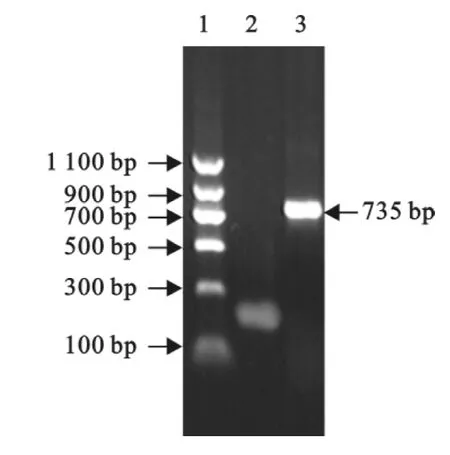
图2 SD0803sE2基因扩增Fig.2 Amplification of sE2gene of SD0803
2.2 重组表达载体pGEX-4T-1-sE2的构建
SD0803sE2基因与pGEX-4T-1构建重组表达载体,获得的阳性克隆送公司测序,测序结果表明,sE2基因插入的位置、大小均正确,证实重组质粒构建成功,命名为pGEX-4T-1-sE2。
2.3 SD0803sE2基因诱导表达及重组蛋白的鉴定
重组质粒pGEX-4T-1-sE2经诱导表达,获得的蛋白表达产物进行纯化,其中,上清Ⅰ为超声波破碎细胞,10000r/min离心10min后收集得到的上清液;加1×PBS重悬沉淀后,加入尿素,充分溶解沉淀,相同条件超声波破碎细胞,10000r/min离心10 min后收集的上清液,此上清为上清Ⅱ。用SDSPAGE电泳分析,获得分子质量约为52ku诱导表达产物,与预期大小一致(图3)。
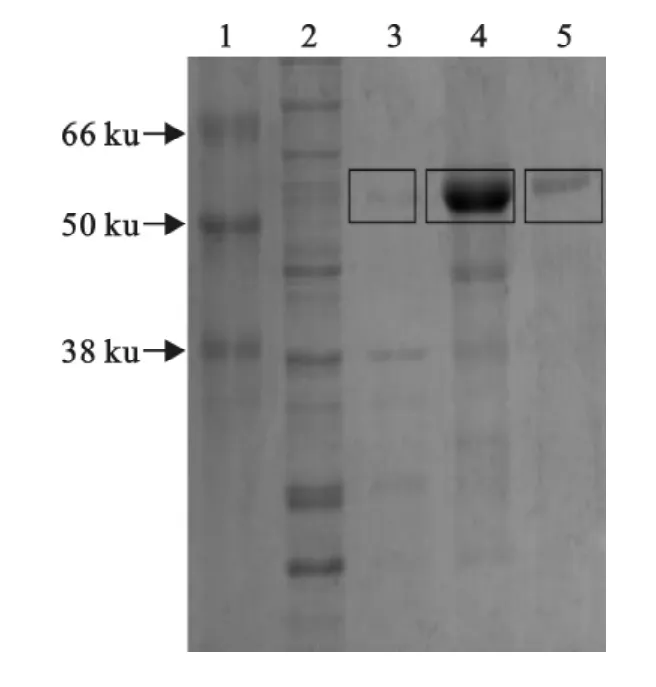
图3 SD0803sE2基因表达产物SDS-PAGE分析Fig.3 Analysis SDS-PAGE of expression product of SD0803sE2gene
2.4 抗rsE2蛋白多克隆抗体的制备
采用建立的间接ELISA,测定末次免疫1周后分离的抗血清,其抗体效价可达1∶256000,表明制备的抗体有较高的效价。
2.5 抗体特异性鉴定
2.5.1 Western blot分析 Western blot发现,一抗(抗血清纯化获得的抗体)1∶1000稀释,亦能出现约52ku特异性条带(图4),结果表明,制备的多抗具有良好的特异性与较高的效价。

图4 抗体Western blot分析Fig.4 Analysis of antibody by Western blot
2.5.2 BVDV抗原检测 间接免疫荧光试验结果,SD0803株、NADL标准株感染的MDBK细胞内出现特异性绿色荧光,结果表明,多克隆抗体分别能特异结合MDBK后分泌产生的E2蛋白(图5)。
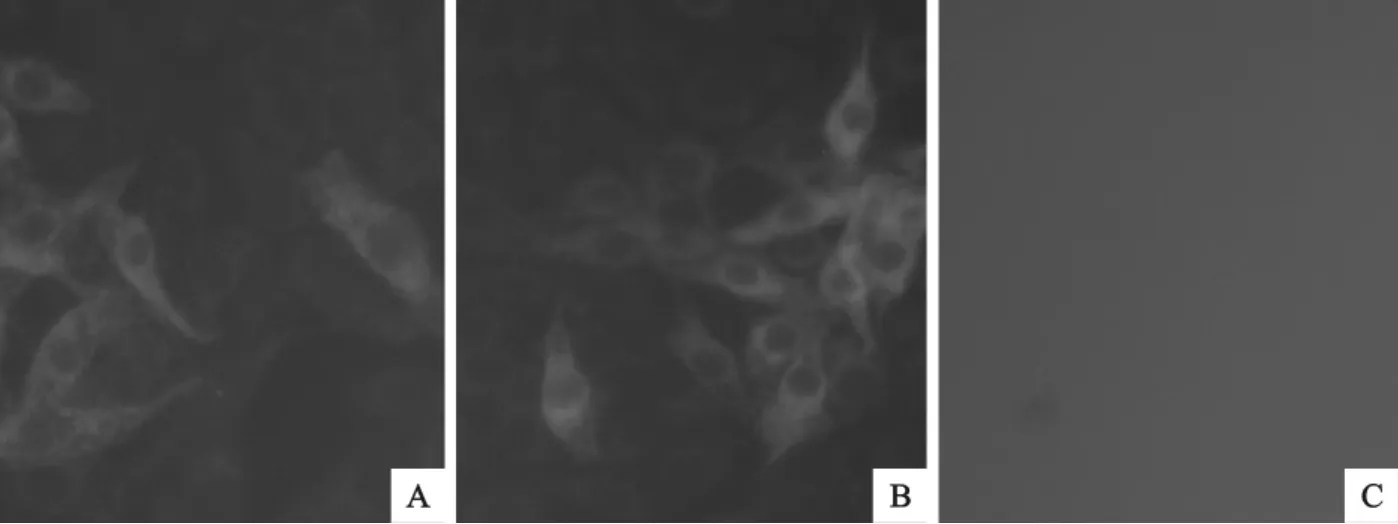
图5 BVDV E2蛋白在MDBK细胞中表达的免疫荧光检测Fig.5 Detection of BVDV E2protein expressed in MDBK with immunofluorescence assay
3 讨论
BVDV E2是病毒的主要保护性抗原,其编码的蛋白gp53是囊膜糖蛋白,受糖基化的影响,分子质量为51ku~58ku之间,介导免疫中和反应、决定BVDV抗原性及其抗体、宿主细胞识别、吸附的主要部位[12-14]。gp53具有中和作用,其N端有2个抗原域(antigenic domain),一个是种内保守的主要抗原域,另一个是不同毒株之间的特异性抗原域;其C端存在YYEP线性表位,在猪瘟病毒(Classical swine fever virus,CSFV)、边界病毒(Border disease virus,BDV)及BVDV这3种病毒内具有高度保守性,这一蛋白可作为特异性诊断工具[15]。最新试验证实,BVDV Manasi株 E2pET-(144~340)、pET-(1~300)诱导表达的融合蛋白均能被BVDV阳性血清识别[16]。通过去除BVDV Changchun184E2基因3′端编码的gp53蛋白跨膜疏水区序列,可以使该蛋白在大肠埃希菌中高效表达[17]。鉴于上述研究结果,本试验选取gp53蛋白56~324区段(sE2)表达的蛋白免疫兔,结果表明,获得的抗体能被SD0803、BVDV标准毒株NADL识别,这一结果证实所制备的抗体具有良好特异性和较高的效价。
构建的表达载体采用不同浓度的IPTG、不同诱导时间,结果发现,在37℃条件下,加1.5 mmol/L IPTG诱导4h,表达的蛋白量最多。诱导表达的蛋白经SDS-PAGE分析,发现以包涵体形式存在。由于包涵体除了含目的蛋白之外,还包含有其他成分比如细菌膜蛋白、肽聚糖、脂多糖及脂质等。一般情况下,在包涵体溶解之前可用低浓度的尿素做变性处理,溶解包涵体,可以除去大部分杂质。所以本试验中,将获得的包涵体用尿素法进行2次洗涤,以去除杂质,然后利用GST蛋白标签柱层析法纯化包涵体,从SDS-PAGE电泳结果来看,过柱纯化后包涵体蛋白杂质明显减少,rsE2蛋白纯化是成功的。
获得的抗血清,在检测其抗体效价时,为了避免非特异性反应,准确测定抗血清效价,我们选用BVDV SD0803MDBK细胞培养上清作为检测抗原包板进行间接ELISA。经检测,获得高达1∶256000效价的抗血清。在多克隆抗体鉴定方面,采用3种方法,即间接ELISA、Western blot、免疫荧光法对多克隆抗体进行鉴定,结果证实制备的多克隆抗体具有良好的反应性和特异性,为下一步建立猪源BVDV特异性诊断方法奠定了基础。
[1]Fauquet C.Virus taxonomy:classification and nomenclature of viruses:eighth report of the International Committee on the Taxonomy of Viruses[M].Academic Press,2005.
[2]Tautz N,Kaiser A,Thiel H J.NS3serine protease of bovine viral diarrhea virus:characterization of active site residues,NS4Acofactor domain,and protease-cofactor interactions[J].Virology,2000,273(2):351-363.
[3]Liu L,Xia H,Wahlberg N,et al.Phylogeny,classification and evolutionary insights into pestiviruses[J].Virology,2009,385(2):351-357.
[4]Becher P,Orlich M,Shannon A,et al.Phylogenetic analysis of pestiviruses from domestic and wild ruminants[J].J Gene Virol,1997,78(6):1357.
[5]Becher P,Orlich M,Kosmidou A,et al.Genetic diversity of pestiviruses:identification of novel groups and implications for classification[J].Virology,1999,262(1):64-71.
[6]Xu X,Zhang Q Y,Liang X,et al.Sequencing and comparative analysis of a pig bovine viral diarrhea virus genome[J].Virus Res,2006,122(2006):164-170.
[7]卫秀余,沈 强,余红梅.2009年猪病诊断回顾[J].今日养猪业,2010(1):34-35.
[8]宋永峰,张 志,张燕霞,等.猪源牛病毒性腹泻病毒的流行初探[J].中国动物检疫,2008(7):25-27.
[9]吴文辉,卫秀余,余红梅,等.猪群BVDV感染状况调查及成因初步分析[J].上海畜牧兽医通讯,2011(4):35-37.
[10]奥斯帕F M,金斯顿R E.精编分子生物学实验指南[M].4版.北京:科学出版社,2005.
[11]郑其升,杨耀武,周 斌,等.流行性乙型脑炎病毒E蛋白主要抗原域的原核表达与间接ELISA检测方法的初步建立[J].中国病毒学,2004,19(5):458-461.
[12]Harada T,Tautz N,Thiel H J.E2-p7region of the bovine viral diarrhea virus polyprotein:processing and functional studies[J].J Virol,2000,74(20):9498.
[13]Tscherne D M,Evans M J,Macdonald M R,et al.Transdominant inhibition of bovine viral diarrhea virus entry[J].J Virol,2008,82(5):2427.
[14]Harpin S,Hurley D J,Mbikay M,et al.Vaccination of cattlewith a DNA plasmid encoding the bovine viral diarrhoea virus major glycoprotein E2[J].J Gen Virol,1999,80(12):3137.
[15]Yu M,Wang L F,Shiell B J,et al.Fine mapping of a C-terminal linear epitope highly conserved among the major envelope glycoprotein E2(gp51to gp54)of different pestiviruses[J].Virology,1996,222(1):289-292.
[16]黄 新,王新华,钟发刚.牛病毒性腹泻病毒玛纳斯株E2基因的克隆及其主要抗原表位区的分段表达[J].中国兽医科学,2009(4):321-326.
[17]徐兴然.牛病毒性腹泻病病毒中国毒株E2基因的鉴定及表达E2蛋白的抗原性研究[D].吉林长春:中国人民解放军军需大学,2002.
