微生物源性抗氧化剂对大鼠繁殖损伤的修复作用研究
2012-06-29上海交通大学农业与生物学院
上海交通大学农业与生物学院
上海市兽医生物技术重点实验室 陈小连 孙婷婷 徐建雄*
畜禽在氧化应激状态下,体内产生大量的自由基,使机体DNA、生物膜脂质、蛋白质等生物大分子发生损伤,动物表现为生产性能下降,最终导致疾病的发生甚至死亡(Valko等,2006)。动物的生产繁殖是一项长期的、繁重的任务,而这种长期、繁重的特殊应激必然会导致机体的损害,导致“生殖应激综合征”(文利新和袁慧,2008)。母体长期处在生殖应激条件下,血液生理生化改变、免疫力减弱、抗病力下降、生成大量自由基,造成机体生殖功能障碍以及并发多种疾病。目前,有关自由基在生殖和性发育过程中的作用的研究相对较少。本研究以脂多糖(LPS)作为自由基的诱发剂,微生物源性抗氧化剂作为自由基的清除剂,探讨自由基对大鼠繁殖性能及仔鼠生长性能的影响。
1 材料与方法
1.1 试验材料 微生物源性抗氧化剂由上海创博生态工程有限公司提供;试验用SD大鼠和大鼠基础日粮购于购自上海西普尔-必凯试验动物有限公司。LPS购于美国Sigma公司,编号为L-2880;促卵泡激素(FSH)和雌二醇(E2)放射免疫分析试剂盒购于北京科美东雅生物技术有限公司。
1.2 试验设计与饲养管理 试验选用70日龄健康 SPF 级 SD 大鼠 64 只,体重(270±30)g,雌雄各半,随机分成4组,每组16只,雌雄各半,分别为:对照组、抗氧化剂组、损伤模型组和损伤修复组。对照组和损伤模型组饲喂基础日粮,抗氧化剂组和损伤修复组饲喂基础日粮并在饮水中按每只每天0.8 mL添加微生物源性抗氧化剂。损伤模型组和损伤修复组在试验的第 5、9、13、17天下午 4∶00分别按每千克体重腹腔注射1 mg LPS,对照组和抗氧化剂组在同一时间用相同方法注射等量的生理盐水。大鼠饲养于动物房内,温度为28~32℃,相对湿度50%~60%,光照明暗各12 h,每笼8只,雌雄分饲,自由进食与饮水。
1.3 试验方法 试验分预试期7 d,全部饲喂基础日粮,自由饮水;正试期开始按试验设计饲喂试验日粮、饮水、注射LPS和生理盐水。在正试期的第17天,即配种前1 d,每组各取出4只雄鼠称重,然后用颈椎脱臼法处死、解剖,迅速将其睾丸和附睾取出,剔除多余结缔组织,生理盐水冲洗,滤纸吸干,在精密电子天平上称重,测定睾丸和附睾的重量系数。取一侧附睾用作精子分析。在试验第18天将各组余下的4只雄鼠分别按1雄2雌的比例与对应组雌鼠合笼交配。每天下午4点合笼,次日早上8点将其重新分开,若次日早上在笼内发现有乳白色、触之较硬的固态胶状物即为阴道栓,可判定为怀孕,连续3 d。在试验第22天,测定每组剩余4只雄鼠睾丸和附睾的重量系数并做精子分析。
1.4 测定指标
1.4.1 雌鼠繁殖指标 记录交配雌鼠数,计算受孕率、正常分娩率、妊娠雌鼠产活仔数,称量仔鼠初生窝重、断奶重,记录断奶数、计算仔鼠育成率、仔鼠日增重以及雌鼠生育综合指数。测定雌鼠正试期第14天和第22天血清中促卵泡激素和雌二醇(E2)的浓度。
生育综合指数=平均每只雌鼠成活仔数×断乳时平均仔重。
1.4.2 雄鼠生殖发育指标 计算雄鼠配种前后睾丸和附睾的重量系数,并作精子分析,计算精子数量、活动率和精子活力。
1.5 数据统计与分析 试验数据利用SAS 6.12统计软件进行统计处理,以LSD法进行组间多重比较,试验结果以平均数±标准差表示。
2 结果与分析
2.1 微生物源性抗氧化剂对雌鼠繁殖性能和生殖激素的影响 由表1可知,抗氧化剂组雌鼠受孕率最高,比对照组高16.67%,损伤模型组和损伤修复组分别比对照组低33.3%和23.81%。各组妊娠雌鼠均能正常分娩,产活仔数相当,其中抗氧化剂组和损伤修复组产活仔数均比对照组多10.00%。离乳仔数仍然是抗氧化剂组最多,其次是损伤修复组、损伤模型组、对照组。
损伤模型组仔鼠的初生重显著低于对照组(P < 0.05),其他各组之间无显著差异(P > 0.05)。在初生窝重、断奶重和仔鼠日增重方面,损伤模型组均显著低于其他各组(P<0.05),其中初生窝重比对照组低16.92%,抗氧化剂组和损伤修复组的断奶重都稍高于对照组(P>0.05);损伤模型组的仔鼠日增重比对照组低23.81%,抗氧化剂组比对照组高10.88%。抗氧化剂组和损伤修复组的断奶窝重显著高于其他两组(P<0.05),分别比对照组高38.63%和22.09%。损伤模型组最低,低于对照组12.34%。对照组的育成率显著低于其他各组 (P<0.05)。各组生育综合指数由高到低排列依次为:抗氧化剂组>损伤修复组>对照组>损伤模型组。抗氧化剂组和损伤修复组分别比对照组高125.80和74.65,损伤模型组比对照组低40.18。
由表2可见,试验第14天,损伤修复组雌鼠血清中FSH的浓度比损伤模型组高13.92%,并且差异显著(P<0.05),对照组、抗氧化剂组和损伤模型组之间无显著差异(P>0.05)。试验第22天损伤模型组比对照组低18.18%,且差异显著(P<0.05),对照组、抗氧化剂组和损伤修复组之间无显著差异(P>0.05)。试验第14天,抗氧化剂组雌鼠血清中E2的浓度显著高于其他各组,损伤模型组的显著低于其他组(P<0.05),损伤修复组和对照组无显著差异。试验第22天,抗氧化剂组雌鼠血清E2浓度显著高于其他组 (P<0.05),损伤模型组和损伤修复组分别比对照组高36.92%和54.51%,但差异不显著(P>0.05)。
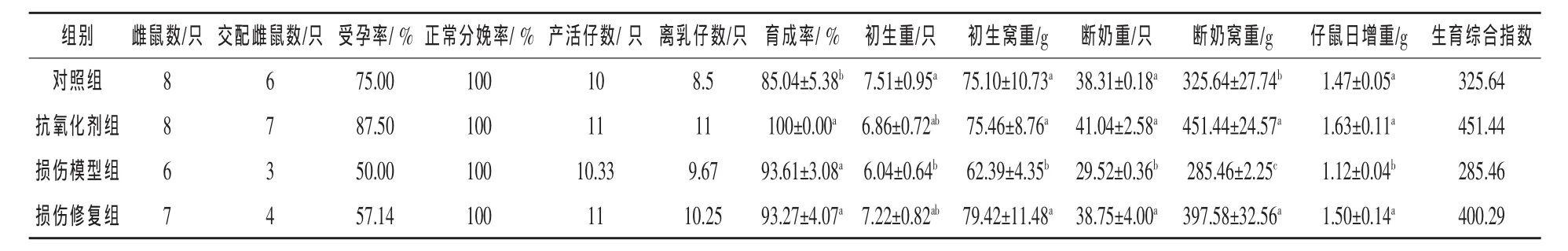
表1 各组雌鼠繁殖性能的比较
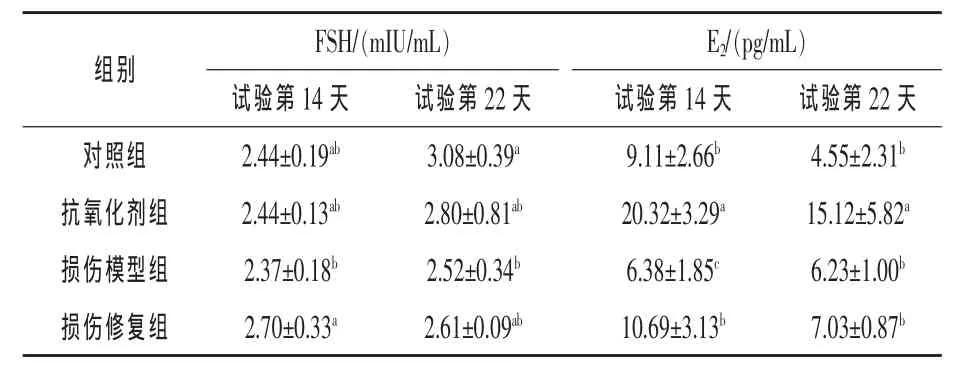
表2 各组雌鼠血清中FSH和E2的浓度
2.2 微生物源性抗氧化剂对雄鼠生殖发育的影响 由表3可见,试验第17天,抗氧化剂组的睾丸系数著显高于损伤模型组和损伤修复组 (P<0.05),与对照组无显著差异(P > 0.05);各组附睾系数无显著差别(P>0.05)。各组精子数量均有显著差异,损伤模型组显著低于其他各组,抗氧化剂组显著高于其他各组(P<0.05),损伤修复组比损伤模型组多5.48×105/mL(P<0.05)。 精子活动率各组间差异均显著(P<0.05),由大到小依次为抗氧化剂组、对照组、损伤修复组、损伤模型组。抗氧化剂组的a级精子数明显高于对照组和损伤组(P<0.05),损伤修复组显著高于损伤模型组 (P<0.05),但与对照组和抗氧化剂组无显著差异(P>0.05)。
试验第22天,抗氧化剂组的睾丸系数显著高于其他3组(P<0.05),其他3组间无显著差异;对照组和抗氧化剂组的附睾系数均显著高于损伤模型组和损伤修复组 (P>0.05)。各组精子数量差异均显著,其中抗氧化剂组比对照组多11.50×105/mL,损伤修复组比损伤模型组多4.52×105/mL(P<0.05)。精子活动率各组间差异显著,其中抗氧化剂组比对照组高4.53%,损伤修复组比损伤模型组高13.32%。抗氧化剂组的a级精子数显著高于其他各组,对照组和损伤修复组差异不显著,而损伤模型组的数目显著低于其他各组。
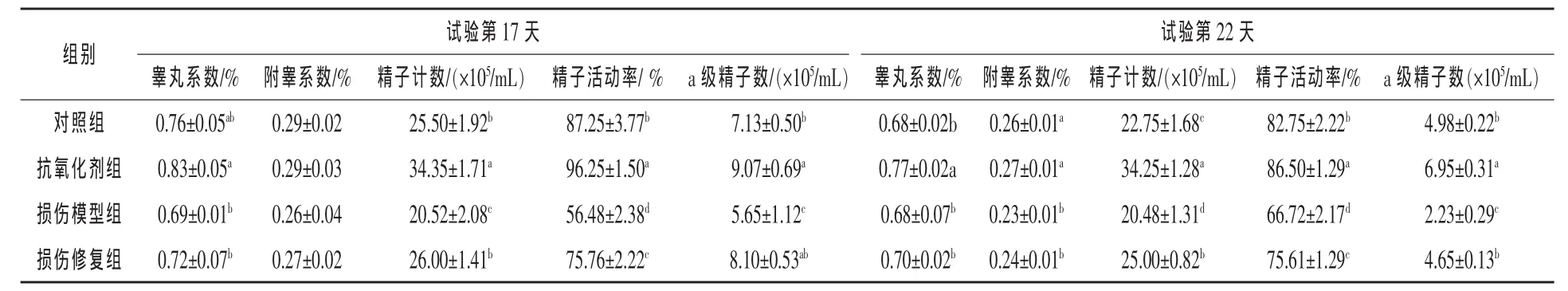
表3 微生物源性抗氧化剂对雄鼠睾丸和附睾重量系数及精子质量的影响
3 讨论
3.1 脂多糖对大鼠繁殖性能的影响 LPS是内毒素的主要成分,存在于革兰氏阴性细菌的细胞壁外膜,是介导全身炎症反应的重要物质,它可激发免疫细胞产生大量炎性细胞因子,如TNF-α、IL-1和IL-6等,炎性细胞因子可刺激巨噬细胞产生大量活性氧(ROS)和活性氮中间体(RNIs),通过消耗体内内源性抗氧化剂,如超氧化物歧化酶(SOD)、过氧化氢酶、谷胱甘肽和VE等改变体内抗氧化系统,引起氧化应激,导致机体损伤(Bharrhan等,2010)。由大量自由基造成的胚胎细胞膜脂质过氧化和线粒体的结构异常,会使胚胎发育减缓或终止(刘斌,2002),所以本试验中损伤模型组仔鼠的初生重和初生窝重都显著低于对照组(P<0.05)。同时因为内毒素的注射导致了雌鼠乳腺的氧化损伤,减弱了其泌乳能力,所以损伤模型组仔鼠的断奶重和断奶窝重显著下降,该组仔鼠的育成率也相对较低。
LPS对雌性动物生殖功能具有抑制作用,其可以抑制卵母细胞的成熟,使异常卵母细胞数增多(郑月慧等,2006)。LPS干扰卵泡发育、成熟和排卵的机制还不清楚。因为卵泡发育和成熟受多因素的调控,其中局部E2和一些细胞因子等起重要的作用。本研究发现,试验第14天,损伤模型组血清中FSH和E2浓度最低,说明LPS在抑制卵泡发育的同时伴有E2的下降。这和郑月慧等(2006)的研究结果一致。故LPS抑制卵泡发育和成熟可能与抑制E2的产生有关。损伤模型组受孕率最低可能是由于注射LPS后体内产生大量自由基,使生殖器官受到损伤,从而雌鼠雌激素分泌下降,雄鼠精子数量与质量降低。
LPS对雄性动物生殖功能也有影响,表现降低雄鼠睾丸和附睾系数及精子密度和精液品质。脏器系数在一定程度上可反映其功能的强弱,注射LPS降低了睾丸和附睾正常的生化状态,在一定程度上降低了其生殖能力。这可能是因为LPS通过开放睾丸血管内皮细胞的紧密连接,使大量的炎症细胞(中性粒细胞等)进入睾丸间质中,这些炎症细胞释放细胞因子发生炎症反应而引起自由基增多致过氧化损伤。精子数目是衡量雄性动物生殖能力的一个指标。本试验中,损伤模型组精子数目最少。说明注射LPS可以使精子数目大大减少,这可能是因为LPS诱导下,间质细胞、支持细胞功能改变,致使睾丸局部生精微环境发生变化,可能导致生精障碍(薛丽英等,2000)。精子运动是正常成熟精子的一个重要功能。这种功能保证生殖过程中精卵相遇,也参与精子对卵的机械穿透作用。精子运动低下被认为是雄性动物不育的主要原因,而且比总数降低和畸形精子数增多更重要(Cai和 Marik,1989)。 本试验中,注射 LPS组精子活动率最低,a级精子数也最少。
3.2 微生物源性抗氧化剂对大鼠繁殖性能的影响 畜禽产生氧化应激后,一般可通过腹膜或静脉注射及营养调控等手段添加抗氧化剂来缓解(Gupta等,2009;Berg等,2004)。 本试验用微生物源性抗氧化剂由光合菌和酵母菌等发酵生产,含有来源于光合菌、酵母菌及其培养物的胡萝卜素、维生素 B1、维生素 B2、维生素 B12、还原型 VC、槲皮酮-3-D吡喃葡萄糖(栎素)、槲皮酮(类黄酮)、肌醇和多种微量元素的金属衍生物,大量研究表明,这些物质都具有抗氧化功效。
本试验表明,添加微生物源性抗氧化剂提高了雌鼠生殖激素水平、受孕率和生育综合指数及仔鼠的断奶窝重和育成率,说明该抗氧化剂能提高大鼠繁殖性能和仔鼠的生长性能。抗氧化剂组的E2显著高于对照组,而且损伤修复组浓度也比损伤模型组高,说明微生物源性抗氧化剂有增强E2分泌的效果。这可能是因为许多生物类黄酮在结构上与己烯雌酚相似而具有雌性激素样作用,对雌激素具有双重调节作用,从而维持机体适宜的雌激素水平。尤其在体内雌激素水平低的情况下,与雌激素受体结合,发挥其作用,表现出弱雌激素作用(陈辉等,2006)。E2除对生殖系统有影响外,还对各种外源刺激导致免疫系统、消化系统等的功能紊乱和器质性损伤具有调整和保护作用(郑月慧等,2006)。这也可能是添加微生物源性抗氧化剂鼠只生长性能较好的原因。
本试验中抗氧化剂组的睾丸重量系数和附睾重量系数均比相应对照组高,损伤修复组也在一定程度上高于损伤模型组,说明微生物源性抗氧化剂在一定程度上提高了雄鼠的生殖能力,并对LPS引起的生殖损伤有一定的修复作用。可能是因为微生物源性抗氧化剂提高了生殖器官的抗氧化能力,尤其是缓解了LPS造成的过氧化损伤。
抗氧化剂组大鼠精子数量高于对照组,损伤修复组相应的比损伤模型组高,精子活动率和a级精子数也呈相似的变化趋势。这说明微生物源性抗氧化剂对大鼠精子数量有较明显的增强作用。精子数量增加的机制可能有两个。第一个机制是抗氧化剂激发了成熟的精子从生精上皮释放,因而增加了精子进入流出管道系统的数量。另一个机制是减慢了精子通过流出管道的速度,或者是减少了对精子的吞噬(Mazaro等,2000)。正常大鼠精子被流出管道上皮吞噬仅发生于输精管的末段。精子活动率高,a级精子数多,说明添加微生物源性抗氧化剂使精子运动能力高,生殖能力强。
4 结语
本试验结果表明,微生物源性抗氧化剂可以提高大鼠繁殖性能,表现为雌鼠生育综合指数明显提高,血清中雌二醇含量升高,雄鼠精子数量增多,精子运动能力提高,对LPS致机体繁殖损伤有一定的修复作用。
[1]陈辉,黄仁录,邸科前.类黄酮化合物在动物营养中的研究进展[J].饲料工业,2006,27(6):10 ~ 12
[2]刘斌.小鼠早期胚胎发育过程中活性自由基生成机制初探:[硕士学位论文][D].湖南:湖南农业大学,2002.
[3]文利新,袁慧.动物生殖应激综合征[J].中国兽医学报,2008,28(7):867 ~870.
[4]薛丽英,李杰,王更新,等.脂多糖诱导的非特异性炎症对大鼠睾丸功能的影响[J].生殖与避孕,2000,26(2):77 ~ 80.
[5]郑月慧,戴育成,肖秋香,等.内毒素对小鼠卵泡发育、成熟及排卵功能的影响及雌性激素的保护作用[J].生殖医学杂志,2006,15(3):188~191.
[6]Berg B M,Godbout J P,Kelley K W,et al.Alpha-tocopherol attenuates lipopolysaccharide-induced sickness behavior in mice[J].Brain,behavior,and immunity,2004,18:149 ~ 157.
[7]Bharrhan S,Chopra K,Rishi P.Vitamin E supplementation modulates endotoxin-induced liver damage in a rat model[J].American Journal of Biomedical Sciences,2010,2(1):51 ~ 62.
[8]Cai X Q,Marik J J.Improving penetrating capacity of spermatozoa with poor motility of caffeine at coincubation with zona-free hamster ova[J].Fertility and Sterility,1989,51:719 ~ 721.
[9]Gupta A,Vij G,Sharma S,et al.Curcumin,a polyphenolic antioxidant,attenuates chronic fatigue syndrome in murine water immersion stress model[J].Immunobiology,2009,214:33 ~ 39.
[10]Mazaro R,Di Stasi L C,Vieira Filho S A,et al.Decrease in sperm number after treatment of rats with Austroplenckia populnea[J].Contraception,2000,62(1):45 ~ 50.
[11]Valko M,RhodesC J,MoncolJ,etal.Free radicals,metalsand antioxidantsin oxidativestress-induced cancer [J].Chemico-biological interactions,2006,160:1 ~ 40.
