嗅成鞘细胞与神经干细胞共移植对阿尔茨海默病大鼠的治疗作用
2012-06-28姚柏春孙天敏唐慕湘王金勇王配军
姚柏春 孙天敏 冯 娜 王 军 唐慕湘 王金勇 王配军
(湖北医药学院,湖北 十堰 442000)
临床治疗阿尔茨海默病(AD)主要是改善患者学习记忆功能,无法补充大脑皮层、基底前脑和海马大量丢失的神经元、神经突触和神经递质。已有研究应用神经干细胞(NSCs)移植治疗AD,但效果不够理想〔1,2〕。本研究用嗅成鞘细胞(OECs)与NSCs共移植于AD大脑,探讨其对AD的作用,为临床有效治疗AD提供实验依据。
1 材料与方法
1.1 实验动物与主要试剂 健康雄性SD大鼠,SPF级,7~9月龄,体重250~300 g;另孕16~18 d SD大鼠4只,均由湖北医药学院实验动物中心〔许可证号:SCXK(鄂)2005-0008〕提供。DMEM/F12、无血清培养液添加剂 B27、表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、Hoechst33258、胰蛋白酶(Gibco);20%胎牛血清FBS(PAA);突触素抗体(Sigma);兔抗鼠Nestin单克隆抗体、鼠抗鼠NF200单克隆抗体(Santa Cruz);大鼠β淀粉样蛋白1-40(Aβ1~40)(Biosource);多聚赖氨酸、兔抗鼠GFAP多克隆抗体、小鼠抗大鼠P75多克隆抗体、胆碱乙酰转移酶(ChAT)抗体、羊抗鼠IgG:TRITC(武汉博士德)。
1.2 OECs培养及鉴定〔3,4〕无菌条件下剖腹取8~10只SD胎鼠(孕 16~18 d)嗅球最外二层(神经层、小球层),经0.125%(W/v)胰蛋白酶消化和机械吹打分散成单细胞悬液,以1×106/ml细胞密度种植于含20%胎牛血清的DMEM/F12培养液的25 cm2玻璃培养瓶中;在培养的第12和24小时分别进行两次差速贴壁处理;第7天加入5×10-5mol/L的阿糖胞苷(Ara-C),作用48 h(除去成纤维细胞)后全量换液消除Ara-C的作用;加入bFGF 10 ng/ml培养5 d,扩增OECs;以后每3天半量换液一次。每天在倒置显微镜下进行形态学观察并摄片,记录细胞生长情况。第14天按照ABC法进行神经生长因子受体(NGFRp75)免疫细胞化学染色鉴定,并计算OECs的纯度;收集培养细胞(密度为1×107/ml)备用或冻存。
1.3 NSCs培养及鉴定〔5〕无菌条件下剖腹取8~10只SD胎鼠(孕16~18 d),分离大脑皮质,放入D-Hank's液漂洗2次,转移至4℃基础培养基,用镊子在解剖显微镜下仔细分离、除去表面毛细血管及软脑膜,用眼科剪剪碎组织块至0.5 mm3大小。用滴管吸入离心管、反复吹打后,用200目筛网过滤,滤液离心800 r/min 5 min去上清、重悬,台盼蓝染色细胞计数、以1×106/ml细胞密度接种于含完全培养液的25 cm2培养瓶中,移入37℃、5%CO2培养箱中培养。每天用倒置显微镜观察细胞生长状态,根据细胞生长速度2~3 d半量换液,换液后,以玻璃滴管酌情吹打,使增殖的神经球尽量散开。当大部分神经球增大到100~200个细胞左右时进行传代。用特异性抗原Nestin免疫荧光染色鉴定 NSCs。收集培养细胞(密度为1×107/ml)备用或冻存。
1.4 OECs和NSCs共培养 NSCs悬液的制备。取SD胎鼠(孕16~18 d)大脑皮层组织,捣碎、过滤,收集细胞培养、传代,所获NSCs进行Nestin免疫荧光鉴定,并以Hoechst33258荧光标记NSCs,以800 r/min离心5 min,最后调整细胞浓度为1×107/μl。OECs悬液的制备。取SD胎鼠(孕16~18 d)嗅球,捣碎并用胰酶消化,所得细胞培养、传代纯化,获取OECs进行NGFRp75免疫荧光鉴定,以800 r/min离心5 min,最后调整细胞浓度为1×107/μl。原代OECs生长到10 d左右,待其贴壁,弃去OECs的血清培养液,用无菌PBS浸洗三次,后将传代后悬浮生长约5 d的神经球加于OECs上,使OECs和NSCs共用一个培养液体系,此时培养液更换为维持培养液,每3天半量换液。每天在倒置显微镜下观察细胞增殖情况。
1.5 建立大鼠 AD模型 将 Aβ1~40溶于无菌生理盐水(5μg/ml),放入37℃温箱孵育2 w,使其变成丝状聚集状态。用35 g/L的戊巴比妥钠(35 g/kg)将大鼠麻醉,双侧海马注射2 μl(10 μg)Aβ1~40,10 min 内注完,并留针 10 min。单笼饲养至大鼠完全清醒,肌肉注射庆大霉素。Aβ1~40海马注射后第7天用Y型电迷宫检测,若大鼠学习记忆能力明显减退,随机从其中抽取10%经Nissl、刚果红组织学染色,出现神经细胞减少、Aβ斑和老年斑(SP),则该批大鼠确定为AD模型成功鼠。将AD模型鼠随机分为NSCs移植组、NSCs与OECs移植组、AD模型组,各30只,另正常对照组30只SD健康大鼠共4组。
1.6 各组大鼠细胞移植
1.6.1 Hoechst33258荧光标记NSCs 离心收集好的细胞里加入新鲜DMEM/F12培养基3~4 ml,移液管反复吹打形成细胞悬液,加入核荧光标记物 Hoechst33258,使之作用浓度为10μg/ml,迅速晃动混匀后移入37℃、5%CO2培养箱中孵育30 min,取少量悬液进行台盼蓝活细胞计数,调整OECs浓度为5×106/ml备用。
1.6.2 细胞移植操作 将AD模型成功鼠在实验动物中心继续普食喂养1 w,即Aβ1~40海马注射2 w后,用于下一步实验。用戊巴比妥钠将大鼠麻醉,用微量进样器给药,注射速度为0.5μl/min。①NSCs移植组:两侧移植点各注射NSCs细胞悬液5μl(约含5×104个细胞)。②NSCs与OECs共移植组:注射NSCs与OECs细胞悬液5μl(约含5×104个 NSCs、5×104个OECs)。③AD模型组:注射5μl 0.85%的盐水。④正常对照组:不作任何处理。被移植注射的NSCs进行过荧光标记。骨蜡封闭颅骨,缝合头皮。单笼饲养至大鼠完全清醒,肌肉注射青霉素,密切观察实验动物4 w。
1.7 行为学测试 细胞移植后第4周开始,用Morris水迷宫测试各组大鼠学习记忆能力。
1.8 免疫组织化学染色 行为学测试后,细胞移植后第28天,将各组大鼠麻醉后打开胸腔,经左心室、主动脉快速灌注200 ml生理盐水(右心耳切开)洗净血液,然后固定。1 h后取脑,后固定2 h,放入150,200,300 g/L蔗糖磷酸盐缓冲液,梯度脱水,隔夜沉底。OCT包埋后入 -70℃冷丙酮速冻,移至-28℃恒冷箱冰冻切片机平衡温度后连续冠状切片,片厚30μm。①荧光免疫组织化学染色:取相邻海马脑切片,4℃丙酮固定10 min,晾干;0.3%H2O2室温10 min;0.125%胰酶消化15 min;2%正常山羊血清封闭,室温孵育15 min;滴加一抗(抗NF-200抗体,1∶400;抗 GFAP抗体,1∶50;抗 ChAT抗体,1∶400),4℃孵育 24 h;滴加 1∶50 稀释的 TRITC 标记 IgG,37℃孵育40 min。甘油缓冲液封片。0.02 mol/L PBS做阴性对照。②免疫组织化学染色法:一抗为抗 SYN抗体(1∶200)、NGFRp75 抗体(1∶200)。
1.9 图像处理 每只大鼠取含海马注射点对应部位5张不同断面切片,这些切片在4组保持断面一致。每个指标计数5张染色切片,每张染色切片光镜下随机计数10个非重叠视野(200倍),分别计数细胞总数和阳性细胞数,计算阳性细胞比例(阳性细胞数/细胞总数),结果用百分率表示。采用Leica图像分析系统对免疫组化结果进行积分吸光度(IA)测定。
1.10 统计学方法 应用SPSS17.0统计软件包进行分析,数据均用x±s表示,两组间均数比较用t检验。
2 结果
2.1 各组大鼠学习记忆能力的变化 细胞移植后第4周,与AD模型组比较,NSCs移植组潜伏期明显缩短、通过平台次数明显增加(P<0.05);与NSCs移植组比较,NSCs与OECs移植组的潜伏期、通过平台次数有显著性差异(P<0.05),接近正常对照组(P>0.05)。见表1。
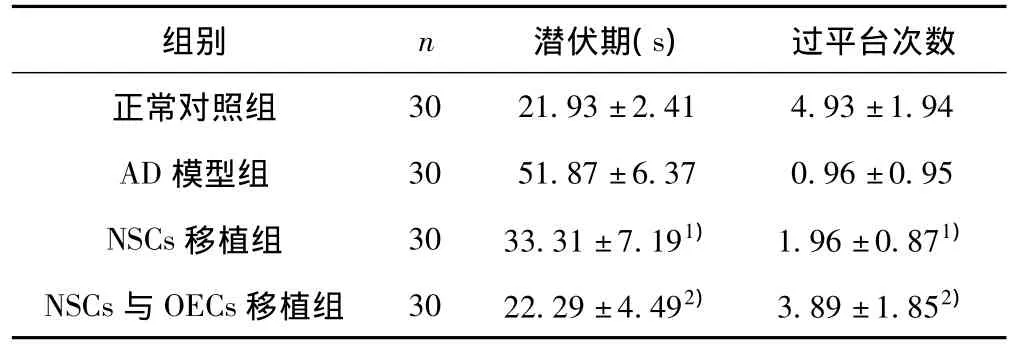
表1 各组大鼠Morris水迷宫试验结果比较(x±s)
2.2 移植细胞的存活和迁移 ①NSCs:细胞移植4 w后,在荧光显微镜下观察脑片,Hoechst33258标记的移植细胞呈黄绿色荧光,细胞大多呈圆形,大小不一。移植细胞迁移较明显,除移植位点和针道内有密集黄绿色亮点或团块外,部分移植细胞沿海马回向两侧迁移,并排列成黄绿色条带状。在海马回内,迁移细胞向内侧接近第三脑室,向外侧达到侧脑室上方。②OECs:倒置显微镜下观察,OECs移植28 d后,大鼠的大脑组织切片中有大量P75 DAB显色阳性的细胞,表明植入脑内的OECs存活数量较多,并且从注射部位分别向两侧海马区及其周围皮质迁移。
2.3 移植细胞NSCs的分化 NSCs移植4 w后,免疫荧光检测明显可见 NF-200、GFAP、ChAT免疫阳性反应。Hoechst33258/NF-200双标阳性细胞,多位于移植细胞的周边部位,其双标阳性细胞的形态为成熟神经元,胞体中央细胞核大而圆,胞浆少,细胞膜发起突起,可见延伸较长的轴突。Hoechst33258/GFAP双标阳性细胞,多位于大脑皮层,胞体中央有一个大而圆的核,胞浆少,有多个较长的突起,细胞形态已发育成熟。可见到少量Hoechst33258/ChAT双标阳性细胞,胞核大,胞浆少,为圆形或椭圆形。移植组移植神经干细胞分化为神经元的百分率及其比较见表2。
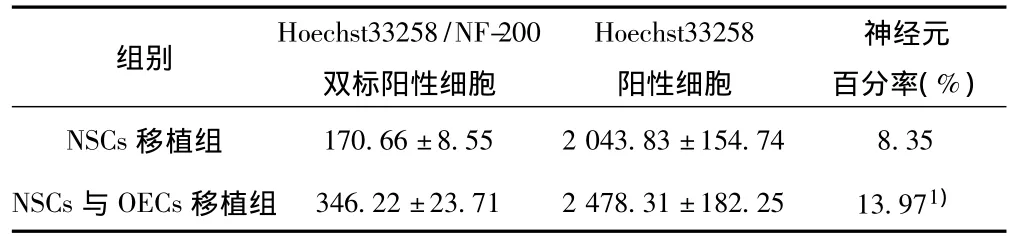
表2 移植组移植神经干细胞分化为神经元的百分率比较(x±s,%,n=30)
2.4 大鼠海马突触素的表达 突触素的表达呈颗粒状,主要分布在海马CA1、CA3区多形层、分子层以及齿状回,沿其长轴呈点状走行。正常对照组IA为(0.429±0.147),AD模型组为(0.276±0.107),NSCs移植组较 AD模型组明显增多〔(0.355±0.119),P <0.05〕,NSCs与 OECs移植组与 NSCs移植组明显增多〔(0.417±0.139),P <0.05〕。
3 讨论
NSCs移植作为AD的一种新兴治疗方法。NSCs移植治疗AD的效果在很大程度上取决于植入的NSCs分化为神经元的多少及其在结构和功能上与宿主神经系统的整合程度,也就是说,移植到体内的NSCs分化的神经元要发挥治疗作用必须与宿主神经元形成突触连接,建立功能性神经回路,释放神经递质,产生神经营养因子或保护因子,改变脑组织对损伤的反应,帮助受损神经元修复。本实验结果表明体外培养的NSCs移植后在AD大鼠脑内能够存活,并沿海马回向两侧迁移,能分化形成神经胶质细胞和神经元,特别是胆碱能神经元能有效改善AD模型鼠的学习、记忆能力。
然而,我们观察到,移植入AD大鼠脑内的NSCs分化形成的神经元细胞数量并不是很多。国内外研究〔2,5〕也证实了这一点。这可能与下列因素有关:①AD脑海马区域内的微环境与离体血清诱导分化的微环境有明显的不同,微环境差异影响了NSCs的存活、迁移与分化;②作为干细胞的标记物,Hoechst33258在DNA修复过程中会逐渐消失,导致了观察的误差。所以有必要寻找更好的标记手段,如绿色荧光蛋白(GFP)或Lac Z基因转染细胞(下一步工作)。因此,对NSCs在体外适当诱导,使其分化为神经元或神经胶质细胞的前体细胞再进行移植;或者直接移植于AD脑病变区域并采用某种因素改善局部的微环境,有可能取得更好的移植效果。
本研究表明,NSCs与OECs共同移植更有利于提高NSCs分化为神经元的分化率,更有利于AD大鼠海马CA1区突触素的表达。我们认为,其可能的原因为嗅成鞘细胞通过五个方面〔6〕:①OECs分泌的神经生长因子与神经元表达的相应受体结合,②OECs膜表面黏附分子的作用,③OECs的成鞘作用,④OECs的迁移性,⑤OECs抑制胶质增生等,为NSCs的生存提供一个适宜生长条件,从而使NSCs的生长增殖达到一个相对良好的阶段,从而提高NSCs的存活、增殖和分化率,特别是促进分化的神经元轴突再生,建立植入神经元与宿主脑神经元之间的联系,从而改善AD大鼠的学习记忆能力及病理损害。
1 杨 春,白琳琳,王书春,等.神经干细胞移植对阿尔茨海默病大鼠海马神经分化和功能的影响〔J〕.郑州大学学报(医学版),2009;44(4):751-4.
2 杨 春,白琳琳,王书春,等.移植入阿尔茨海默病大鼠海马内神经干细胞的存活、迁移和分化〔J〕.中国老年学杂志,2010;30(6):779-81.
3 袁碧波,蔡文琴,孙 榆.嗅球成鞘细胞的培养纯化及与功能相关的形态学研究〔J〕.第三军医大学学报,2003;25(17):1540-3.
4 范志海,沈忆新.成年大鼠嗅球和嗅黏膜嗅鞘细胞的培养纯化与生物学特性的研究〔D〕.苏州大学,2006.
5 穆丽芳,何 成.嗅鞘细胞体外诱导神经干细胞定向分化的研究〔D〕.第二军医大学,2008.
6 赵君朋,雷季良.嗅成鞘细胞移植促中枢神经再生的研究进展〔J〕.神经解剖学杂志,2003;19(3):334-7.
