TBX5基因rs3825214位点多态性和心房颤动的相关性
2012-06-28王亚珠范晋奇殷跃辉
李 瑛 王亚珠 范晋奇 殷跃辉
(重庆医科大学附属第二医院心内科,重庆 400010)
越来越多的报道揭示了基因变异与房颤的关联〔1,2〕,包括离子通道、结构重塑、心脏发育相关的基因〔3~6〕,这些致病基因主要通过对心房各种离子通道的结构和功能改变来影响房颤的发生或维持。在这些房颤的分子遗传学研究中,参与早期心脏发育的基因与房颤的相关性却少有报道。TBX5基因对早期心脏的正常发育起着至关重要的作用,TBX5基因变异可导致心房结构的形成和发育异常,影响心房的结构和功能,增加房颤发生的机会〔7〕。本研究通过对TBX5基因rs3825214位点单核苷酸多态性(SNPs)的研究,探讨TBX5基因rs3825214位点多态性与房颤的相关性。
1 资料与方法
1.1 研究对象 选择2009年6月至2010年12月就诊于我科门诊和住院患者,房颤组100例和对照组107例。研究对象入选标准:房颤组:①年龄18~75岁,男女不限;②确诊房颤,依据明确的心电图或动态心电图资料,以及明确的临床症状和病史。对照组:选择与病例组基础临床资料相匹配的同期住院患者,①年龄18~75岁,男女不限;②无房颤病史。排除标准:排除风湿性心脏瓣膜病、扩张型心肌病、肥厚型心肌病、病毒性心肌炎、继发性高血压、甲状腺功能亢进、电解质紊乱、恶性肿瘤、肝肾功能不全等疾病。100例房颤病例和107例对照病例的临床资料(表1)。两组患者的性别、年龄、体重指数、吸烟史等一般资料无显著差异(P>0.05);在左右心房内径上有显著差异(表1)。
1.2 房颤组和对照组的基本特征检测指标 性别、年龄、体重指数(BMI)、吸烟、饮酒、冠心病史、高血压病史、糖尿病史等。
1.3 基因组DNA提取 采集所有入组病例外周静脉血2 ml,用天根全血DNA提取试剂盒(DP318)提取全基因组DNA,-20℃冰箱储存备用。
1.4 基因型检测 采用巢氏聚合酶链反应(PCR)扩增含有目的位点的片段。PCR扩增反应体系为25μl,第一轮反应体系包括模板DNA 2μl,PCR预混试剂〔宝生物工程(大连)有限公司〕12.5μl,第一对引物上下游引物各20 pmol,加去离子水至25μl。第二轮反应体系包括模板2μl(第一轮PCR产物加水稀释10倍),PCR预混试剂12.5μl,第二对引物上下游引物各20 pmol,加去离子水至25μl。扩增反应在PCR热循环仪(美国Bio-Rad公司)上完成。rs3825214位点设计引物如下:第一对上游引物:5'-TGGGTAGCTAAGAACTAAGATTGAG-3';下游引物:5'-GTTTCATTTTTCTTCACTTCTCCA-3';第二对上游引物:5'-TCCGTCAACATGAACTGCTCT-3';下游引物:5'-GATAAGTAATGAGTCTGTGTTGAGGT-3'〔生工生物工程(上海)有限公司合成〕;第一轮循环扩增参数为:95℃预变性5 min;95℃ 30 s,60℃ 30 s,72℃ 45 s,共 40 个循环;72℃延伸 6 min,4℃ 保存。第二轮循环扩增参数为:95℃预变性5 min;95℃ 25 s,59℃25 s,72℃ 35 s,共 35 个循环;72℃ 延伸 6 min,4℃ 保存。PCR产物片段长度为160 bp。扩增产物用限制性内切酶 AluI ER0011〔生工生物工程(上海)有限公司合成〕消化。酶切反应总体积为20 μl,包括 PCR 产物10 μl,10×Buffer 2 μl,限制性内切酶1μl,加去离子水至20μl,酶切反应条件为37℃水浴过夜。2%琼脂糖凝胶电泳鉴定酶切产物,电泳缓冲液为1倍TAE,100 V电压下电泳30 min。同时选择部分病例的PCR产物,琼脂糖凝胶电泳后回收目的DNA片段送生工生物工程(上海)有限公司测序。
1.5 统计学处理 计量资料用x±s表示,均行正态分布检验,组间比较采用独立样本t检验。计数资料用百分数表示,组间比较采用χ2检验。单个基因型及组间等位基因频率的比较采用χ2检验。Hardy-Weinberg吻合度检验判断样本基因频率的可靠性。对临床资料和基因多态性进行相关分析,采用Logistic多元回归分析临床资料和基因多态性与房颤的相关性,所有统计学处理由SPSS17.0统计软件完成。
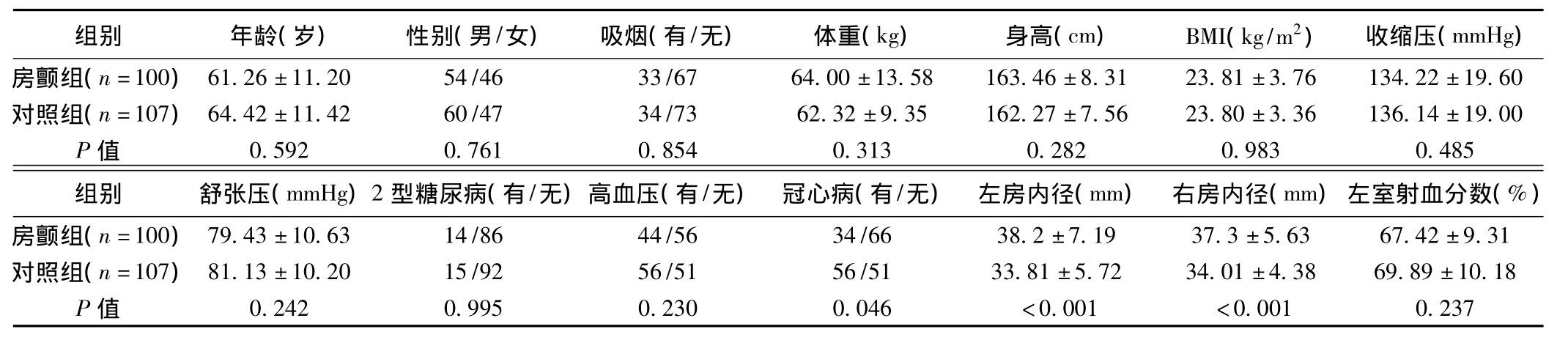
表1 两组患者的临床及辅助检查基线资料(n,x±s)
2 结果
2.1 基因型分型 rs3825214位点PCR扩增产物片段长度为160 bp,经限制性内切酶AluI消化,2%琼脂糖凝胶电泳后出现三种不同的结果,分别为GG纯合型(1条谱带,160 bp),AG杂合型(3条谱带,160、111 bp和49 bp)和AA纯合型(2条谱带,111 bp和49 bp)。见图1。rs3825214位点单核苷酸多态性测序结果见图2。
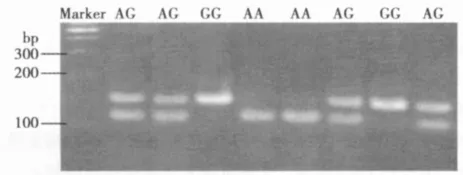
图1 rs3825214位点单核苷酸多态性PCR产物酶切电泳结果
2.2 基因型分布与房颤的关系 房颤组和对照组TBX5基因rs3825214位点均存在多态性改变(GG,AG和AA),等位基因频率符合Hardy-Weinberg平衡性检验。房颤组和对照组间比较,GG,AG和AA的基因型分布存在显著差异(P=0.001)。两组间G和A等位基因频率差异显著(P=0.001)。见表2。
2.3 基因分型与房颤合并高血压的关系 在房颤组中合并有高血压的患者(44例)与不合并高血压的患者(56例)的GG、AG、AA基因型分别为12例,28例,4例和16例,32例,8例;对照组中合并有高血压的患者(56例)与不合并高血压的患者(51例)的 GG、AG、AA基因型分别为11例,22例,23例和6例,32例,13例,各亚组G/A等位基因频率符合Hardy-Weinberg平衡性检验。对三种基因型在房颤组与对照组中的分布比较发现:①在207例研究对象中,高血压患者与非高血压患者的GG、AG、AA基因型分布和G/A等位基因频率无明显差异(P=0.323);②在100例房颤患者中,GG、AG、AA基因型分布和G/A等位基因频率在合并有高血压与不合并高血压的患者中无明显差异(P=0.690);③房颤组中的高血压患者与对照组中的高血压患者的GG、AG、AA基因型分布和G/A等位基因频率均存在显著差异(P=0.002,P=0.005);④不合并高血压的房颤患者与对照患者相比,房颤患者的GG基因型明显多于对照患者(P=0.032)。
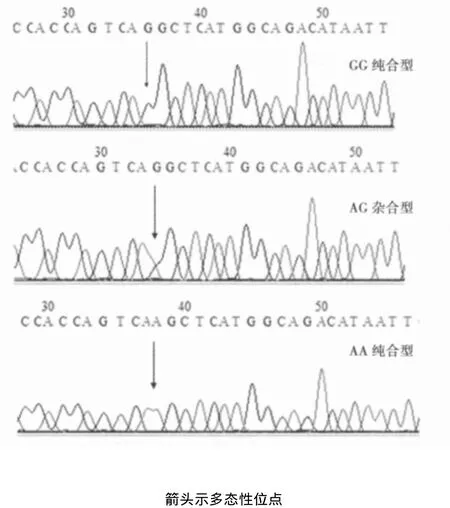
图2 rs3825214位点单核苷酸多态性测序结果
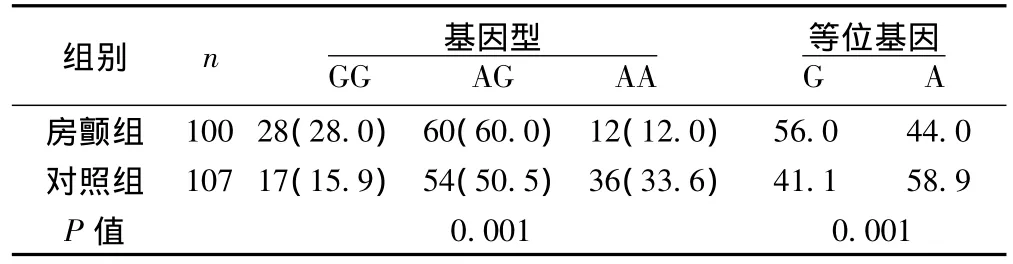
表2 房颤组和对照组间rs3825214位点基因型分布和等位基因频率比较〔n(%)〕
2.4 临床特征及rs3825214G/A多态性与房颤的关系 年龄、性别、吸烟史、体重、身高、BMI、收缩压、舒张压、糖尿病、高血压、射血分数与房颤发生无相关性,而冠心病的发生率与房颤的发生呈负相关(P=0.046),左房内径和右房内径与房颤的发生呈正相关(均P<0.001),rs3825214G/A多态性与房颤发生明显相关(P=0.001)。见表3。
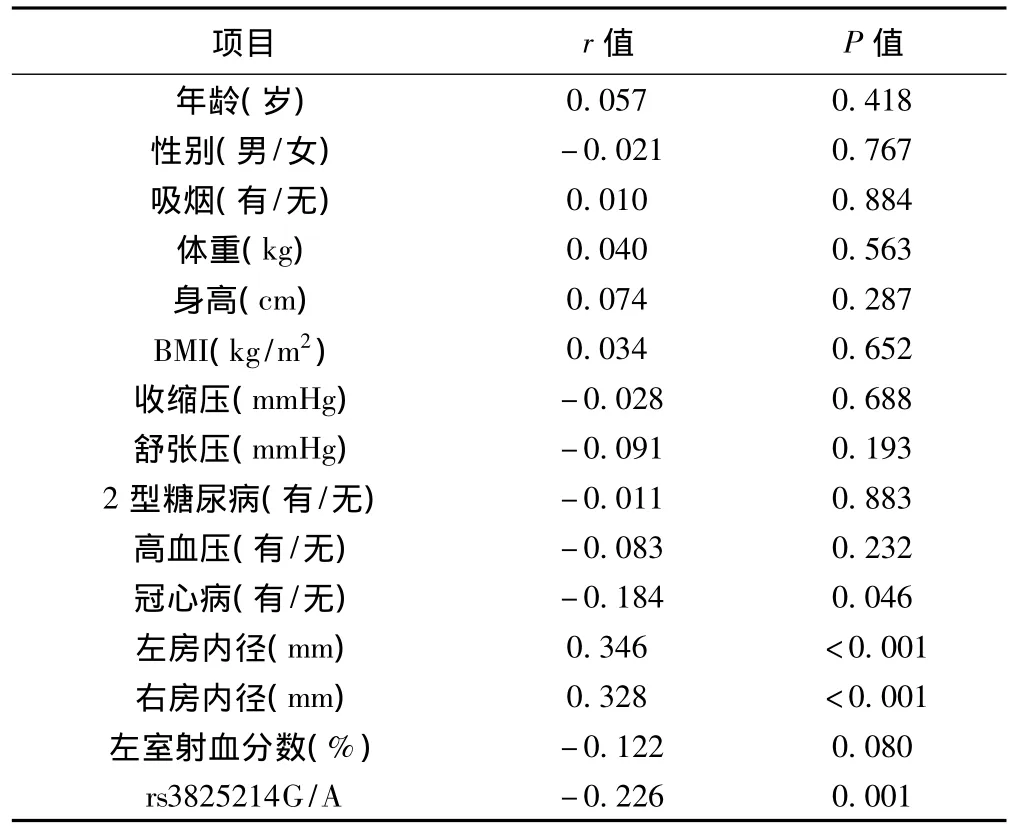
表3 临床资料与房颤的相关分析
2.5 Logistic多元回归分析 冠心病与左、右心房内径及rs3825214G/A多态性对房颤的发生有影响。见表4。
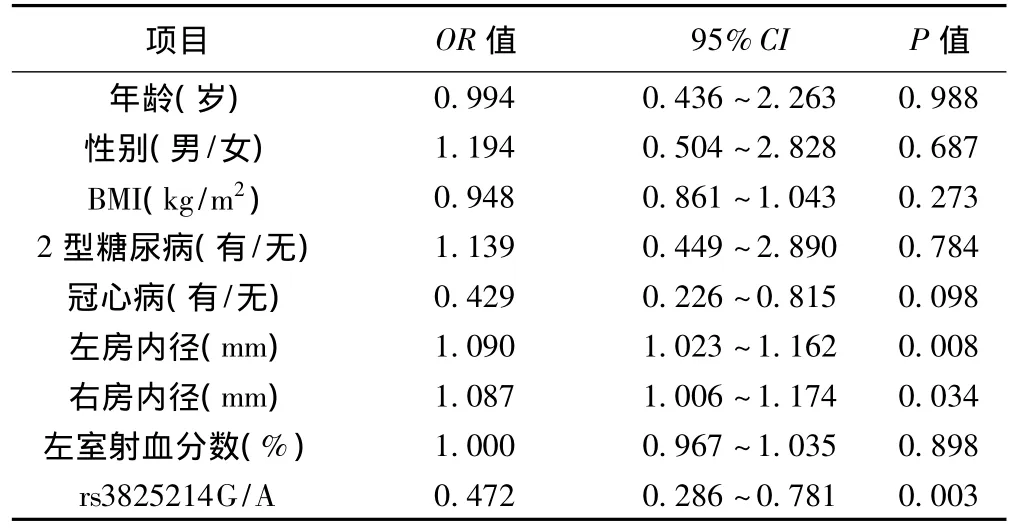
表4 临床资料对房颤的Logistic多元回归分析
3 讨论
TBX5是T-box转录因子基因家族的重要成员,主要通过其特有的T-box结构域与下游靶基因结合,调控着胚胎早期阶段的生长发育,主要控制着心脏和上肢的发育形成。TBX5基因参与了整个心脏发育过程的调控,TBX5基因在胚胎心脏发育中的精确表达对心房的正常发育起着十分重要的作用。
TBX5基因突变会导致TBX5转录因子异常表达,TBX5转录因子过表达或表达缺陷都会使心脏发育畸形,房室腔的结构或功能异常〔8〕。Postma等〔9〕报道了 TBX5基因 c.373G >A 错义突变可导致p.Gly125Arg氨基酸的改变,显著增强了TBX5的下游效应子Nppa、Cx40、Kcnj2和Tbx3的表达,这些效应基因的表达与功能异常可能与心肌传导性、复极特性等电生理异常相关,即可能增加心房颤动的易患性。Holm等〔10〕研究发现,TBX5基因rs3825214位点变异与PR间期和QRS时限异常显著相关,同时发现该位点多态性与房颤发生也存在关联。
TBX5基因rs3825214位点的变异是否影响下游效应子的表达水平,在中国汉族人群中与房颤发生是否相关是一个值得探讨的问题。
本研究结果显示:TBX5基因rs3825214位点G/A多态性与房颤的发生明显相关,其发生机制可能为:①位于内含子中的rs3825214位点多态性可使TBX5转录因子过高表达或表达降低,TBX5转录因子表达异常将影响多种下游效应子的表达,如Nppa、Cx40、Kcnj2和Tbx3等,这些转录因子对心脏发育及心脏传导系统的形成起着十分重要的作用,这些转录因子的异常表达会大大增加房颤发生的风险;②基因多态性的表型受种族、地域及不同研究人群等多因素的影响,在我们所选择的研究人群中,TBX5基因rs3825214位点多态性对房颤发生的影响可能比其他种族或地域的人群更大。
1 梁 磊,陈义汉.心房颤动的分子遗传学研究进展〔J〕.同济大学学报,2006;27(1):9-13.
2 丰明俊,周宏林,陈晓敏.心房颤动相关离子通道基因变异研究进展〔J〕.中国心脏起搏与心电生理杂志,2008;22(6):562-4.
3 Lai LP,Su MJ,Yeh HM,et al.Association of the human MinK gene 38G allele with atrial fibrillation:evidence of possible genetic control on the pathogenesis of atrial fibrillation〔J〕.Am Heart J,2002;144(3):485-90.
4 Lasse S,Ravn MD,Hofman-Bang J,et al.Relation of 97T polymorphism in KCNE5 to risk of atrial fibrillation〔J〕.Am J Cardiol,2005;96(3):405-7.
5 Juang JM,Chern YR,Tsai CT,et al.The association of human connexin 40 genetic polymorphisms with atrial fibrillation〔J〕.Int J Cardiol,2007;116(1):107-12.
6 Schreieck J,Dostal S,von Beckerath N,et al.C825T polymorphism of the G-protein beta3 subunit gene and atrial fibrillation:association of the TT genotype with a reduced risk for atrial fibrillation〔J〕.Am Heart J,2004;148(3):545-50.
7 Hatcher CJ,Kim MS,Basson CT.Atrial form and function:lessons from human molecular genetics〔J〕.Trends Cardiovasc Med,2000;10(1):93-101.
8 Bruneau BG,Nemer G,Schmitt JP,et al.A murine model of Holt-Oram syndrome defines roles of the T-box transcription factor Tbx5 in cardiogenesis and disease〔J〕.Cell,2001;106(6):709-21.
9 Postma AV,van de Meerakker JBA,Mathijssen IB,et al.A gain-of-function TBX5 mutation is associated with atypical holt-oram syndrome and paroxysmal atrial fibrillation〔J〕.Circ Res,2008;102:1433-42.
10 Holm H,Gudbjartsson DF,Arnar DO,et al.Several common variants modulate heart rate,PR interval and QRS duration〔J〕.Nat Genet,2010;42:117-22.
