苦马豆素对家兔肝脏抗氧化功能的影响
2012-06-21王帅张玲陈根元马春晖
王帅 张玲 陈根元 马春晖
苦马豆素(Swainsonine,简写为SW)是豆科棘豆属(Oxytropis)和黄芪属(Astragalus)等疯草植物的主要有毒成分[1]。疯草在我国分布极为广泛,严重影响着我国畜牧业的发展[2]。目前国内外研究认为SW引起家畜中毒的机理主要为SW是α-甘露糖苷酶的特异性抑制剂,可导致合成的低聚糖在溶酶体内蓄积,从而影响糖蛋白的合成,其特征性病理变化为组织细胞的胞浆空泡变性[3]。根据杨鸣琦等[4]的研究,尽管SW能引起肝、肾实质细胞空泡变性,但低聚糖仅蓄积于肾脏,说明SW可通过其它途径导致肝脏细胞发生空泡变性。李培峰等[5]认为生物碱中毒导致的细胞空泡变性与自由基引起的空泡变性有一定的相似性,并初步研究了臭豆碱和黄花碱对小鼠氧自由基(·O2)代谢的影响,发现这两种生物碱会降低小鼠机体的超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活性。肝脏是机体重要的抗氧化系统,目前国内尚无SW对动物肝脏抗氧化功能影响的报道,本实验通过测定SW对家兔肝脏抗氧化物酶和过氧化物的影响,分析SW对家兔肝脏自由基代谢的影响,进一步探讨动物小花棘豆中毒的机理,为合理制定家畜小花棘豆中毒防治方法提供理论依据。
1 材料和方法
1.1 试验材料、试剂与仪器
小花棘豆2011年8月采集于新疆阿拉尔市托喀依乡,由塔里木大学动物科学学院草业科学学科组鉴定。取植株的地上部分,阴干、保存备用。
超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH -Px)、过氧化氢酶(CAT)、丙二醛(MDA)、游离脂肪酸(NEFA)、一氧化氮(NO)、一氧化氮合酶(NOS)、羟自由基(·OH)检测试剂盒,均购自南京建成生物技术有限公司;其余试剂均为国产分析纯;实验室用水为超纯水。
Carry 100型紫外-可见分光光度计,澳大利亚;BS124型精密电子天平,德国赛多力斯;Direct-Q3型超纯水系统,美国Millipore;MR231型高速冷冻离心机,法国Jouan。
1.2 试验动物
家兔24只,雌雄各半,体重(2.0±0.1 kg),购自塔里木大学动物科学学院实验站。随机分为对照组,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组,每组6只。分笼饲养,自由采食和饮水。对照组饲喂全价饲料,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组分别饲喂含有小花棘豆15%、30%和45%的混合日粮。
1.3 动物饲料
将小花棘豆全草粉碎,过200目筛,按15%、30%、45%的比例与全价饲料充分混合。根据气相色谱法测定结果[6],相当于SW添加量为30 mg/kg、60 mg/kg和 90 mg/kg。全价饲料组成为:面粉25%,玉米粉24%,豆饼20%,麸皮10%,鱼粉5%,植物油1%,酵母粉1%,食盐1%,鱼肝油1%,骨粉1%,矿物质添加剂 0.9%。维生素添加剂0.1%[7]。利用颗粒饲料机将其制成颗粒料,干燥后备用。
1.4 临床症状观察
每天观察并记录各试验组家兔的饮食状况、精神状态、行为活动及临床症状等变化,记录家兔的采食量,每周定期测量各试验家兔的体质量,直到出现典型中毒症状为止。
1.5 肝脏组织抗氧化指标的测定
在攻毒后14、35和70 d每组随机取2只家兔,剖杀后取肝脏于冰生理盐水中。制成10%组织匀浆,3 000 r/min离心10 min后取上清液用于SOD、GSH-Px、CAT和 NOS活性的测定,MDA、NEFA、NO和·OH含量的测定。
1.6 数据分析
实验数据用Excel进行处理,数据分析用SPSS 11.5中One-Way ANOVA进行单因素方差分析。
2 结果与分析
2.1 家兔临床症状、采食量及体质量的变化
对照组家兔整个试验期未见异常。攻毒后第1周开始各试验组家兔被毛开始失去光泽;第3周出现被毛竖立,其中试验Ⅲ组最为明显;第10周时试验Ⅲ组出现典型中毒症状,表现为躁动不安,头部和四肢出现神经性震颤,对外界反应迟钝,运动协调性下降,其临床症状与沈明华等[8]的报道一致。
在试验期间,对照组家兔平均采食量基本无变化。各试验组攻毒后1周内采食量略有升高,但试验Ⅲ组从第2周开始采食量下降,试验Ⅰ组和试验Ⅱ组采食量从第3周开始下降。这可能与动物采食小花棘豆初期会产生成瘾性有关。整个试验期内试验组家兔体重呈现先增长,后下降的趋势,其中试验Ⅲ组下降幅度最大。
2.2 家兔肝脏SOD、GSH-Px和CAT活性的变化

图1 家兔试验期内采食量(A)和体质量(B)的变化
在整个试验期内对照组家兔肝脏SOD、GSHPx和CAT活性均无明显变化,试验组家兔SOD、GSH-Px和CAT活性均显著下降。攻毒第14 d时试验Ⅲ组家兔肝脏SOD活性极显著低于对照组(P<0.01),试验Ⅰ组和试验Ⅱ组家兔SOD活性显著低于对照组(P<0.05);攻毒第35 d时所有试验组家兔SOD活性极显著低于对照(P<0.01)。攻毒第14 d时,所有试验组家兔肝脏GSH-Px活性均显著低于对照组(P<0.05),攻毒第35 d时所有试验组家兔GSH-Px活性极显著低于对照(P<0.01)。与正常对照组相比,在攻毒第14 d时,所有试验组家兔CAT活性均已极显著低于对照组(P<0.01)。说明SW可显著影响家兔肝脏抗氧化物酶的活性,而且随着攻毒剂量的增加,家兔酶活性的下降就越明显,即SW可通过影响肝脏抗氧化物酶的活性而干扰家兔体内自由基的代谢。

图2 家兔试验期内SOD(A)、GSH-Px(B)和CAT(C)活性的变化
2.3 家兔肝脏MDA含量的变化
由图3可知,在整个试验期内对照组家兔肝脏中MDA含量无明显变化。在攻毒第14 d时,所有试验组家兔MDA含量均已极显著高于对照组(P<0.01),随着攻毒剂量的增加,小鼠体内MDA的蓄积也就越多。说明SW可显著影响家兔肝脏MDA的代谢。

图3 家兔试验期内MDA含量的变化
2.4 家兔肝脏·OH含量的变化
由图4可知,在整个试验期内对照组家兔·OH含量无明显变化,而试验组家兔·OH含量均异常升高。在攻毒第14 d时,试验Ⅲ组和试验Ⅱ组家兔肝脏·OH含量均极显著高于对照组(P<0.01),试验Ⅰ组家兔·OH含量显著高于对照组(P<0.05);攻毒第35 d时所有试验家兔·OH含量均极显著高于对照组(P<0.01)。说明SW会导致动物机体·OH蓄积,引起机体损伤。
2.5 家兔肝脏NEFA含量的变化
由图5可知,整个试验期内试验组家兔肝脏NEFA含量均有不同程度的增加,并与日粮中SW含量呈现出明显的时间-剂量效应关系。攻毒第14 d时,试验Ⅲ组家兔NEFA含量极显著高于对照组(P<0.01),试验Ⅱ组家兔NEFA含量显著高于对照组(P<0.05),试验Ⅰ组家兔NEFA含量与对照组差异不显著(P﹥0.05);攻毒第35 d时,试验Ⅰ组家兔NEFA含量与对照组差异显著(P<0.05),试验Ⅱ组和试验Ⅲ组家兔NEFA含量与对照组差异极显著(P<0.01);攻毒第70 d时所有试验组家兔肝脏NEFA含量极显著高于对照组(P<0.01)。

图4 家兔试验期内·OH含量的变化
2.6 家兔肝脏NO和NOS的变化

图5 家兔试验期内NEFA含量的变化
由图6可知,与对照组相比,试验组NO和NOS含量均有不同程度的升高。攻毒第14 d时,试验Ⅲ组家兔NO和NOS含量均极显著高于对照组(P<0.01);试验Ⅱ组家兔NO含量极显著高于对照组(P<0.01),NOS含量显著高于对照组(P<0.05);试验Ⅰ组家兔NO和NOS含量均显著高于对照组(P<0.05)。攻毒第35 d时,试验组家兔NOS和NO含量与对照组差异均极显著(P<0.01),试验组NO和NOS含量的变化趋势均一致。
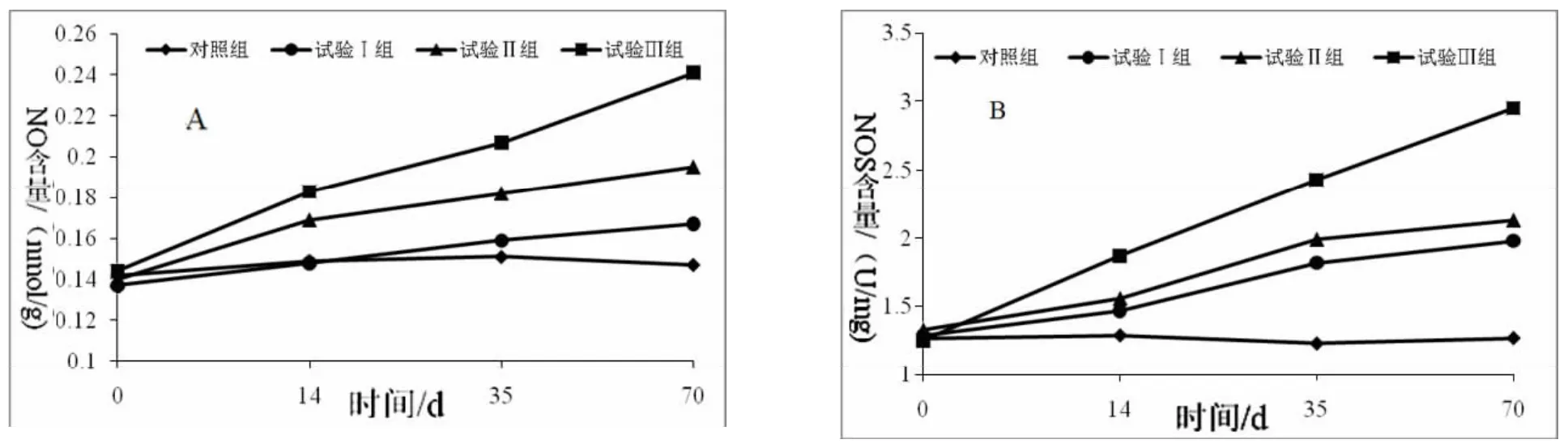
图6 家兔试验期内NO(A)和NOS(B)含量的变化
3 讨论
SOD、GSH-Px和CAT均为生物体内重要的抗氧化物酶,SOD在生物体内将超氧自由基转化为过氧化氢,GSH-Px和CAT可立即将过氧化氢分解为无害的水,这样3种酶即组成了一个完整的抗氧化体系,起到了保护细胞膜结构和功能完整的作用[9]。本试验研究结果表明,SW可显著降低家兔肝脏中SOD、GSH-Px和CAT的生物合成或活化,严重影响了机体的抗氧化能力,从而影响了血清和组织中自由基及其中间产物过氧化氢的分解,造成了细胞膜多不饱和脂肪酸的过氧化,加剧了细胞的胁迫损伤。
机体产生的自由基约有95%为·O2,·O2可与组织生物膜的不饱和脂肪酸发生脂质过氧化连锁反应,产生大量MDA,即MDA含量的变化可反应·O2的代谢情况[10]。本试验中家兔攻毒后肝脏中的MDA含量极显著升高,可能是因为SW降低了机体中抗氧化物酶的活性,从而影响了机体MDA的清除,导致了MDA大量蓄积于机体组织细胞中,造成了机体组织的毒理性变化。说明SW可显著影响动物机体·O2的代谢。
·OH是氧化性最强的自由基,可杀死红细胞,降解DNA、细胞膜和多糖化合物,对机体危害极大。机体中的·OH主要是由过氧化物负离子和过氧化氢反应生成的[11]。在本试验中家兔攻毒后机体·OH含量急剧上升,而且其增加量与SW的摄入量呈正相关。其原因可能为SW显著降低了机体抗氧化物酶的活性,既影响了机体对·OH的清除,又影响了自由基代谢产物过氧化氢的分解,从而导致了·OH的增多,最终导致机体细胞和器官的损伤,说明SW可显著影响动物机体·OH的代谢。
NEFA是细胞膜脂质结构和前列腺素合成的供体,也是重要的能源物质。同时,它也是具有高度细胞毒性的两性分子[12]。试验结果表明,攻毒试验各组肝脏NEFA含量与对照组比较均有不同程度的升高。NEFA不仅对肝脏细胞有直接的毒性作用,其中的不饱和脂肪酸还可通过加强脂质过氧化反应损伤肝脏细胞,致使肝脏功能受损。
NO在动物体内是由NOS合成的,既是一种重要的营养代谢信号分子,同时也是一种自由基,高浓度的NO会氧化细胞生物膜,从而导致细胞膜的损伤以及重要的生化反应受到抑制,甚至引起细胞死亡。NOS是间接研究NO病理生理的作用的重要环节,NOS表达的增加会持续产生大量的NO,发挥细胞毒性作用及过氧化反应,对肝脏造成严重损伤,导致肝脏出血和实质性变化[13]。试验中SW可引起家兔肝脏NO和NOS的持续升高,说明SW可通过影响NO自由基的代谢从而导致家兔肝脏功能受损。
目前研究表明,外源物质一般通过两条途径影响动物机体的自由基代谢,一是直接影响体内的自由基含量,二是通过影响体内的抗氧化系统,从而影响自由基的代谢[14]。机体中自由基的清除主要依赖于酶促自由基清除系统,如SOD、CAT、GSH-Px等。但在病理或机体中毒的情况下,自由基的产生超过了清除能力,过剩的自由基及其代谢的中间产物是许多疾病发生的根源[13]。从本次的试验可以看出,SW作为一种毒物进入家兔机体后,对家兔抗氧化酶系及脂质氧化代谢终产物含量产生了显著影响。本研究证明,经口服攻毒后,SW使家兔肝脏抗氧化酶的活性极显著降低(P<0.01),过氧化产物MDA含量极显著升高(P<0.01);机体·O2、·OH和NO等自由基的代谢均受到显著影响,可能会导致家兔肝脏功能严重受损。这与临床上观察到的小花棘豆中毒动物的症状一致[3]。这一结果进一步证实了肝脏组织易受到自由基的损伤,其病理变化的严重程度与自由基增多有关。
4 结论
通过小花棘豆对家兔的攻毒试验,发现小花棘豆主要毒性成分SW可显著降低家兔机体SOD、GSH-Px和CAT等抗氧化酶的活性,并导致机体MDA、NO等过氧化产物的浓度增加。说明SW可显著影响肝脏自由基的代谢,从而导致肝脏损伤。
[1] 刘志滨.疯草中苦马豆素提取方法研究[D].陕西杨凌,西北农林科技大学,2006.
[2] 卢萍,赵萌莉,韩国栋.小花棘豆毒性的危害与利用[J].草业科学,2009,26(3):97-101.
[3] James L F.Swainsonine induced high mountain disease in calves[J].Vet Hum Toxicol,1991,33(3):217 -219.
[4] 杨鸣琦,曹光荣.苦马豆素的毒性、代谢与用途[J].动物医学进展,1997,18(4):20 -23.
[5] 李培峰,赵树臣,杨保收,等.小花棘豆主要毒性成分对小鼠体内氧自由基的影响[J].中国兽医杂志,2005,41(11):21 -22.
[6] 王帅,陈根元,胡建军,等.气相色谱内标法测定南疆地区小花棘豆中苦马豆素的含量[J].新疆农业科学,2011,48(4):723-728.
[7] 孙以方,白德成,张文慧.医学实验动物学教程[M].郑州:河南医科大学出版社,1998.
[8] 沈明华,莫重辉,赵宝玉.甘肃棘豆对试验家兔血液学指标的影响[J].中国兽医学报,2011,31(7):1038-1041.
[9] Li H Y,Hao Z B,Wang X L,et a1.Antioxidant activities of extracts and fractions from Lysimachia foenumgraecum Hance[J].Bioresour Technol,2009,100(2):970-974.
[10] 崔伟,彭西,赵丽,等.高铜对雏鸭肾脏抗氧化功能的影响[J].畜牧兽医学报,2009,40(4):572-576.
[11] Ozsoy N,Can A,Yanardag R,et al.Antioxidant activity of Smilaa-excelsa L.leaf extracts[J].FOOD CHEM,2008,110(3):571 -583.
[12] Kocaman A Y,Topaktas M.Genotoxic effects of a particual mixture of acetamiprid and alpha-cyper-methrin on chromosome aberration sister chromatid exchange,and micronucleus formation in human peripheral biood lymphocytes[J].Environ Toxicol,2009,25(2):157 -168.
[13] 李聪智,范学工,荆照政,等.各型病毒性肝炎患者血清一氧化氮水平的测定及临床意义[J].中国现代医学杂志,2001,11(2):35-36.
[14] Zhang QF,Zhang ZR,Cheng H Y.Antioxidant activity of Rhizoma Smilacis Glabrae extracts and its key constituent-astilbin[J].Food Chem,2009,115(1):297-303.
