新疆南疆地区奶牛乳房链球菌gapC基因原核表达载体的构建
2012-06-21焦海宏
张 辉 焦海宏 陈 伟,*
乳房链球菌(Streptococcus uberis)作为引起奶牛乳房炎(mastitis)的主要致病菌之一,致病性与多种毒力因子相关。其中乳房链球菌gapC基因编码的具有3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)活性的一种表位蛋白,即GapC蛋白,是近年来研究较多的一种毒力蛋白,也被认为是一种与毒力相关的免疫调节蛋白[1]。GapC蛋白能与血纤维蛋白溶酶结合,在疾病发展过程和信号转导过程中起着重要作用,可作为疫苗发展的良好靶位点[2,3]。因此,研究GapC蛋白的功能可为乳房链球菌抗原的筛选、疫苗的研制和奶牛乳房炎的防治提供一定的理论指导。
本研究通过PCR方法扩增乳房链球菌临床分离株的gapC基因,应用基因重组技术,构建乳房链球菌gapC基因原核表达载体 pET-32a(+)-gapC,并进行GapC蛋白的诱导表达,获得GapC蛋白最佳诱导表达条件,为后续应用该蛋白进行免疫学研究,确定其免疫原性及免疫保护作用奠定基础。
1 材料和方法
1.1 实验仪器
PCR仪(Bio-Rad),恒温培养箱(Boxun,上海),移液器(Eppendorf)等。恒温水浴锅(金坛市医疗器械厂),金属浴(金银杏生物科技,北京),凝胶成像系统(Bio-Rad),蛋白电泳仪(北京六一仪器厂),高速台式离心机(Eppendorf)。
1.2 实验药品与试剂
限制性内切酶E coRⅠ、X hoⅠ、T4 DNA连接酶、IPTG、氨苄青霉素(AMP)、DNA分子量标准(DL2 000,DL10 000)与表达载体pET-32a(+)均购自TaKaRa宝生物工程(大连)有限公司;Taq DNA聚合酶、dNTPs等PCR试剂购自东盛生物有限公司;质粒小提试剂盒、普通DNA产物纯化试剂盒购自北京天根生物有限公司;蛋白质分子量标准、TEMED、考马斯亮蓝、丙烯酰胺、甲叉双丙烯酰胺、DTT均购自Ameresco公司;其它试剂均为国产分析纯或试剂纯;BHI培养基(Becton Dickinson)。
1.3 实验菌株
乳房链球菌菌株分离自新疆南疆地区某奶牛场患乳房炎病牛的乳样,E.coli DH5a、BL21(DE3)为本实验室保存。
1.4 目的基因gapC的PCR扩增
1.4.1 引物的设计与合成
根据Genbank公布的基因序列,查找乳房炎性链球菌的gapC基因,设计引物。上游引物为Pet32a-F:5’- GAGGAATTCATG GTA GTT AAA GTT GGT ATT AAC G -3’,下游引物为Pet32a-R:5’-GGACTCGAGTTA TTT AGC GAT TTT TGC AAA GTA C-3’,预期片段约为1011 bp。上游引物中引入E coR I酶切位点,下游引物中引入X ho I酶切位点(见下划线部分),由上海生工生物工程技术服务有限公司进行合成。
1.4.2 乳房链球菌基因组DNA的提取
挑取活化好的乳房链球菌单菌落接种于BHI液体培养基,37℃培养18 h左右,12 000 rpm离心5 min收集菌体,按文献[4]操作步骤稍作改动,提取乳房链球菌基因组DNA,于-20℃冰箱保存备用。
1.4.3 gapC 基因的 PCR 扩增
以乳房链球菌基因组DNA为模板进行PCR扩增,反应体系如表1所示。反应条件:95℃变性5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 45 s,30 个循环;72℃延伸10 min。取适量PCR产物电泳检测(1%琼脂糖凝胶、120 v、30 min),EB 染色10 min,凝胶成像系统成像。将所有PCR产物合并后用DNA产物纯化试剂盒(TIANGEN BIOTECH)纯化回收,于-20℃冰箱保存备用。

表1 目的基因gapC扩增体系
1.5 重组表达质粒的构建
1.5.1 质粒载体的纯化
将含有质粒载体pET-32a(+)的大肠杆菌DH5a活化、摇菌后,用质粒小提试剂盒(TIANGEN BIOTECH)进行质粒载体的抽提(方法与步骤见质粒小提试剂盒说明书)。电泳检测抽提效果后,于-20℃冰箱保存备用。
1.5.2 载体及目的基因双酶切
将载体pET-32a(+)用限制性内切酶(E coR I、X ho I)进行双酶切,电泳检测后,用DNA产物纯化试剂盒(TIANGEN BIOTECH)回收载体大片段。同时用与酶切载体相同的内切酶进行目的基因gapC的双酶切与纯化。
1.5.3 表达载体的构建
取约20 ng(1μL)酶切回收后的载体pET-32a(+)DNA片段,加适量目的基因gapC片段、1μL10×T4 DNA连接缓冲液、1μL T4 DNA连接酶,加ddH2O至10μL,混匀后置于16℃连接过夜。连接产物转化至E.coli DH5a感受态细胞中,经PCR和限制性内切酶筛选鉴定,送阳性克隆进行测序。测序正确的阳性克隆进行重组质粒的抽提(方法同前),转化E.coli BL21(DE3)。将鉴定正确的阳性质粒命名为pET-32a(+)-gapC。
1.6 重组蛋白的诱导表达
1.6.1 样品的制备
取测序正确的菌株(编号B-21),同时以含质粒pET-32a(+)的菌体为对照,接种于含 Amp的液体LB培养基中,37℃ 振荡培养过夜。取此培养物按1%(v/v)的量接种于准备好的含Amp的液体LB培养基中(100 mL),37℃ 振荡培养至OD600值0.4~0.6(约2~3 h),加 IPTG至终浓度为1 mmol/L,继续在37℃振荡培养,并在培养的不同时刻(0、1、2、3、4、5、6、7、8、9 h)各取 1 mL 菌液转移至离心管,10 000 r/min离心5 min,收集菌体沉淀,加入90μL 1×上样缓冲液和10μL 1 mol/L DTT悬浮混匀,沸水浴5 min,10 000 r/min离心5 min。同时将蛋白质分子量标准在沸水中处理5 min。1.6.2 重组蛋白的 SDS-PAGE检测
制备合适浓度的聚丙烯酰胺凝胶(12%分离胶,5%浓缩胶),每孔加入20μL样品,在浓缩胶中采用8 V/cm的电压进行电泳,在分离胶中采用15 V/cm的电压进行电泳。电泳结束后取出凝胶用考马斯亮蓝R-250染色液染色30 min左右,然后脱色至背景清晰,用清水冲洗、扫描照相。
1.7 重组蛋白最佳诱导条件的确定
1.7.1 最佳诱导时间的确定
样品处理方法同前,选择在培养液中加IPTG至终浓度为0.5 mmol/L和1 mmol/L,并分别在诱导的不同时间点(0、1、2、3、4、5、6、7、8、9 h)各取 1 mL菌液转移至离心管,进行SDS-PAGE检测。
1.7.2 最佳IPTG诱导浓度的确定
确定最佳诱导时间后,进行IPTG最佳诱导浓度的确定。在培养液中加入终浓度依次为 0.0 mmol/L、0.25 mmol/L、0.5 mmol/L、0.75 mmol/L、1.0 mmol/L、1.25 mmol/L 的IPTG,同时设立空质粒对照,培养至最佳诱导时间时取样,方法同前,进行SDS-PAGE检测。
2 结果和分析
2.1 目的基因gapC的扩增与序列分析
以乳房链球菌基因组DNA为模板,PCR扩增特异性片段并回收,PCR产物及回收产物用1%琼脂糖凝胶电泳检测。结果显示,PCR扩增产物在略大于1 000 bp处有一条清晰明亮的DNA条带(图1),与预期片段大小相符。克隆测序后表明为乳房链球菌的gapC基因。

图1 gapC基因的PCR扩增(M为DNA Marker DL2000,1为gapC基因)
2.2 重组表达质粒的构建与鉴定
2.2.1 重组表达质粒的PCR鉴定
将所构建的原核表达质粒 pET-32a(+)-gapC,转化 E.coli BL21(DE3),氨苄抗性筛选,对抗性平板上长出的克隆用基于载体设计的通用引物(T7,S-Tag)进行PCR鉴定,疑似阳性克隆12个。部分重组子PCR鉴定结果如图2所示。
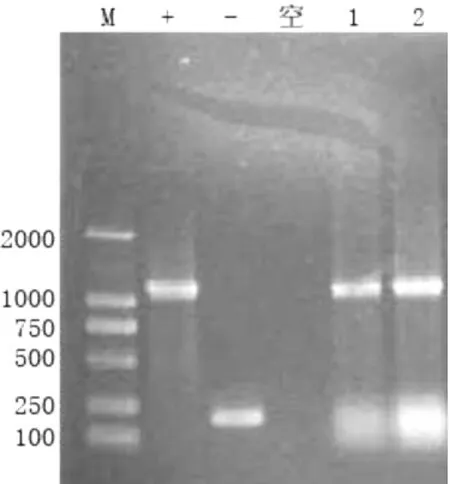
图2 重组质粒的PCR鉴定(+:以质粒pET-32a(+)-gapC为模板作阳性对照,-:以质粒pET-32a(+)为模板作阴性对照,空:以ddH2 O为模板作空白对照;1、2为待检重组子;M为DNA Marker DL2000)
2.2.2 重组表达质粒的酶切鉴定
对PCR鉴定后阳性重组子抽提质粒后电泳检测。结果显示,重组质粒pET-32a(+)-gapC比质粒pET-32a(+)略大(见图3)。酶切结果显示,重组质粒经E coR I单酶切后产生一条约7 kb的DNA条带,与预期大小6 883 bp相符。经E coR I、X ho I双酶切后出现的两条 DNA条带与实际大小(约5.9 kb和1 kb)相符,说明重组质粒构建正确。
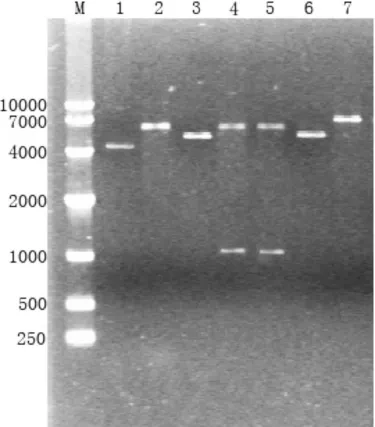
图3 重组质粒酶切鉴定(1为空质粒pET-32a(+),2为pET-32a(+)双酶切;3、6为重组质粒pET-32a(+)-gapC;4、5为pET-32a(+)-gapC双酶切;7为pET-32a(+)-gapC单酶切;M为DNA分子量标准)
2.3 重组GapC蛋白最佳诱导条件的确定
2.3.1 重组蛋白最佳诱导时间
IPTG在不同诱导时间对重组质粒pET-32a(+)-gapC表达量有明显影响。未加入IPTG时,重组蛋白产生量极少。当诱导1 h时,表达量开始上升,一直持续到5 h。6 h时表达量达到最高,随后表达量略有下降。诱导9 h时,仍有足量的重组蛋白表达(图4)。因此,确定最佳诱导时间为6 h。

图4 不同诱导时间重组蛋白的检测(A:0.5 mmol/L IPTG诱导,B:1.0 mmol/L IPTG诱导)(1、9、13为质粒pET32a(+)分别诱导0 h、6 h和9 h;2~8、10~12为重组质粒pET-32a(+)-gapC分别诱导0~9 h;M为蛋白分子量标准)
2.3.2 重组蛋白IPTG最佳诱导浓度
在确定最佳诱导时间的基础上,进一步确定IPTG最佳诱导浓度。结果表明,IPTG在0~1.25 mmol/L浓度范围内,在最佳诱导时间即诱导6 h时,GapC蛋白的表达量随着IPTG浓度的增大而逐渐增加(如图5所示),当IPTG浓度为0.5 mmol/L时,表达量已达到最高。IPTG浓度为0.75 mmol/L和1.0 mmol/L时,GapC蛋白的表达量较 0.5 mmol/L时无明显变化,而当IPTG浓度提高到1.25 mmol/L时表达量有所降低,说明高浓度的IPTG会抑制重组蛋白的表达。因此,确定最佳诱导浓度为0.5 mmol/L。

图5 不同浓度IPTG诱导6 h重组蛋白的检测(1、8为质粒pET32a(+)分别诱导0 h和6 h;2~7为重组质粒pET-32a(+)-gapC分别在0~1.25 mmol/L 6种不同浓度IPTG诱导下的表达情况,M为蛋白分子量标准)
3 讨论
奶牛乳房炎是奶牛最常见的疾病之一,给奶业发展造成了严重的经济损失。治疗该病目前主要以抗生素为主。但由于抗生素的残留和耐药菌的出现,使得治疗难度增加,而利用疫苗来控制该病已成为一种趋势。病原微生物的某些生理代谢酶,是一些功能蛋白作用的良好受体,可作为疫苗的重要靶分子。研究表明具有3-磷酸甘油醛脱氢酶(GAPDH)活性的蛋白是细菌、真菌和寄生虫感染的最佳疫苗靶向[5-7]。而链球菌 gapC基因编码的具有GAPDH活性的表面保守性蛋白,即GapC蛋白,是近年来最受关注的一种毒力蛋白。
不同种类细菌其gapC基因同源性存在很大差异,已经有研究报道引起奶牛乳房炎的三种链球菌(无乳链球菌、停乳链球菌和乳房链球菌)之间gapC基因同源性高达88%[8]。这种基因高同源性的存在为利用该基因表达产物获得免疫保护提供了理论基础。
有研究表明gapC基因编码产物3-磷酸甘油醛脱氢酶(GADPH)可与纤维蛋白溶酶结合,以助于病原菌在宿主体内定殖[9,10]。因此,从削弱链球菌定殖机体能力的角度出发,针对GADPH蛋白研制链球菌性奶牛乳房炎疫苗具有潜在的应用前景。
gapC基因ORF全长1 011 bp,编码一条336个氨基酸的功能多肽。当gapC与表达载体pET32a(+)连接,构建原核表达系统时,目的蛋白以融合蛋白的形式表达。融合蛋白包括Trx-Tag(分子量约11.7kD)、His-Tag(分子量约0.8 kD)、S-Tag(分子量约1.7 kD)、与目的蛋白相连接的部分氨基酸(分子量约3.8 kD)和目的蛋白GapC(分子量约36.0 kD)。所产生的融合蛋白分子量约54.0 kD(介于43 kD~66.2 kD之间)。同时应用生物学软件DNAStar对推导的融合蛋白氨基酸序列进行分析,推测其分子量约为53.8 kD,二者结果一致。本研究中SDS-PAGE检测结果表明,重组蛋白分子量介于43 kD~66.2 kD之间,与预期大小相符,表明重组蛋白成功获得表达。
本研究成功构建了乳房链球菌gapC基因原核表达载体并获得最佳诱导条件。诱导实验表明,当IPTG浓度为0.5 mmol/L,诱导时间为6 h时,重组蛋白的表达量达到最高。持续诱导至9 h时,仍可获得大量重组蛋白。但随着诱导时间的增加,表达量不再升高,却有逐渐下降的趋势,很可能是重组蛋白合成速度太快,以至于没有足够的时间进行折叠而形成了包涵体。本实验确定的GapC蛋白最佳表达条件与褚明亮等[11]的结果有所不同,可能是在实验设计及方法选择上有所不同。在本实验中,0.5 mmol/L和1.0 mmol/L的IPTG对目的蛋白表达量的影响并无明显区别。考虑到过高浓度的IPTG可能会使目的蛋白更容易产生包涵体,对后续目的蛋白的纯化实验造成不良影响,因此,在既满足实验要求,又不浪费实验药品的前提下,我们选择IPTG浓度为0.5 mmol/L作为目的蛋白的最佳诱导浓度。GapC蛋白的成功表达和最佳表达条件的建立,为下一步制备重组蛋白抗体、确定抗体免疫原性及免疫保护作用奠定了基础。
[1] Madureira P,Baptista M,Vieira M,et al.Streptococcus agalactiae GAPDH is a virulence-associated immunomodulatory protein [J].J Immunol,2007,178(3):1379-1387.
[2] Viscogliosi E,Muller M.Phylogenetic relationships of the glycolytic enzyme,glyceraldehydes-3 - phosphate dehydrogenase,from parabasalid flagellates[J].J Mol Evol,1998,47(2):190-199.
[3] Rosey E L,Lincoln R A,Ward P N,et al.PauA:a novel plasminogen activator from Streptococcus uberis[J].FEMSMicrobiol Lett,1999,178(1):27 -33.
[4] 徐淑菲.猪链球菌2型胞外蛋白因子部分基因片段的克隆表达及小鼠的免疫保护性试验[D].江苏南京,南京农业大学,2003.
[5] Fontaine M C,Perez- Casal J,Song X M,et al.Immunization of dairy cattle with recombinant Streptococcus uberis GAPC or a chimeric CAMP antigens confers protection against heterologous challenge [J].Vaccine,2002,20(17-18):2278-2286.
[6] 刘志华,杨谦.球毛壳菌甘油醛-3-磷酸脱氢酶基因克隆及特性分析[J].微生物学报,2005,45(6):885-889.
[7] Yang H W,Yang T S,Lee J H,et al.Characterization of two glyceraldehydes-3-phosphate dehydrogenase genes in Giardia lamblia[J].Parasitol Res,2002,88(7):646-650.
[8] 王丽君,陈伟,张利莉.奶牛乳房炎相关链球菌PCR检测方法的建立[J].畜牧与兽医,2010,42(10):7-10.
[9] Boel G,Jin H,Pancholi V.Inhibition of cell surface export of group A streptococcal anchorless surface dehydrogenase affects bacterial adherence and antiphagocytic properties[J].Infect Immun.2005,73(10):6237-6248.
[10] Winram S B,Lottenberg R.The plasmin-binding protein Plr of group A streptococci is identified as glyceraldehyde-3-phosphate dehydrogenase.Microbiology[J].1996,142(Pt 8):2311- 2320.
[11] 褚明亮.奶牛乳房炎链球菌的分离鉴定及抗原基因的克隆和表达[D].石河子大学,2008.
