转天蚕素AD(CAD)基因于紫花苜蓿的研究
2012-06-19刘秀明朱海林杜淑环李海燕李校堃
刘秀明,朱海林,杜淑环,万 秋,李海燕,李校堃
(1吉林农业大学生物反应器与药物开发教育部工程研究中心,吉林长春130118;2温州医学院,浙江温州325035;3吉林农业大学生命科学学院,吉林长春130118)
抗生素的发现和应用挽救了许多被致病菌感染的人,然而,随着传统抗生素的广泛使用导致临床耐药株日益增多,从而使许多抗生素逐渐失去临床应用的价值.因此,寻找新一代的抗菌药已成为现时一项迫切的任务.抗菌肽(Antibacterial peptide,ABP)是广泛存在于生物体内具有抵抗外界微生物侵害的一类小分子多肽,是生物天然免疫防御系统的重要组成部分.与传统抗生素相比,抗菌肽具有相对分子量小、水溶性好、热稳定、广谱抗菌、不易产生耐药性、对真核细胞毒性作用低、有一定抑制某些恶性肿瘤作用等特点,显示出了良好的临床应用前景[1].天蚕素AD(Cecropin AD,CAD)基因是人工合成的由Cecropin A的N端1~11肽段和Cecropin D的C端12~37肽段组成的杂合肽.据测定,化学合成的抗菌肽AD,其杀菌活性和抗菌谱都明显高于天然抗菌肽(杀菌活性是Cecropin D的5~55倍,对枯草杆菌Bacillus subtilis的活性是 Cecropin A 的6倍)[2-3].植物作为生物反应器生产药用蛋白有如下优点:1)植物细胞具有全能性;2)真核表达系统能正确表达和加工[4];3)生产成本低;4)存储、使用简单方便[5];5)使用安全.紫花苜蓿Medicago sativa是世界上最重要的饲料作物之一,具有抗逆性强,适应范围广,利用年限长,再生性强的特点.另外,紫花苜蓿具有广泛的生态适应性和稳定的生产力,每年可以收获多次,而且由于本身能固氮,需肥量少,和其他植物相比投入少、生物量大,所以适宜作生物反应器.本研究利用根癌农杆菌LBA4404将CAD基因导入紫花苜蓿,成功得到了表达,并且表达的蛋白具有一定的抑菌活性.对利用紫花苜蓿作为植物反应器生产抗菌肽的研究有一定的意义.
1 材料与方法
1.1 菌种及质粒
根瘤农杆菌 Agrobacterium tumefaciens菌种LBA4404(含Ti辅助质粒)、大肠埃希菌 Escherichia coil菌株DH5α、质粒pCAMBIA1390R等由生物反应器与药物开发教育部工程研究中心提供.
1.2 酶及化学试剂
内切酶、DNA相对分子质量标准 DL2000、TaqDNA聚合酶、T4DNA连接酶、PCR回收试剂盒、胶回收试剂盒、质粒抽提试剂盒购自TaKaRa公司;植物DNA抽提试剂盒购自北京百泰克生物技术有限公司、RNA抽提试剂盒购自捷瑞生物有限公司、通用型RT-PCR试剂盒购自北京鼎国昌盛生物技术有限责任公司;地高辛标记试剂盒购自ROCHE(Cat.No.11 745 832 910).
1.3 CAD基因的合成
根据GenBank上登录的Cecropin A和Cecropin D序列设计CAD碱基序列,按照植物偏好密码子将CAD碱基序列重新改造,根据密码子的简并性消除在试验中用到的酶切位点,并且引入对外源基因表达有促进作用的调控元件:Ω序列、Kozak序列及KDEL四肽序列.应用Primer Premier 5.0软件,设计合成正向引物:ADP1、ADP2、ADP3,反向引物:ADP4、ADP5、ADP6(表 1),并在基因两端引入 KpnⅠ和BglⅡ酶切位点及保护碱基.采用基因重叠延伸拼 接 方 法[6](Gene splicing by overlap extension,SOE)合成全长CAD基因(图1).

表1 设计并合成的引物序列Tab.1 Primer sequences of designing
1.4 CAD基因中间克隆载体的构建及测序
合成的CAD基因片段通过8 g/L琼脂糖凝胶电泳在紫外灯下检测目的产物,并用凝胶回收试剂盒纯化回收.将回收产物分别用限制性内切酶KpnⅠ和BglⅡ酶切,用PCR纯化回收试剂盒回收目的片段.将目的基因片段与经相同酶切回收的pUC19大片段连接命名为pUC19CAD.反应产物转化E.coli DH5α感受态细胞,选择阳性克隆菌进行菌落PCR鉴定,将鉴定正确的单菌落摇菌后保存菌种并测序,测序工作由上海生工生物工程服务有限公司完成.
1.5 植物双元表达载体pCAMBIA1390RCAD构建
将测序正确的pUC19CAD和pCAMBIA1390R分别用限制性内切酶KpnⅠ和BglⅡ进行酶切,回收小片段CAD和大片段pCAMBIA1390R,连接并转化大肠埃希菌感受态DH5α,通过菌落PCR筛选阳性克隆菌,摇菌并保种,命名为pCAMBIA1390RCAD(图2).提取质粒进行酶切鉴定,将鉴定正确的植物双元表达载体pCAMBIA1390RCAD用冻融法转入农杆菌LBA4404制备工程菌.用PCR法对转化菌落进行鉴定,经鉴定所得阳性单菌落为含目的基因的工程菌株.
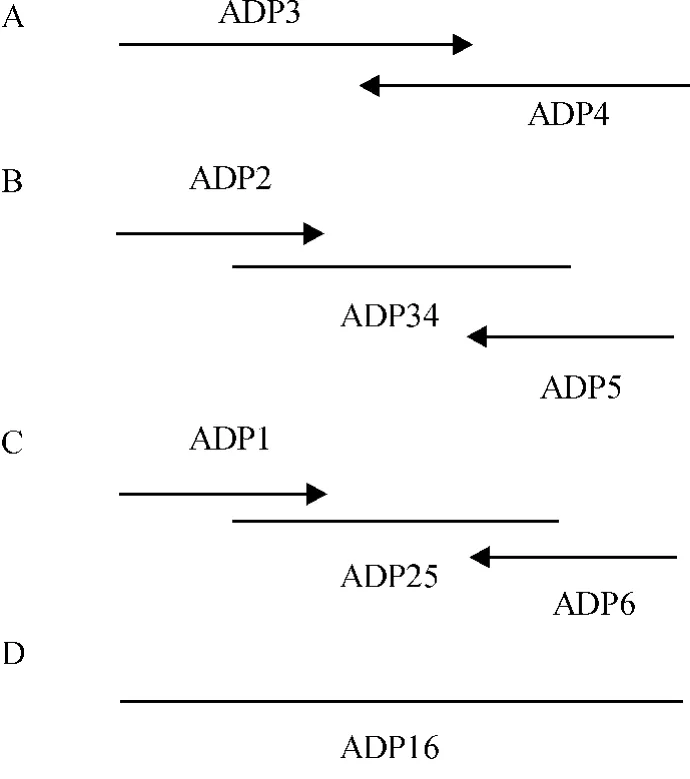
图1 PCR方法合成CAD基因全长策略图Fig.1 Strategy to synthesize CAD gene by overlapping extension method of PCR
1.6 紫花苜蓿的转化
将在种子培养基(MS培养基+琼脂7 g/L+蔗糖30 g/L)上培养5~7 d的紫花苜蓿无菌苗子叶剪成0.3~0.5 cm小段;用含pCAMBIA1390RCAD农杆菌LBA4404(D600nm=0.5~0.6)浸染5~8 min,吸去外植体表面残余菌液,置共培养基(TM-1+2,4-D 2 mg/L+6-BA 1 mg/L+NAA 0.1 mg/L+ 琼脂6 g/L+蔗糖30 g/L)上共培养3 d(25℃黑暗条件);转入选择培养基(TM-1+2,4-D 2 mg/L+6-BA 1 mg/L+NAA 0.1 mg/L+Tim 300 mg/L+Hyg 20 mg/L+琼脂6 g/L+蔗糖30 g/L)进行筛选,每2周继代1次诱导胚性愈伤组织;待组织有绿色的芽点出现,将其转移到分化培养基(MS培养基+Tim 300 mg/L+Hyg 20 mg/L+琼脂7 g/L+蔗糖10 g/L)上继续培养,每2周继代1次,待芽长至3~5 cm高时,将其从外植体上分离开,转移到生根培养基(MS培养基+Hyg 20 mg/L+琼脂7 g/L+蔗糖10 g/L)中继续伸长及生根.培养温度25~26℃,每天光照16 h.3~4周后待根系发达后,打开瓶盖,炼苗2~3 d,移栽到灭菌的土中继续培养.

图2 植物表达载体pCAMBIA1390RCAD结构示意图Fig.2 Structure of plant expression plasmid pCAMBIA1390RCAD
1.7 紫花苜蓿抗性植株的PCR检测
取潮霉素抗性苗和未转基因植株新鲜叶片各100 mg,置于液氮中研磨成细粉,按照植物基因组DNA提取试剂盒操作方法提取总DNA.取1μL总DNA为模板,用CAD基因上游引物ADP1和下游引物ADP6为引物,以非转基因植株为阴性对照,以表达载体pCAMBIA1390RCAD为阳性对照,对基因进行PCR扩增检测.反应体系为:2×Power Taq PCR MasterMix 10 μL,模板 DNA 1 μL,上下游引物各 1 μL(10 μmol/μL),加 ddH2O 至 20 μL.扩增反应条件为:94℃预变性5 min;94℃变性45 s,64℃退火45 s,72℃延伸45 s,30个循环;72℃后延伸3 min.通过8 g·L-1琼脂糖凝胶电泳,紫外灯下分析扩增的DNA片段.
1.8 转基因紫花苜蓿的 Southern blotting分析
取PCR检测为阳性的紫花苜蓿植株叶片4 g,用CTAB法[7]提取苜蓿基因组DNA.每个苜蓿植株样品取40~50 μg基因组DNA,用限制性内切酶KpnⅠ酶切过夜.将酶切好的基因组样品用8 g/L琼脂糖凝胶进行电泳,使片段按照分子大小分开,用碱变性法处理凝胶后,再利用毛细转移法将酶切后的DNA片段转移到硝酸纤维素膜上.根据 DIG High Prime DNA Labeling and Detection Starter KitⅠ试剂盒制备探针(TTTATTTTTACAACAATTACCAACAACAACAAAC;TTACAACTCATCCTTGTTCTTAGCAAGAGCAGTAGCCTG),42℃进行杂交过夜,显色,分析杂交信号.
1.9 CAD转基因植株体外抗菌活性鉴定
将沙门氏菌Salmonella及金黄色葡萄球菌Staphylococcus aureus单克隆培养过夜,摇至D600nm为0.4~0.6后,取100 μL均匀涂布于无抗生素的固体LB平板上,涂布均匀无液体后,在板上放入裁剪好的圆型滤纸,在其上加入20 μL蛋白样品.待加入的液体被吸收之后,将平板正置于37℃培养箱中,过夜.
2 结果与分析
2.1 CAD基因的克隆及测定
利用PCR搭桥法合成CAD全长基因,得到长度为229 bp的基因片段(图3A),与预期一致.将目的基因片段与测序载体 pUC19连接并转化 E.coli DH5α感受态细胞,选择阳性克隆菌进行菌落PCR鉴定(图3B),PCR鉴定为阳性的菌落测序结果与预期一致.
2.2 植物双元表达载体 pCAMBIA1390RCAD的构建
将CAD基因定向插入pCAMBIA1390R载体中,得到重组质粒pCAMBIA1390RCAD,经过限制性内切酶KpnⅠ和BglⅡ酶切得到了229 bp的目的片段和载体大片段(图4).结果与预期一致,表明CAD基因已经整合进了重组质粒中.

图3 CAD全长基因及其克隆菌的PCR鉴定Fig.3 PCR amplification of CAD gene and identification of colony

图4 重组质粒pCAMBIA1390RCAD的酶切鉴定Fig.4 Restriction digestion analysis of recombinant plasmid pCAMBIA1390RCAD
2.3 农杆菌的转化
利用冻融法将重组质粒pCAMBIA1390RCAD转入农杆菌LBA4404,用菌落PCR法对阳性菌落进行PCR鉴定,PCR扩增得到大小为229bp左右的CAD基因(图5),说明挑取的农杆菌可以用于下一步紫花苜蓿的转化.
2.4 紫花苜蓿阳性植株的PCR鉴定
挑选潮霉素抗性植株,提取基因组DNA,非转基因植株作为阴性对照,重组质粒pCAMBIA1390RCAD为阳性对照,以ADP1和ADP6为上、下游引物进行PCR扩增,结果显示有目的条带出现(图6),表明CAD已整合进苜蓿基因组.
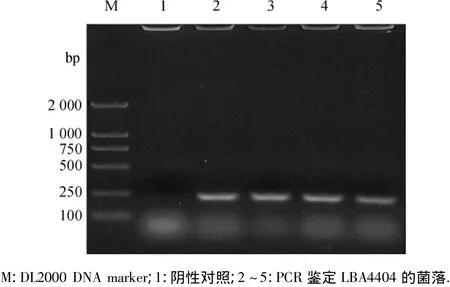
图5 农杆菌阳性克隆Fig.5 Screen of positive transformants of Agrobacterium tumefaciens

图6 转基因苜蓿植株的PCR检测Fig.6 Identification of transgenic plants by PCR amplification
2.5 转基因植株的Southern blotting分析
对PCR检测为阳性的转基因植株进行Southern blotting分析(图7).结果显示有4株出现杂交信号,而非转基因植株没有出现杂交信号.由此可以说明,目的基因CAD已经成功地整合进苜蓿基因组中.
2.6 转基因植株的体外抗菌活性鉴定
对从转基因苜蓿叶片中提取的总蛋白的抑菌活性进行了分析,选取2种不同的指示菌,即沙门氏菌和金黄色葡萄球菌.结果显示,转基因苜蓿对测试菌有抑菌圈出现,而野生型苜蓿没有抑菌圈(图8).

图7 转基因苜蓿植株Southern blotting分析Fig.7 Identification of the transgenic plants by Southern hybridization

图8 琼脂糖扩散法测抑菌活性Fig.8 Results of agarose diffusion assay
3 讨论
近年来,很多研究证实植物表达系统具有表达活性外源蛋白的能力,无论是在产品质量、成本和安全性等各方面都显现出巨大优势[8].但是,作为一种新型的表达系统,如何提高蛋白表达量,减少错误蛋白的修饰以及降低下游分离纯化成本等问题是所有研究者共同面对的问题.
起始位点上游的调节序列,也对转录的效率有很大的影响,如Ω序列等.有研究显示在烟草和水稻中,以CaMV35S为启动子,插入Ω序列和内含子序列,使GUS基因的活性提高20~70倍[9].所以本试验在合成基因时在起始位点上游引入了Ω序列和Kozak序列.
为了提高外源蛋白的表达量,本试验在抗菌肽的C端引入了KDEL序列.研究表明,蛋白质C端的KDEL序列能将蛋白质定位在内质网膜上,通过改变蛋白质的细胞定位和分泌途径,能明显地提高外源蛋白在宿主体内的表达水平[10-11].
本研究利用植物生物反应器表达系统表达CAD基因,经PCR检测、Southern blot检测和抑菌活性检测,结果表明:根癌农杆菌能够成功介导CAD基因,整合到阳性紫花苜蓿转化株的基因组中,抑菌活性结果表明,转基因苜蓿具有一定的抑菌活性.本试验将CAD基因导入紫花苜蓿中,可为今后利用生物反应器表达系统在植物中生产药用蛋白的工程化提供参考.
[1]赵东红,戴祝英,周开亚.昆虫抗菌肽的功能、作用机理与分子生物学研究最新进展[J].生物工程进展,1999,19(5):14-18.
[2]郑青,鲍时翔,姚汝华,等.抗菌肽AD基因的合成[J].生物化学和生物物理进展,1998,25(1):178-180.
[3]郑青,黄自然,姚汝华,等.人工合成cecropin AD基因在酵母中的表达[J].蚕业科学,1999,25(3):75-180.
[4]DANIELL H,STREATFIELD S J,WYCOFF K.Medical molecular farming:production of antibodies biopharmaceuticals and edible vaccines in plants[J].Trends Plant Sci,2001,6(5):219-226.
[5]KORBAN S S,KRASNYANSKI S F,BUETOW D E.Foods as production and delivery vehicles for human vaccines[J].J Am Coll Nutr,2002,21(3):212-217.
[6]张素芳,贾云,蔡梅红,等.Magainin和cecA2mil抗菌肽基因的密码子优化及在毕赤酶母中的高效表达[J].中国生物工程杂志,2004,24(7):93-97.
[7]顾红雅,瞿礼嘉.植物分子生物学实验手册[M].北京:高等教育出版社,1998:464-466.
[8]STREATFIELD S J.Approaches to achieve high-level heterologous protein production in plants[J].Plant Biotech J,2007,5(1):2-15.
[9]MITSUHARA I,UGAKI M,HIROCHIKA H,et al.Efficient promoter cassettes for enhanced expression of foreign gene in dicotyledonous and monocotyledonous plant[J].Plant Cell Physiol,1996,37(1):49-59.
[10]MUNROE W D,PELHAM H A.C-terminal signal prevents secretion of luminal ER proteins [J].Cell,1987,48:899-907.
[11]ANDRES D A,RHODES J D,MEISEL R L,et al.Characterization of the carboxyl-terminal sequences responsible for protein retention in the endoplasmic reticulum [J].J Biol Chem,1991,266(22):14277-14282.
