韭菜根系浸提液对香蕉枯萎病和土壤微生物生态的影响
2012-06-19杨江舟陆尚沛李华兴
杨江舟,张 静,胡 伟,任 爽,陆尚沛,李华兴
(华南农业大学资源环境学院,广东广州510642)
香蕉枯萎病也称巴拿马病、黄叶病、“蕉癌”,是由尖孢镰刀菌古巴专化型Fusarium oxysporum f.sp.cubense(E.F.Smith)Snyder and Hansen(简称 Foc)侵染而引起维管束坏死的一种毁灭性真菌病害和典型的土传病害.近年来由于香蕉枯萎病的危害,使香蕉产业正遭遇有史以来香蕉枯萎病最严重的威胁和挑战[1].香蕉枯萎病菌根据鉴别寄主的不同分为4个生理小种,其中4号生理小种几乎对所有香蕉栽培种均致病,严重威胁香蕉产业的发展[2].目前,有关香蕉枯萎病防治的研究多集中在化学农药、拮抗内生菌、土壤生防菌、选育抗性品种等方面[3-5],取得了一定的成果,但仍未从根本上解决香蕉枯萎病防治难题.
化感作用(Allelopathy)是指植物或微生物通过向周围环境释放自身产生的化学物质,对其他生物的生长产生直接或间接的刺激或抑制作用[6-7].在农业生态系统中充分利用化感作用的正效应,避免负效应,建立合理的种植模式、防治病虫害、抑制杂草生长,开发天然农药和生长调节剂,对于有效利用资源,保护生态环境,发展可持续农业具有重要的理论价值和现实意义[8-9].其中,利用植物与微生物之间的化感效应被认为是植物保护和病害控制的新途径和新技术[10-11].
韭菜Allium tuberosum为多年生宿根性辛香类草本,百合科葱属植物.韭菜植株体内含芳樟醇、甙类、苦味素及硫化物,这些化合物对一些害虫和霉菌具有杀伤作用[12].曾有报道韭菜的水溶液提取物有显著的抗菌性[13],韭菜叶片提取液对大毛霉菌、柑橘青霉菌和香蕉枯萎病菌有较强的抑制作用[14-15],韭菜茎、叶有机溶剂提取液中存在对香蕉枯萎病菌孢子有抑制作用的化学成分[16].但是,关于韭菜根系提取液对香蕉枯萎病和土壤微生物生态影响的研究至今鲜见报道.本研究通过抑菌试验和盆栽试验,探讨韭菜根系浸提液对香蕉枯萎病的抑菌和防病效果及对土壤微生物生态的影响,旨在为利用韭菜对香蕉枯萎病菌的化感抑制作用防治香蕉枯萎病的田间应用提供依据.
1 材料与方法
1.1 供试材料
病原菌为尖孢镰刀菌古巴专化型4号生理小种Fusarium oxysopoyum f.sp.cubence race 4(简称Foc4),华南农业大学资源环境学院植物病理系姜子德教授提供;巴西蕉Musa acuminata AAA Cavendish cv.Brazil营养杯组培苗,广东省农业科学院果树研究所提供;韭菜Allium tuberosum为平韭四号,采自华南农业大学农场.
供试土壤:由赤红壤发育而成的水稻土.其基本理化性质为:有机质22.69 g·kg-1,碱解氮 (N)106.9 mg·kg-1,速效磷(P)48.5 mg·kg-1,速效钾(K)117.8 mg·kg-1.采自华南农业大学农场.
1.2 韭菜根系浸提液对香蕉枯萎病菌的抑菌效应
1.2.1 不同质量浓度韭菜根系浸提液的制备 称取韭菜根系160.0 g,剪成小段,用500 mL无菌水振荡浸提48 h,离心,取上清液并经0.22 μm滤膜过滤,得质量浓度为320 mg·mL-1无菌根系浸提液,将此液用无菌水分别稀释配制成质量浓度为240、160、80、60、40、30、20 和 10 mg·mL-1的浸提液.
1.2.3 平板菌落的制备 将病原菌用液体PDA培养基培养3 d,经细胞计数(血球计数板)调整孢子浓度为104~105cfu·mL-1.吸取100 μL孢子悬液于PDA培养基平板上,涂布,置于28℃黑暗条件下培养,待菌落长满平板后,用于制备菌饼.
1.2.4 菌丝生长抑制率测定 采用生长速率法[17].在无菌条件下,用9 mm打孔器在菌落平板上打制菌饼,并接入各浓度带药平板培养基中央,在28℃条件下培养,每隔24 h用十字交叉法测量菌落生长直径,每个处理5个重复,以5次重复的平均值为测量结果.用下述公式计算抑菌率.抑菌率=[1-(处理皿菌落直径-菌块直径)/(对照皿菌落直径-菌块直径)]×100%.
1.2.5 孢子萌发抑制率的测定 采用凹玻片孢子萌发法[18].将病原菌用液体PDA培养基培养3 d,然后用4层灭菌纱布过滤,制成孢子悬液,用无菌水调整孢子浓度至每个视野(10×40倍显微镜)为30~40个孢子.吸取1 mL孢子悬液分别与1 mL质量浓度分别为40、30、20、10 和0 mg·mL-1的韭菜根系浸提液混合均匀,取适量混合液于洁净、灭菌的凹玻片上,盖上盖玻片,置于铺有湿润滤纸的培养皿中,在28℃条件下培养,每隔8 h进行镜检,记录孢子萌发数,直到对照孢子萌发率接近100%.每个质量浓度重复4次,每个重复观察10个视野,观察时以牙管超过孢子长轴长度一半为萌发,计算萌发率和抑制率.孢子萌发率=(孢子萌发数/总孢子数)×100%;孢子萌发抑制率=[(对照萌发率-处理萌发率)/对照萌发率]×100%.
1.2.6 病原菌菌丝和孢子形态显微镜观察 将1.2.4中40 mg·mL-1韭菜根系浸提液培养基中培养5 d后的菌落和对照菌落,用接种针挑取病原菌菌落边缘的菌丝体制成玻片标本,在10×40倍显微镜下观察韭菜根系浸提液对香蕉枯萎病菌菌丝形态的影响.将1.2.5中韭菜根系浸提液处理的凹玻片和对照凹玻片,在10×40倍显微镜下观察韭菜根系浸提液对香蕉枯萎病菌孢子萌发时形态的影响.
1.3 韭菜根系浸提液对香蕉枯萎病的防治作用和对土壤微生物生态的影响
盆栽试验于网室内进行,设4个处理:Ⅰ.接种Foc4(病原菌),不浇灌韭菜根系浸提液 (CK);Ⅱ.接种Foc4,浇灌40 mg·mL-1韭菜根系浸提液;Ⅲ.接种Foc4,浇灌80 mg·mL-1韭菜根系浸提液;Ⅳ.接种Foc4,浇灌160 mg·mL-1韭菜根系浸提液.每个处理12盆,每盆装3 kg土、种植1株香蕉苗,每4盆为1组,每组为1次重复,共3次重复.除CK外,移栽香蕉前,向各处理盆内分别浇灌20 mL相应质量浓度韭菜根系浸提液,保湿24 h后,移栽香蕉苗,同时采用伤根浇灌法接种病原,每株接入病原菌孢子悬液10 mL(1×106cfu·mL-1).以后每隔5 d向各处理盆内浇灌20 mL相应浓度韭菜根系浸提液,对照以清水代替.
香蕉枯萎病病情分级标准参考文献[19].病情指数=[∑(各级发病数×该级代表值)/(处理植株总数×最高级代表值)]×100;防病效果=[(对照病情指数-处理病情指数)/对照病情指数]×100%.
采用稀释涂平板法测定土壤中细菌、真菌、放线菌、香蕉枯萎病菌数量.细菌采用牛肉膏蛋白胨培养基,放线菌采用高氏一号培养基,真菌采用孟加拉红培养基,香蕉枯萎病菌采用尖孢镰刀菌分离培养基[20].香蕉生长期间每隔20 d采土样1次,采样深度为5~15 cm.
采用Biolog Eco微平板技术研究韭菜根系浸提液对土壤微生物多样性的影响,在移苗40 d后取土样分析,具体方法参照文献[21].
随着互联网在我国大范围的普及,虽然其为酒店创造了新的销售模式和销售渠道,但是如何确定社交媒体的商业价值、如何衡量使用社交媒体的营销价值,以及如何通过社交媒体提高自身的品牌价值,一直是酒店经营者需要面对的重要问题。
1.4 统计方法
用SAS 9.0软件对数据进行处理,采用Duncan's法对数据进行差异显著性分析;图用Excel 2007进行制作.
2 结果与分析
2.1 韭菜根系浸提液对香蕉枯萎病菌的抑菌效应
2.1.1 韭菜根系浸提液对香蕉枯萎病菌菌丝生长的抑制作用 图1的结果表明,不同质量浓度的韭菜根系浸提液对香蕉枯萎病菌菌丝生长均具有显著的抑制作用,且存在明显的浓度效应,即随着浸提液质量浓度的提高对菌丝生长的抑制效果增强,两者之间的相关系数(r)在处理后的第48、72、96和120 h分别为0.969、0.979、0.975和0.975.在作用 24 h时,ρ≥20 mg·mL-1的浸提液对菌丝生长的抑制率达到100%,但浸提液对香蕉枯萎病菌菌丝生长的抑制效果并不因处理时间的延长而增加,反而随着处理时间的延长各浓度浸提液的抑菌效果呈现一定的下降趋势.分析其原因,可能与单个菌丝细胞所接受的浸提液剂量有关,虽然浸提液对菌丝生长起抑制作用,但没有将其完全抑杀,菌丝仍在生长,菌丝量在增加,因此,在培养基中浸提液剂量一定时,对每一菌丝细胞而言,其所受到的浸提液剂量下降.尽管随着时间的延长对菌丝生长的抑制率有一定下降,但当达到最长测定时间 (120 h)时,质量浓度为5、10、20、30和40 mg·mL-1的韭菜根系浸提液对菌丝生长的抑制率仍分别达到 18.23%、31.07%、42.58%、48.96%和53.85%,与CK差异均达到极显著水平.
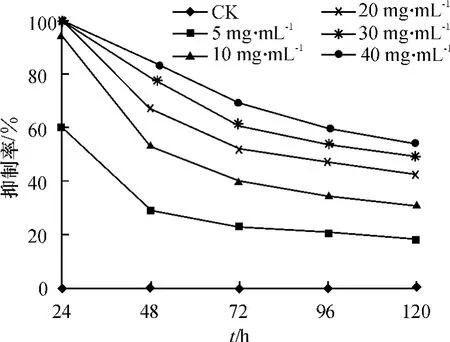
图1 韭菜根系浸提液抑制香蕉枯萎病菌菌丝生长的时间-浓度效应Fig.1 The time-concentration effect of Allium tuberosum root extracts on mycelia growth of Foc4
2.1.2 韭菜根系浸提液对香蕉枯萎病菌孢子萌发的抑制作用 由表1可见,在测试的各阶段,不同质量浓度的韭菜根系浸提液对病菌孢子萌发的抑制率与CK的差异均达到极显著水平,并且随着浸提液质量浓度的提高,对病原菌孢子萌发的抑制效果增强.浸提液质量浓度每提高5 mg·mL-1,对病原菌孢子萌发的抑制率与上一个质量浓度浸提液的抑制率呈极显著差异.质量浓度为10 mg·mL-1的浸提液,在测试的各时间段对孢子萌发抑制率都达到60%以上,当浸提液质量浓度达到20 mg·mL-1时,在测试的各时间段对孢子萌发达到100%的抑制(完全抑杀)效果.
将韭菜根系浸提液对病菌孢子萌发的相对抑制率换算成抑制几率值,浸提液质量浓度换算成浓度对数作毒力曲线,得韭菜根系浸提液抑制几率值与浓度对数的回归方程.通过回归方程计算得出各测试时期韭菜根系浸提液对病菌孢子萌发的抑制中浓度(EC50)和EC95,结果见表1.由表1可见,各测试时期的EC50始终维持在较低水平,说明韭菜根系浸提液对香蕉枯萎病病原菌孢子萌发具有较好的抑制效果.

表1 韭菜根系浸提液对香蕉枯萎病菌孢子萌发的抑制效应Tab.1 The inhibitive effect of Allium tuberosum root extracts on conidium germination of Foc4
2.1.3 病原菌菌丝和孢子的形态变化 经韭菜根系浸提液处理后的香蕉枯萎病菌菌丝和孢子形态与CK有明显的区别(图2).由图2a可见,CK中的香蕉枯萎病病原菌菌丝细胞大小一致,核区明显,菌丝连续伸长无断裂,生长排列均匀,形状一致.由图2b可见,经韭菜根系浸提液处理后的病原菌菌丝弯曲交错,节间长短不均,断丝现象大量存在,菌丝膨大,一部分菌丝细胞核区消融变为泡囊.由图2c可见,CK孢子萌发后芽管修长,孢子呈正常的椭圆形,由图2d可见,香蕉枯萎病菌分生孢子经韭菜根系浸提液处理后,萌发的芽管发生扭曲断裂,且长度显著短于对照,孢子膨大畸变.

图2 韭菜根系浸提液对香蕉枯萎病菌菌丝和孢子形态的影响Fig.2 Effect of Allium tuberosum root extracts on the morphology of mycelia and conidium of Foc4
2.2 韭菜根系浸提液对香蕉枯萎病的防治作用
由图3可知,在整个试验期间,CK病情指数一直保持最高,经韭菜根系浸提液浇灌的处理,各个时期病情指数均显著低于CK,且随着浸提液质量浓度提高,病情指数下降(图3a).说明韭菜根系浸提液对减轻香蕉枯萎病发病程度具有很好的效果.随着香蕉的生长,各处理病情指数都在上升,在盆栽试验的第60天时,CK的病情指数达到85.42;40和80 mg·mL-1韭菜根系浸提液的处理,病情指数依次为75.00和54.17,分别比CK下降了10.42和31.25,防病效果依次为12.20%和36.58%(图3b);当浸提液质量浓度达到160 mg·mL-1时病情指数仅为39.58,比CK以及40和80 mg·mL-1韭菜根系浸提液的处理分别降低45.84、35.42和14.59,防效达到53.66%.上述结果表明,韭菜根系浸提液对香蕉枯萎病的发生具有明显的抑制作用.
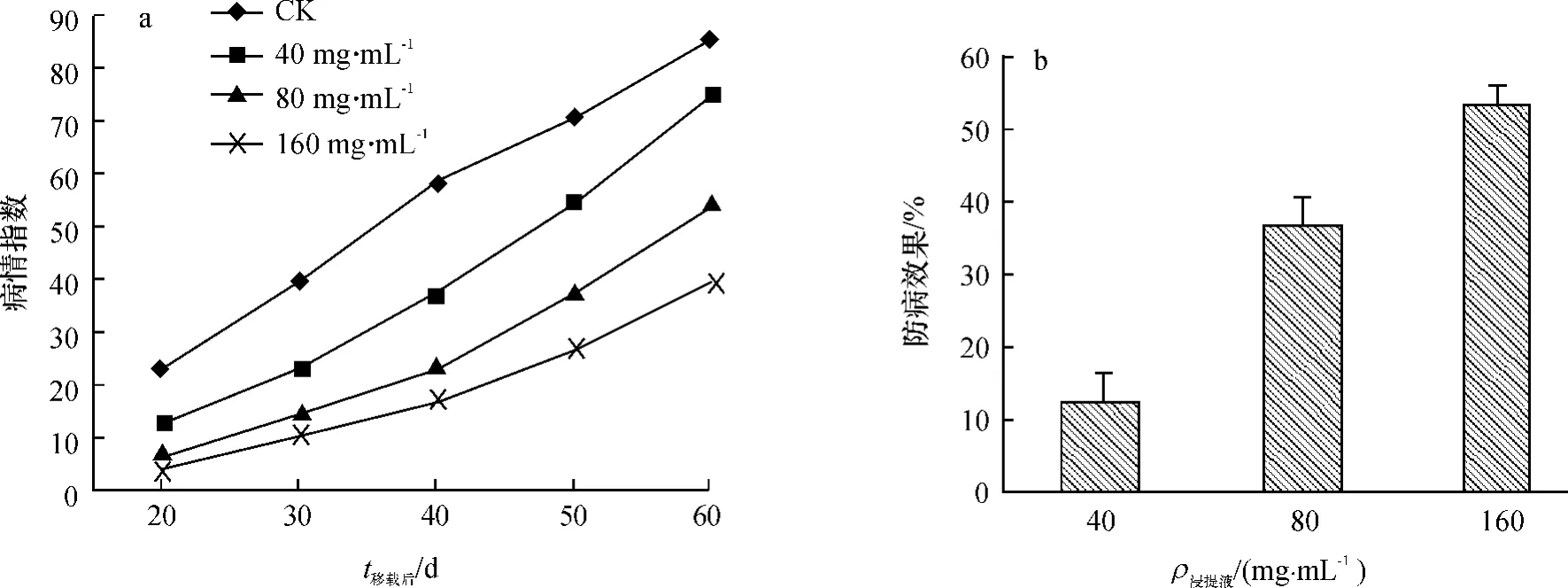
图3 韭菜根系浸提液对香蕉枯萎病病情指数和移栽后60 d时防病效果的影响Fig.3 Effects of Allium tuberosum root extracts on banana fusarium wilt disease index and disease-control efficiency after 60 planting days
2.3 韭菜根系浸提液对土壤微生物生态的影响
2.3.1 韭菜根系浸提液对土壤中香蕉枯萎病菌和主要微生物菌群数量的影响 由图4可见,在整个生长过程中,相对于CK,3个浇灌韭菜根系浸提液的处理都不同程度地降低了土壤中病原菌的数量,与CK的差异均达到显著水平.此外,160 mg·mL-1浸提液处理的香蕉根际土壤病原菌数量持续降低,但40 mg·mL-1浸提液处理的根际土壤病原菌数量在经过一段时间减少后,在第60天出现增长现象,但仍与CK存在显著差异.这说明40mg·mL-1的浸提液浓度对抑制病原菌的生长不能起到长效作用,而160 mg·mL-1浓度的浸提液在试验周期内能持续抑制病原菌的生长.
由图5可见,在盆栽试验的各时期,不同质量浓度浸提液处理的土壤中细菌数量都要高于CK,在试验的中后期,不同浓度浸提液处理与CK之间细菌数量的差异达到显著水平.并且在整体上呈现出随着试验时间的延长和浸提液质量浓度的提高,香蕉根际土壤中细菌数量增加的趋势.说明韭菜根系浸提液能促进细菌的繁殖,增加土壤中细菌数量.

图4 韭菜根系浸提液对土壤中香蕉枯萎病病原菌数量的影响Fig.4 Effects of Allium tuberosum root extracts on the amount of Foc4 in the soil
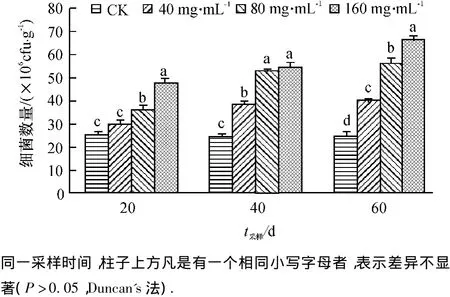
图5 韭菜根系浸提液对土壤细菌数量的影响Fig.5 Effects of Allium tuberosum root extracts on the amount of bacteria in the soil
由图6可知,不同质量浓度浸提液处理的土壤真菌数量在各时期均显著低于CK,40和80 mg·mL-1浸提液处理的土壤真菌数量在试验中后期均保持相对稳定,而当浸提液浓度达到160 mg·mL-1时,可使土壤中真菌数量持续降低.整体来看,韭菜根系浸提液对土壤中真菌的增长起抑制作用,且浸提液浓度越高抑制作用越强烈、时效越长.由此可以推断韭菜根系浸提液不但可以抑制土壤中香蕉枯萎病病原菌的繁殖,还有可能抑制其他真菌性病原菌的繁殖,这就为利用韭菜防治其他作物的土传真菌性病害提供了可能.

图6 韭菜根系浸提液对土壤真菌数量的影响Fig.6 Effects of Allium tuberosum root extracts on the amount of fungi in the soil
由图7可知,在第20和40天,80与160 mg·mL-1浸提液处理之间放线菌数量无显著差异,但是不同质量浓度浸提液处理之间土壤放线菌数量的差异随着时间的延长逐渐增大,且放线菌数量均有所下降.此外,不同浓度浸提液处理的放线菌数量在试验各时期均显著低于CK,在整体上呈现出随试验时间的延长和浸提液质量浓度的提高,香蕉根际土壤中放线菌数量逐渐减少的趋势,这与病原菌、真菌数量变化趋势相似,与细菌数量变化趋势相反.

图7 韭菜根系浸提液对土壤放线菌数量的影响Fig.7 Effects of Allium tuberosum root extracts on the amount of actinomyces in the soil
2.3.2 韭菜根系浸提液对土壤微生物群落功能多样性的影响 土壤微生物多样性是土壤生态肥力的重要指标,土壤微生物多样性的提高有利于作物抵御病害的侵害[22-24].土壤微生物多样性主要包括物种多样性、基因多样性和功能多样性[25].本试验采用Biolog Eco微平板技术研究韭菜根系浸提液对土壤微生物群落功能多样性的影响.
AWCD(Average well color development)值作为微生物整体活性指标,反映微生物对Biolog Eco微平板中碳源总体利用能力和微生物群落功能多样性[26].由图8可知,随着培养时间的延长和浸提液浓度的提高,土壤微生物AWCD值增高,变化趋势与防病效果一致.从第24 h开始不同质量浓度浸提液处理的土壤微生物AWCD值均显著高于对照处理,说明韭菜根系浸提液处理的土壤微生物群落所含的能利用Biolog Eco微平板上碳源底物的微生物数量和种类要多于CK,浸提液处理的土壤微生物对Biolog Eco微平板上碳源底物利用能力要高于CK,进而说明韭菜根系浸提液可以提高土壤微生物整体活性和土壤微生物群落多样性.

图8 韭菜根系浸提液对Biolog Eco微平板上AWCD的影响Fig.8 Effects of Allium tuberosum root extracts on AWCD in Biolog plate
不同浓度浸提液处理的土壤微生物Shannon指数、Simpson指数和McIntosh指数均高于CK,均达到显著差异水平,并表现出随着浸提液质量浓度的提高,各指数加大的趋势,变化趋势与AWCD值一致(表2).说明韭菜根系浸提液有利于提高土壤微生物群落的丰富度、均匀度和多样性.据此分析韭菜根系浸提液处理的防病效果优于CK的主要原因之一在于韭菜根系浸提液处理的土壤微生物群落的丰富度、均匀度和多样性等都处于较好的状态,整个微生物群落趋于和谐、优化、平衡、稳定,这对于防治香蕉枯萎病有重要作用.

表2 韭菜根系浸提液对土壤微生物群落多样性指数的影响(96 h)1)Tab.2 Effects of Allium tuberosum root extracts on diversity indexes of soil microbial community
Biolog Eco微平板上有31种碳源,分为6大类,研究土壤微生物对碳源利用能力的不同,可以深入了解微生物群落功能的差异.由表3可知,相对于CK,韭菜根系浸提液处理的土壤微生物对6类碳源的利用率差异明显减小,说明韭菜根系浸提液处理的土壤微生物群落组成的均匀度较高.此外,韭菜根系浸提液处理的土壤中微生物对6类碳源的利用能力均高于对照,且随着浸提液浓度的提高,土壤微生物对碳源底物的利用能力增强,说明韭菜浸提液促进了土壤微生物群落总体水平和微生物代谢活性的提高.这一结果验证了上述关于韭菜根系浸提液优化土壤微生物生态积极作用的结论.

表3 韭菜根系浸提液对土壤微生物利用碳源底物能力的影响1)Tab.3 Effects of Allium tuberosum root extracts on carbon substrate utilization by soil microbial
3 讨论与结论
目前,关于韭菜的抑菌抗菌作用的研究仅有少量报道[12,14,27-30],利用韭菜对香蕉枯萎病菌的化感抑制作用防治香蕉枯萎病的研究报道更少,且这些研究都集中在韭菜茎、叶浸提液对香蕉枯萎病的抑菌防病效果上,此外,这些报道均未对韭菜对土壤微生物生态的影响以及上述影响与防病之间的联系作出解释,而关于韭菜根系对香蕉枯萎病的抑菌和防病效果以及对土壤微生物生态影响的研究目前尚鲜见报道.香蕉枯萎病为典型的土传病害,因此,以韭菜的地下部分(根系)为研究对象,来验证和推广韭菜-香蕉套作、间作耕作制度防治香蕉枯萎病更具实际意义.
韭菜根系浸提液对香蕉枯萎病的抑菌试验和盆栽防病试验表明,韭菜根系浸提液可以显著抑制病原菌菌丝的生长和孢子的萌发,并使其形态发生畸变,对香蕉枯萎病具有明显的防治效果.这与YU[28]关于韭菜浸提液抑制番茄青枯病、黄永红等[15]和冯岩等[16]关于韭菜茎、叶浸提液抑制香蕉枯萎病的研究结论一致.至于究竟是韭菜根系中何种物质在起作用或者是否为多种物质的协同作用及其抑制机理尚待进一步研究.冯岩等[16]在韭菜体内检测出多种含硫化合物和多种农药的重要组成成分,如嗪、吡喃、吡唑、吡啶、喹啉等,并推断这些物质与抑菌作用相关.此外,韭菜对香蕉枯萎病的后期防病效果有待进行大田试验观察.
在对土壤微生物数量的影响上,韭菜根系浸提液抑制了土壤中香蕉枯萎病菌和真菌数量的增长.说明韭菜根系浸提液还有可能抑制其他真菌性病原菌的繁殖,这就为利用韭菜防治其他作物的土传真菌性病害提供了可能.这一推断在姚安庆[14]关于韭菜部分组织浸提液对大毛霉菌、柑橘青霉、黑根霉表现出抑菌性的研究中得到验证.与之相反,土壤中细菌的数量随着浸提液浓度的提高和时间的延长持续增加,这与邓晓等[31]关于香蕉枯萎病危害程度轻的土壤中细菌数量明显高于危害程度高的土壤的研究结论一致.土壤微生物数量的增加尤其是细菌数量的增加有利于土壤养分的转化、土壤微生物群落多样性和整体活性的提高,进而促进整个土壤生态的平衡稳定,提高土壤抑病性[32-34].
韭菜根系浸提液能提高土壤微生物利用碳源的能力以及微生物群落的多样性、丰富度和均匀度,进而说明韭菜根系浸提液能提高土壤微生物的代谢活力,优化微生物群落结构,使得土壤微生物生态趋向平衡.前人研究发现土传病害的流行其主要原因就在于土壤微生物群落结构失衡而导致的微生态环境恶化,健康平衡的土壤微生物生态对作物土传病害的发生有较强的抑制作用[23,34-36].由此可知,韭菜根系浸提液对香蕉枯萎病的防治效果,不仅源自其对病原菌的直接抑制作用,而且,还由于其促进了土壤微生物生态向健康、平衡、稳定的方向发展,提高了土壤的抑病性,从而对香蕉枯萎病的发生起到间接控制作用.
[1]杜志勇,樊小林.改性石灰氮防治香蕉枯萎病及其恢复香蕉生产的效果[J].果树学报,2008,25(3):373-377.
[2]STOVER R H,BUDDENHAGEN I W.Banana breeding polyploidy,disease resistance and productivity[J].Fruits,1986,41(3):175-191.
[3]卓国豪,黄有宝,吴运新,等.香蕉枯萎病的综合防治技术[J].植物检疫,2003,17(5):279-280.
[4]GETHA K,VIKINESWARY S,WONG W H,et al.Evaluation of Streptomyces sp.strain g10 for suppression of Fusarium wilt and rhizosphere colonization in pot-grown banana plantlets[J].J Ind Microbiol Biotechnol,2005,32(1):24-32.
[5]WEBER O B,MUNIZ C R,VITOR A O,et al.Interaction of endophytic diazotrophic bacteria and Fusarium oxysopoyum f.sp.cubence on plantlets of banana‘Maca’[J].Plant Soil,2007,298(1/2):47-56.
[6]RICE E L.Allelopathy[M].New York:Academic Press Inc,1984:1-5.
[7]SINGH H P,BATISH D R,KOHLI R K.Autotoxicity:Concept,organisms,and ecological significance[J].Crit Rev Plant Sci,1999,18(6):757-772.
[8]董章杭,林文雄.作物化感作用研究现状及前景展望[J].中国生态农业学报,2001,9(1):80-83.
[9]孔垂华.21世纪植物化学生态学前沿领域[J].应用生态学报,2002,13(3):349-353.
[10]连宾,王进军,陆玲.植物与微生物的化感作用[J].南京师范大学学报:自然科学版,2007,30(1):88-94.
[11]袁高庆,黎起秦,叶云峰,等.植物化感作用在植物病害控制中的应用[J].广西农业科学,2009,40(8):1017-1020.
[12]刘建涛,赵利,苏伟,等.韭菜中生物活性成分及其分子生物学的研究进展[J].食品科技,2006,40(8):67-70.
[13]JACQUES A,CHANTAL L,ERIC T.Sulfur compounds in allium(9):Biosynthesis and activity in insects[J].Acta Bot Gallica,1993,140(2):157-168.
[14]姚安庆.洋葱、大蒜、韭菜抗菌作用的比较[J].贵州农业科学,2004,32(3):56-57.
[15]黄永红,李春雨,左存武,等.韭菜对巴西香蕉枯萎病发生的抑制作用[J].中国生物防治学报,2011,27(3):344-348.
[16]冯岩,杨静美,陈睿,等.韭菜有机溶剂提取液的气相色谱-质谱分析及其对香蕉枯萎病菌的抑制作用研究[J].分析测试学报,2011,30(11):103-107.
[17]吴文君.植物化学保护实验技术导论[M].西安:陕西科学技术出版社,1988:157-213.
[18]孙广宇,宗兆锋.植物病理学实验技术[M].北京:中国农业出版社,2002:58-60.
[19]许志刚.普通植物病理学[M].北京:中国农业出版社,2002:236-262.
[20]韩宝坤,杜艳华.非无菌条件下分离尖孢镰刀菌的培养基[J].植物病理学报,2001,31(4):373.
[21]姚槐应,黄昌勇.土壤微生物生态学及其试验技术[M].北京:科学出版社,2006:166-169.
[22]MASAYA N,SHIOMI Y,SUZUKI S.Suppression of growth of Ralstonia solanacearum,tomato bacterial wilt agent,on/in tomato seedlings cultivated in a suppressive soil[J].Soil Sci plant Nutr,1999,45(1):78-87.
[23]SHIOMI Y,MASAYA N,TOMOKO O,et al.Comparison of bacterial community structure in the rhizosphere of tomato plants grown in soils suppressive and conducive towards bacterial wilt[J].Appl Eiron Microb,1999,65(9):3996-4001.
[24]章家恩,廖宗文.试论土壤的生态肥力及其培育[J].土壤与环境,2000,9(3):253-256.
[25]GARLANG J L,MILLS A L.Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J].Applied Environmental Microbiology,1991,57(8):2351-2359.
[26]GARLANG J L.Patterns of potential C source utilization by rhizosphere communities[J].Soil Biology & Biochemistry ,1996,28:223-230.
[27]周国顺,甘贤友,孙俊良,等.番茄韭菜间作防治番茄病毒病研究简报[J].河南职技师院学报,1992,20(4):52-53.
[28]YU J Q.Allelopathic suppression of Psedomonas solanacearum infection of tomato(Lycoperdicon esculentum)in a tomatochinese chive(Allium tuberosum)intercropping system[J].Journal of Chemical Ecology,1999,25(11):2409-2417.
[29]吴莉,陈文利.韭叶中化学成分的生物活性研究[J].化学与生物工程,2005,22(2):49-51.
[30]孙志勇,宋明英,韦坤德,等.韭菜汁对病原菌的体外抑制作用的研究[J].遵义医学院学报,2008,31(6):584-586.
[31]邓晓,李勤奋,侯宪文,等.香蕉枯萎病区土壤可培养微生物生态特征[J].热带作物学报,2011,32(2):283-288.
[32]IBEKWE A M,KENNEDY A C,FROHNE P S,et al.Microbial diversity along a transect of agronomic zones[J].FEMS Microbiology Ecology,2002,39(3):183-191.
[33]GARBEVA P,POSTMA J,VEEN J A,et al.Effect of above-ground plant species on soil microbial community structure and its impact on suppressionn of Rhizoctonia solani AG3[J].Environmental Microbiology,2006,8:233-246.
[34]龚明福,贺江舟,孙晓棠,等.土壤微生物与土壤抑病性形成关系研究进展[J].新疆农业科学,2007,44(6):814-819.
[35]蔡燕飞,廖宗文,董春,等.番茄青枯病的土壤微生态防治研究[J].农业环境保护,2002,21(5):417-420.
[36]胡可,李华兴,卢维盛,等.生物有机肥对土壤微生物活性的影响[J].中国生态农业学报,2010,18(2):303-306.
