343株致病性念珠菌的基因鉴定及药物敏感性检测
2012-06-15罗振华
罗振华,王 和
(贵阳医学院微生物学教研室,贵阳550004)
近年来,随免疫抑制剂、糖皮质激素、抗菌药物的广泛应用与滥用、器官移植手术以及介入性诊疗操作等的普及,真菌感染尤其是机会性深部真菌感染率逐年上升[1,2]。文献[3,4]报道,白假丝酵母菌等念珠菌是条件致病性真菌感染的主要病原体,占目前医院内真菌感染率的首位。临床对于致病性真菌的鉴定主要依赖形态、培养和生化反应,近年来国内外已开始研究和采用基因检测与分析的方法进行真菌研究、鉴定与分类[5~7]。为了解贵州地区致病性念珠菌的基因类型、分布情况和药物敏感性特点,2007年1月~2010年12月,我们对临床标本分离的343株念珠菌的内部转录间隔区(Internal transcribed spacer,ITS)、25SrDNAⅠ型内含子序列和药物敏感性进行了检测与分析,现将结果报告如下。
1 材料与方法
1.1 标本来源及其分布 按文献[8]方法从317例(贵阳市、安顺市、凯里市、兴义市的二级或三级医院)感染患者的标本中分离致病性念珠菌343株,其中分离自痰或或纤支镜标本分离227株(66.1%)、阴道分泌物 58 株(16.9%)、尿液 38 株(11.0%)、粪便5 株(1.5%)、精液5 株(1.5%)、前列腺液 5株(1.5%)、伤口分泌物 3株(0.9%)、血液1 株(0.3%)、胸水1 株(0.3%)。
1.2 念珠菌基因检测与鉴定 ①DNA提取:用Fungus DNA extraction isoplant试剂盒(日本和光纯药工业)及其方法处理和分离提取念珠菌的DNA。②ITS序列检测与分析:用引物ITS5 5'-GGAAGTAAAAGTCGTAACAAGG-3'和ITS4 5'-TCCTCCGCTTATTGATATGC-3'(美国 AmershamBiosciences公司)扩增各分离菌株的ITS序列[9]。PCR反应体系总体积为 25μL,含 puReTaq Ready-To-Go PCR beads(美国 AmershamBiosciences公司)1份、引物ITS5和ITS4各1μL、DNA模板液1μL、蒸馏水补至25μL。PCR反应循环参数:94℃预变性5 min,94℃变性30 s、55℃退火30 s、72℃延伸1 min共35个循环,72℃终末延伸10 min。PCR产物在1.5%琼脂糖凝胶电泳50 V电泳1 h,260 nm紫外线灯下观察和送北京三博远志生物技术有限公司做序列测定。测序结果用CLC sequence Analysis软件分析,经BLAST检索搜索GeneBank及DDBJ数据库进行序列的同源性分析,根据99%以上符合率鉴定菌种。③25SrDNA I型内含子序列检测:分别对ITS鉴定的白假丝酵母菌、光滑假丝酵母菌及热带假丝酵母菌进行25SrDNA I型内含子序列检测,用引物CA-INT-L 5'-ATAAGGGAAGTCGGCAAAATAGATCCGTAA-3'和CA-INT-R 5'-CCTTGGCTGTGGTTTCGCTAGATAGTAGAT-3'(美国 AmershamBio-sciences公司)扩增其25S rDNAⅠ型内含子区[6]。PCR反应总体积为25μL,含PCR bead 1份、引物CA-INT-L和 CA-INT-R各 2.5μL、DNA模板液 1 μL、蒸馏水补至25μL。PCR反应循环参数:94℃预变性3 min,94℃变性1 min、65℃退火1 min、72℃延伸2.5 min共30个循环,72℃终末延伸10 min。PCR产物在1.5%琼脂糖凝胶电泳50 V电泳1 h,260 nm紫外线灯下观察,对照25S rDNAⅠ型内含子基因型阳性菌株[日本千叶大学病原性真菌与真菌毒素研究所惠赠,包括白假丝酵母菌54366(基因 A型)、54368(基因 B型)、54375(基因 C型)、49826(基因E型),都柏林假丝酵母菌54605(基因D型)]的电泳图谱鉴定分离菌株的基因型。白假丝酵母菌、光滑假丝酵母菌和热带假丝酵母菌部分菌株的PCR扩增产物送北京三博远志生物技术有限公司做序列测定,结果用CLC sequence Analysis软件分析,经BLAST检索GeneBank及DDBJ数据库进行序列的同源性分析及比对分析基因结构特点。
1.3 药物敏感试验 按ATB FUNGUS3酵母菌样药敏检测试剂(法国梅里埃公司)说明书对227株临床分离念珠菌进行5-氟胞嘧啶(5-FC)、两性霉素B(AMB)、氟康唑(FCA)、伊曲康唑(ITR)、伏立康唑(VRC)的药敏性检测。以白假丝酵母菌ATCC 10231和克柔假丝酵母菌ATCC6258为质控菌株(中国生物药品检定所提供)。
1.4 统计学方法 采用SPSS13.0软件进行统计学处理,率的比较行χ2检验,检验水准α=0.05。
2 结果
2.1 念珠菌的ITS类型 分离的343株念珠菌经ITS序列分析,分别为白假丝酵母菌210株(61.2%)、光滑假丝酵母菌 45 株(13.1%)、热带假丝酵母菌29株(8.4%),见表1。
2.2 25S rDNAⅠ型内含子基因型 ①25S rDNAⅠ型内含子电泳图谱:210株白假丝酵母菌Ⅰ型内含子基因型分别为A型115株(54.8%)、B型58株(27.6%)、C 型37株(17.6%),未发现D 型与 E 型菌株,见图1。29株光滑假丝酵母菌和17株热带假丝酵母菌PCR扩增产物均为约450 bp的单一条带,见图2、3。②25SrDNAⅠ型内含子序列:光滑假丝酵母菌与热带假丝酵母菌25S rDNAⅠ型内含子测序全长 461 bp,GenBank(http://www.ncbi.nlm.nih.gov/)的核苷酸数据库基因序列对比与白假丝酵母菌编码25S rRNA基因(登录号AY441784)序列同源性达99%。光滑假丝酵母菌与热带假丝酵母菌25S rDNAⅠ型内含子与白假丝酵母菌54366(基因A型)25SrDNAⅠ型内含子序列的同源性分别为90%和97%。
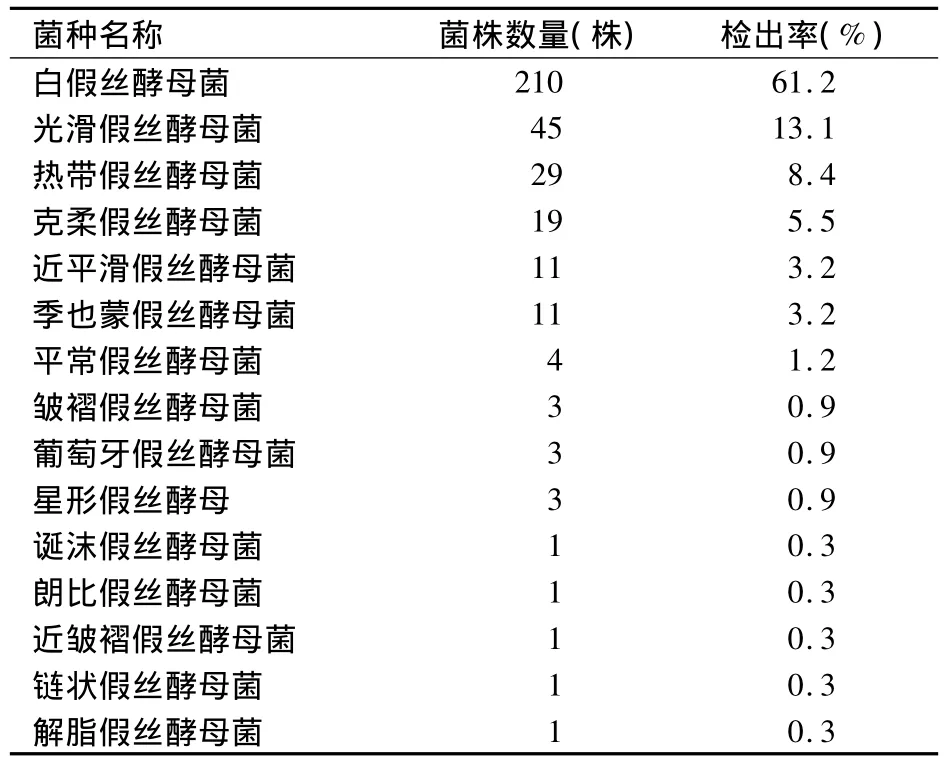
表1 343株临床分离念珠菌ITS鉴定结果
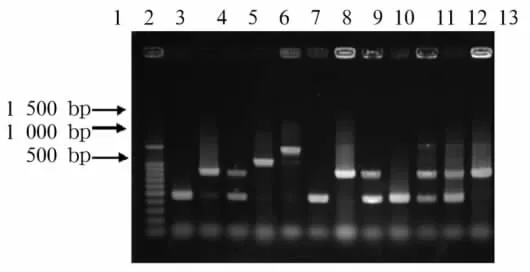
图1 白假丝酵母菌25S r DNAⅠ型内含子序列PCR扩增产物电泳结果
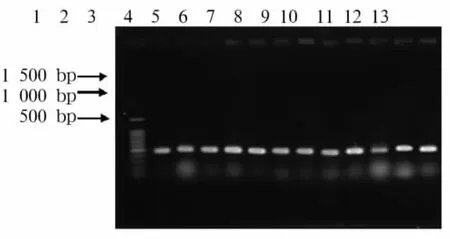
图2 光滑假丝酵母菌25Sr DNAⅠ型内含子序列PCR扩增产物电泳结果注:1为DNA Marker;2~13为光滑假丝酵母菌临床分离株
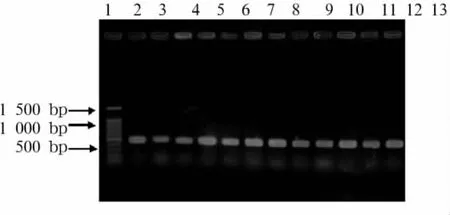
图3 热带假丝酵母菌25Sr DNAⅠ型内含子序列PCR扩增产物电泳结果注:1为DNA Marker;2~13为热带假丝酵母菌临床分离株
2.3 不同类型菌株的药物敏感性 227株念珠菌对5-FC和AMB具有较高的药物敏感率,其中白假丝酵母菌5-FC与AMB的药物敏感率分别为91.5%和98.9%。白假丝酵母菌、光滑假丝酵母菌和热带假丝酵母菌对唑类药物的敏感率较低(33.3% ~82.9%),其中白假丝酵母菌对唑类药物的耐药率达82.9%(见表2)。
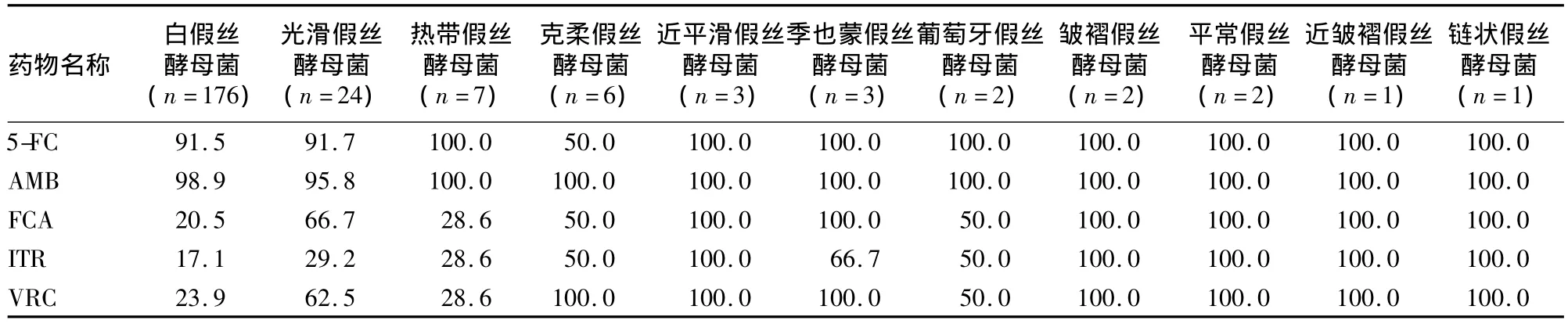
表2 227株念珠菌的药物敏感率(%)
2.4 白假丝酵母菌不同基因型的药物敏感性 97株白假丝酵母菌基因A型、51株基因B型和28株基因C型对5-FC和AMB具有较高的敏感率(88.7% ~100.0%),对唑类药物具有较高的耐药率(72.5% ~89.3%),见表3。各基因型间的药物敏感性无显著性差异(P>0.05)。
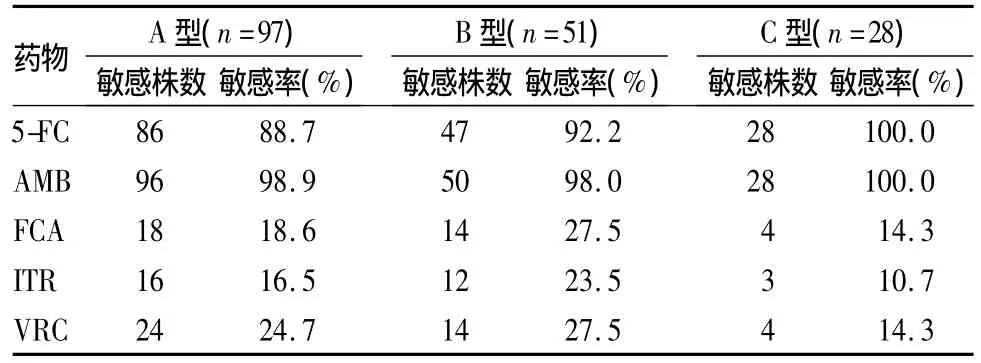
表3 白假丝酵母菌A、B和C基因型的药物敏感性
3 讨论
近年来,念珠菌已成为深部真菌感染中最常见的条件致病性真菌,常继发于细菌或病毒感染、肿瘤、机体免疫力低下、插管等侵入性操作以及抗菌药物的不规范使用等情况下[1,5,10]。本文结果显示,自临床标本分离的343株致病性念珠菌中,白假丝酵母菌占检出率的首位(61.2%);其次分别是光滑假丝酵母菌、热带假丝酵母菌、克柔假丝酵母菌等。提示白假丝酵母菌是本地区念珠菌感染的常见病原性真菌,与国内外报道[10,11]相似。文献[5,12,13]报道,ITS是位于真菌染色体上18S rDNA和5.8S rDNA之间及5.8SrDNA和28S rDNA之间的核糖体内转录区序列,相同菌种的ITS区序列具有大于99%的相似性,因此近年来国内外广泛应用于真菌的基因鉴定及其流行病学调查与研究。本文结果进一步证实,采用ITS序列PCR扩增及序列分析的方法,有助于提高致病性念珠菌鉴定的敏感性与特异性。
白假丝酵母菌的25S rDNA编码区内存在可转座Ⅰ型内含子核苷酸序列,根据内含子缺失以及形成的片段大小,可将白假丝酵母菌划分为A、B、C、D和E五种基因型,其中基因A型缺乏Ⅰ型内含子。白假丝酵母菌的不同基因型在引起感染的分布、抗真菌药物敏感性等方面存在差异[6]。本文结果显示,贵州地区深部感染致病性白假丝酵母菌的基因包括A型、B型和C型,未检出D型和E型,其中A型检出率最高(54.8%),与国内外文献[6,14]报道相似。提示基因A型、B型和C型为贵州地区深部感染患者的病原性白假丝酵母菌常见基因型,尤以A型为著。热带假丝酵母菌和光滑假丝酵母菌25S rDNAⅠ型内含子序列PCR扩增产物与白假丝酵母菌基因A型扩增产物大小一致(约450 bp),经序列比对与白假丝酵母菌基因A型相似率分别为97%和90%。提示光滑假丝酵母菌与热带假丝酵母菌25SrDNA序列中不存在可转座Ⅰ型内含子,采用PCR扩增25SrDNAⅠ型内含子方法对白假丝酵母菌进行基因分型具有较高的特异性。
致病性真菌耐药性菌株的形成与扩散对临床治疗真菌感染的效果产生了重要的不利影响。本文结果显示,临床分离念珠菌对5-FC和AMB的敏感率较高,其中白假丝酵母菌的敏感率分别高达91.5%和98.9%。但其中常见的致病性菌种白假丝酵母菌、光滑假丝酵母菌和热带假丝酵母菌对唑类药物均具有较高的耐药率(33.3% ~82.9%),尤其白假丝酵母菌的唑类药物耐药率达82.9%。提示本地区常见致病性念珠菌存在较高对唑类药物耐药率及交叉耐药现象,可能与这些抗真菌药物的广泛使用或不规范使用有关。文献[14,15]报道,白假丝酵母菌的不同基因型具有不同的抗真菌药物敏感性。本文结果显示,白假丝酵母菌基因A型、B型和C型菌株对5-FC和AMB均具有较高的敏感率(88.7% ~100.0%),但对唑类药物具有较高的耐药率(72.5% ~89.3%),其中基因A型对5FC的耐药率(11.3%)高于基因 B型(7.8%)与基因 C型(0),与文献报道[14,15]相似。
本地区临床分离的致病性念珠菌以白假丝酵母菌及其基因A型最常见,检测ITS序列和25S rDNAⅠ型内含子序列有助于致病性念珠菌的快速鉴定;白假丝酵母菌对唑类药物的高耐药性以及交叉耐药性是造成真菌感染患者临床治疗困难的一个重要因素。
[1]冯文莉,杨静,奚志琴,等.3年间医院内侵袭性真菌感染的病原菌分布及临床分析[J].中华医院感染学杂志,2008,18(7):1030-1033.
[2]Chapman SW,Sullivan DC,Cleary JD.In search of the holy grail of antifungal therapy[J].Trans Am Clin Climatol Assoc,2008,119:197-216.
[3]Miceli MH,Diaz JA,Lee SA.Emerging opportunistic yeast infection[J].Lancet Infect Dis,2011,11(2):142-151.
[4]Machado AG,Komiyama EY,Santos SSF,et al.In vitro adherence of Candida albicans isolated from patients with chronic periodontitis[J].JAppl Oral Sci,2011,19(4):1678-1682.
[5]李劲松,宋诗铎,祁伟,等.常见深部念珠菌感染快速基因诊断[J].中国感染控制杂志,2004,3(3):198-201.
[6]Tamura M,Watanabe K,Mikami Y,et al.Molecular characterization of new clinical isolates of candida albicans and C.dubliniensis in Japan:analysis reveals a new genotype of C.albicans with group I intron[J].JClin Microbiol,2001,39(12):4309-4315.
[7]Tay ST,Chai HC,Na SL,et al.Molecular subtyping of clinical isolates of Candida albicans and identication of Candidadubliniensis in Malaysia[J].Mycopathologia,2005,159(3):325-329.
[8]叶应妩,王毓三,申子瑜,等.全国临床检验操作规程[M].南京:东南大学出版社,2006:736-753.
[9]White TJ,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A].In:Innis MA,Gelfand DH,Sninsky JJ,et al∥PCR protocols,a guide to methods and applications[C].Academic Press,San Diego,Calif,1990:315-322.
[10]Morace G,Borghi E.Fugal infections in ICU patients:epidemiology and the role of diagnostics[J].Minerva Anestesiologica,2010,76(11):950-956.
[11]袁春雷,李介华,李冬秀,等.323株酵母样真菌的分离鉴定与耐药性分析[J].中国公共卫生杂志,2004,20(1):98.
[12]Chang HC,Leaw SN,Huang AH,et al.Rapid identification of yeasts in positive blood cultures by a multiplex PCR method[J].J Clin Microbiol,2001,39(10):3466-3471.
[13]Leaw SN,Hsien CC,Hsiao FS,et al.Identi cation of Medically Important Yeast Species by Sequence Analysis of the Internal Transcribed Spacer Regions[J].JMicrobiol,2006,44(3):693-699.
[14]朱晓芳,章强强,蓝和魁,等.白念珠菌临床分离株的基因分型及药物敏感性研究[J].扬州大学学报(农业与生命科学版),2004,25(4):82-84.
[15]Mc Cullough M,Clemons KV,Stevens DA.Molecular and phenotypic characterization of genotypic Candida albicans subgroups and comparison with Candida dubliniensis and Candida stellatoidea[J].JClin Microbio,1999,37(2):417-421.
