碎米荠CarKCS基因全长CDS克隆、序列分析及表达载体构建
2012-06-14魏解冰刘春林
杨 慧,魏解冰,阮 颖,刘春林*
(1作物种质资源创新与利用国家重点实验室培育基地,长沙410128;2湖南农业大学农学院;3湖南农业大学生物科学与技术学院,长沙410128)
神经酸,化学名为顺-15-二十四碳烯酸(24:1),是一种超长链单不饱和脂肪酸(VLCMFA),存在于蒜头果、碎米荠、银扇草、大麻、鸡爪槭、旱金莲、遏蓝菜、盾叶木、元宝枫等植物的种子油中[1,2]。有研究表明,神经酸是大脑神经细胞和神经组织的核心天然成分,是迄今为止世界上发现的能促进受损神经组织修复和再生的特效物质,是神经细胞特别是大脑细胞、视神经细胞、周围神经细胞生长、再发育和维持的“必需高级营养素”,对提高脑神经的活跃程度,防止脑神经衰老有很大作用[3]。但人体自身很难生成神经酸,只能靠体外摄取来补充。目前人们正致力于生产天然的神经酸油用于医药、营养制品和工业应用。自然界中含神经酸植物的果实含油量、神经酸含量差异较大,开发成本高,要开发神经酸产品,需要低成本地获得天然高含神经酸的资源。
神经酸的合成过程主要涉及到β-酮脂酰-CoA合酶(3-ketoacyl-CoA synthase,KCS)、β-酮脂酰-CoA还原酶 (3-ketoacyl-CoA reductase,KCR)、β-羟脂酰-CoA脱水酶(3-hydroxacyl-CoA dehydratase,HCD)和反式烯脂酰-CoA还原酶(trans-2,3-enoyl-CoA reductase,ECR),这4种酶协同作用形成功能复合体,称为脂肪酸延长酶[4]。其中β-酮脂酰-CoA合酶又称为脂肪酸延长酶1(Fae1)或简称KCS。有研究显示,虽然所有植物及微生物体的脂肪酸延长酶系统中都普遍存在着这4种酶,但除第一个酶β-酮脂酰-CoA合酶(KCS)起着关键作用外,其它3种酶的作用处于次要地位,因此KCS酶的活性高低成为制约超长链脂肪酸合成的重要因素[5],是超长链脂肪酸合成反应的限速酶[6]。目前许多低芥酸油菜品种的育种原理都是通过该酶的突变完成的。Millar和Kunst在酵母中成功地利用强半乳糖诱导型启动子表达了拟南芥的fae1基因,并且在转化株中积累了20:1,22:1以及24:1这些在非转化酵母培养物中不存在的脂肪酸[7]。Fae1基因是β-酮脂酰-CoA合酶的编码基因,也是控制芥酸等超长链脂肪酸合成的关键基因[8]。Elzbieta Mietkiewska等人克隆了银扇草的KCS基因,将其转入野生型拟南芥中,种子油脂肪酸成分分析表明神经酸的含量增长了30倍,转入埃塞俄比亚芥也使其种子油中神经酸含量增长了7至10 倍[9]。GenBank 中 尚 无 碎 米 荠 (Cardamine hirsuta L.)KCS基因cDNA序列的记录。本实验根据KCS基因的保守性,设计引物,通过PCR克隆神经酸含量较高的碎米荠的KCS基因,并将其连接到种子特异性启动子NapinA上,构建成过表达载体,用来转化高芥酸含量的甘蓝型油菜,希望通过生产油菜来获得神经酸产品。
1 材料与方法
1.1 材料
1.1.1 供试品种
碎米荠,采于湖南农业大学校内路旁;高芥酸含量的甘蓝型油菜品种GX-29,为湖南农业大学植物代谢调控研究组提供。
1.1.2 菌株
DH5α,LBA4404,为湖南农业大学植物代谢调控研究组保存。
1.1.3 载体与质粒
pMD19-T载体购自 TaKaRa公司。pFGC-5941.nap[10]表达载体为本实验室以NapinA启动子置换pFGC-5941质粒35S启动子改造而成。
1.1.4 分子生物学试剂
TaqTMDNA聚合酶购自东盛生物;LongAmp TaqDNA Polymerase购自BioLabs公司;限制性内切酶,DNA T4 Ligation Kit购自晶美公司;质粒DNA小量纯化 Kit,DNA凝胶回收 kit购自安比奥公司;DNA Marker购自北京天根;CTAB,Tris base,EDTA均购自欧迈生物;琼脂糖:西班牙产;酵母提取物、蛋白胨购自OXOID.L TD;抗生素购自北京鼎国生物技术发展中心。
1.2 方法
1.2.1 碎米荠总DNA的制备
以碎米荠幼叶为材料,参照CTAB法制备[11]。
1.2.2 引物设计及目的基因的全长CDS克隆
登陆 NCBI网站 (http://www.ncbi.nlm.nih.gov/),未找到碎米荠KCS基因的相关信息,但找到碎米荠属Cardamine graeca L.的KCS基因mRNA全长序列(EU871788)。下载后利用DNAS TAR软件进行序列编辑和分析,该KCS基因全序列,不含内含子,总长度为1 521 bp,共编码506个氨基酸。而KCS基因在不同的种间都具有很大的保守性,因此可以根据该序列用Primer Premier 5.0软件设计引物扩增碎米荠的KCS基因全序列。并根据质粒载体pFGC5941.nap的限制性酶切位点,在正反向引物的5'端分别加入AscI和BamHI位点。引物由南京金斯瑞(Genscript)生物科技有限公司合成。引物序列如下:
KCSSF:5'-GGCGCGCCATGACGTCCATTAACG TAAAGCTC-3'
KCSSR:5'-GGATCCTTAGGACCGACCGTTT TGGGCA-3'
高保真LongAmp TaqDNA聚合酶PCR扩增的反应体系为50 μL,反应条件:94℃预变性3 min;94℃变性30 s;70℃退火10 s;72℃延伸80 s;72℃延伸7 min;16℃保存。扩增28个循环。PCR产物经琼脂糖凝胶电泳检测,然后用安比奥公司DNA凝胶回收kit进行回收纯化后,连接到载体 pMD19-T构建成T载体,命名为T-CarKCS。热激法将此连接质粒转化到大肠杆菌DH5α感受态细胞中,取100 μL涂到LB固体培养基(含氨苄青霉素50 μg/mL)上,于37℃过夜培养,重组子经鉴定后送南京金斯瑞生物科技有限公司测序。
1.2.3 序列的生物信息学分析
可在NCBI站点上进行氨基酸序列推导及结构域分析,通过 EXPASY的 ProtParam(http://us.expasy.org/tools/protparam.html)分析 CarKCS基因编码蛋白的理化性质,应用SMART(http://smart.embl-heidelberg.de/)在线预测CarKCS基因编码蛋白的结构域,用Clustal W软件进行氨基酸序列同源性比对,再用MEGA 4.1做系统进化树分析。
1.2.4 种子特异表达载体的构建
用限制性内切酶AscI和 BamHI分别对 TCarKCS载体和pFGC-5941.nap质粒进行双酶切。酶切得到的目的片段和载体均用凝胶回收kit回收,再按3∶1的连接体系进行连接。将切下的TCarKCS片段插入pFGC-5941.nap质粒的相应位点,构建成pNapin-CarKCS载体。将连接产物转化大肠杆菌DH5α感受态细胞,再涂布于 LB平板(含卡那霉素50 μg/mL)上筛选阳性克隆,通过菌落PCR检测阳性克隆。按常规方法提取质粒,进行PCR反应及酶切验证获得带有目的基因的植物过表达载体。
2 结果与分析
2.1 目的片段的克隆和测序
根据合成引物的退火温度,设计温度梯度PCR,确定最佳的退火温度为53℃,然后以53℃为退火温度做PCR扩增,扩增结果如图1。从电泳图可以发现扩增条带大小约为1 500 bp,扩增片段的大小与预期的一致。回收PCR产物,连接到pMD19-T载体上,用热激法转化大肠杆菌DH5α的感受态细胞,取100 μL涂布到含50 μg/mL氨苄青霉素的LB固体培养基上,于37℃过夜培养,挑单菌落做菌落PCR,如图2所示。图中4、5、7号泳道都为阳性克隆,选取7号泳道的阳性克隆送公司测序。测序结果表明,去掉载体及酶切位点后扩增产物的大小为1 518 bp。将测序结果在NCBI上进行Blast同源分析比对,此序列与碎米荠属Cardamine graeca L.的KCS基因的mRNA全长序列(EU871788)同源性达到88%。由此表明,所克隆的片段为CarKCS基因的全长序列。
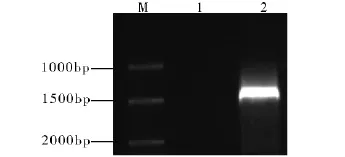
图1 CarKCS目标片段的PCR产物Fig.1 PCR test of CarKCS fragment

图2 菌落PCR检测结果Fig.2 Results of PCR test of colonies
2.2 序列及蛋白质的理化性质分析
将测序的CarKCS基因CDS序列在NCBI上进行翻译,发现该基因编码505个氨基酸,不含内含子,全长为1 518 bp的完整开放阅读框,相对分子质量为 56 346.0,等电点为 9.41。而碎米荠属Cardamine graeca L.的KCS基因(EU871788)编码506个氨基酸,相对分子质量为56 465.1,等电点为9.25。进一步将在NCBI上翻译得到的氨基酸序列用SMART在线进行蛋白质结构预测及分析,结果表明,其在第9至第31位氨基酸、第51至第70位氨基酸及第342至第364位氨基酸分别构成了3个跨膜结构域。
许多科学家都对甘蓝型油菜中KCS活性丧失的原因进行了大量研究。Han等发现,在所有有功能的KCS蛋白中第282位氨基酸都为丝氨酸残基,而无功能的蛋白在该位都为苯丙氨酸残基[12],CarKCS基因在第282位氨基酸都为丝氨酸残基。Ghanevati等利用酵母表达系统,进行定点突变研究,还证实了 Cys223,His302,His387,His391 和His420都是组成β-酮酯酰-CoA合酶的活性位点的氨基酸残基,这些氨基酸任何一个发生突变都会导致酶活性的丧失[13,14]。
将CarKCS基因氨基酸序列与拟南芥中同源性最高的KCS18氨基酸序列进行ClustalW分析,再用MEGA做系统进化树图谱如图3,结果表明该基因有 Ser282,Cys223,His302,His387,His391 和 His420这些活性位点的氨基酸都存在,据此可以推测该基因具有正常的催化功能。

图3 CarKCS与KCS18酶活性位点分析图Fig.3 Analysis on enzyme active site between CarKCS and KCS18
2.3 CarKCS基因的系统进化树分析
KCS基因家族主要存在于植物界,拟南芥脂基因数据库中揭示了21个KCS相关基因的存在[15]。Lessire等人根据氨基酸序列同源性进行ClustalW比对,可将其划分为4个亚组:FAE1-like,KCS1-like,FDH - like,CER6 - like[16]。这些 KCS 基因存在组织、器官的特异性表达和底物特异性。它们对饱和的及单不饱和的C16和C18脂肪酰-CoA具有较高的活性,其中7个基因(FAE1,KCS1,KCS2,At5g43760,Atlg04220,CER60,At2g16280)在酵母中异源表达后可催化VLCEAs合成,不同程度的积累C20 ~C30 脂肪酸[17,18]。碎米荠与拟南芥同属于十字花科植物,本实验通过Clustal W将CarKCS与拟南芥KCS基因家族成员的氨基酸序列进行同源性比对分析,发现CarKCS基因与KCS18的亲缘关系最近,同属于FAE1-like亚家族。

图4 CarKCS与拟南芥KCS基因家族蛋白的进化树Fig.4 A phylogenetic tree of family proteins of CarKCS and KCS gene
2.4 CarKCS基因种子特异表达载体的构建
用AscI和BamHI分别双酶切T-CarKCS和pFGC-5941.nap质粒,切胶回收目的片段,并用T4连接酶将T-CarKCS片段和pFGC-5941.nap载体目的片段连接,根据pFGC-5941.nap载体序列和目的片段序列设计一对引物用来检测载体是否插入目的片段,引物序列如下:
NAP-F:5'-GCTTCTCTCTCACAGCACACA CATAC-3'
KCS-R:5'- TGAACATGCAACAAGTCTTTAG CCAGATC-3'
从图5中分析,2号和3号泳道均以pNapin-CarKCS质粒为模板,2号泳道为检测引物所扩增出的条带,大小为848 bp左右,与所设计的大小相符。3号泳道为KCS基因引物所扩增出的条带,大小为1.5 kb左右。说明CarKCS片段已成功插入pFGC-5941.nap表达载体中,已成功构建好pNapin-CarKCS过表达载体。

图5 pNapin-CarKCS过表达载体的PCR检测Fig.5 PCR detection of pNapin-CarKCS overexpression vector
2.5 种子特有表达载体的酶切验证
用AscI和 BamHI双酶切所提的 pNapin-CarKCS质粒,如图6所示。泳道 2为 pNapin-CarKCS质粒双酶切后得到的片段长度与目的片段的大小刚好相符,证明目的基因碎米荠β-酮脂酰-CoA合酶(KCS)基因已成功连接到 pFGC5941.nap质粒为载体的植物表达载体中。进一步验证了CarKCS片段已成功插入pFGC-5941.nap表达载体中,已成功构建好 pNapin-CarKCS过表达载体。

图6 pNapin-CarKCS过表达载体的酶切检测Fig.6 Enzyme detection of overexpression vector of pNapin-CarKCS
3 讨论
拟南芥是一种良好的十字花科模式植物。Rosska等以拟南芥为材料,分别对40粒开花后3~15 d的未成熟种子和第17 d的成熟种子进行了脂肪酸成分分析,结果发现超长链脂肪酸从第7 d才开始出现,然后迅速积累直至第13 d,到第15 d种子接近成熟时超长链脂肪酸的合成也随之基本完成[19]。Tumham和Northocet通过实验发现甘蓝型油菜中储存脂也在胚发育中期合成速率最大[20]。本实验构建的pNapin-CarKCS过表达载体启动子来源于甘蓝型油菜种子储藏蛋白Napin A基因的启动子,具有种子特异、高效表达的特性,能够满足超长链脂肪酸合成的限速酶基因(KCS基因)在油菜种子中特异表达与调控。

图7 CarKCS基因过表达载体构建示意图Fig.7 Construction of the overexpression vector of CarKCS gene
芥酸是形成神经酸的原料,通过KCS的延长催化作用,加入2个碳原子后就能合成24:1的神经酸。以往通过基因工程的方法获得能产生神经酸的转基因植株,基本上是将克隆的KCS转到拟南芥或其它植物中,如埃塞俄比亚芥。但这些植物往往不是大田作物,且芥酸(22:1)含量极低。油菜作为主要的油料作物之一,广泛种植于中国、加拿大、澳大利亚及北欧国家,已成为第三大经济作物,菜子油已经成为第三大植物油[21];而且在油菜的一些材料中芥酸含量很高。所以,在成功构建了碎米荠CarKCS基因的种子特异表达载体基础之上,我们将进一步通过农杆菌介导的转化法转化高芥酸含量的甘蓝型油菜品种GX-29,以期获得pNapin-CarKCS表达的稳定转基因植株,筛选出神经酸含量高、产量高的稳定转基因油菜植株,以为获得廉价的神经酸产品来满足社会需求奠定基础。
[1]马柏林,梁淑芳,赵德文,等.含神经酸植物的研究[J].西北植物学报,2004,24(12):2362-2365.
[2]王性炎,樊金栓,王姝清.中国含神经酸植物开发利用研究[J].中国油脂,2006,31(3):69-71.
[3]候镜德,陈至善.神经酸与脑健康[M].北京:中国科学技术出版社,2006.
[4]Whitfield HV,Murphy DJ,Hills MJ.Sub-cellular localization of fatty acid elongase in developing seeds of Lunaria annua and Brassica napus[J].Phytochemistry,1993,32:255-258.
[5]Ohlrogge JB,Browse JA.Lipid biosynthesis[J].Plant Cell,1995,7:957 -970.
[6]Rossak M,Smith M,Kunst L.Expression of the FAE1 gene and FAE1 promoter activity in developing seeds oil.Arabidopsis thaliana [J].Plant Mol Biol,2001,46:717-725.
[7]Millar AA,Kunst L,The natural genetic variation of the fatty-acyl composition of seed oils in different ecotypes of Arabidopsis thaliana[J].Phytochem,1999,52(6):1029-33.
[8]武玉花,卢长明,吴 刚,等,植物芥酸合成代谢与遗传调控研究进展[J].中国油料作物学报,2005,27(2):82-86.
[9]GuoYM,Elzbieta Mietkiewska,Tammy Francis.Increase in nervonic acid content in transformed yeast and transgenic plants by introduction of a Lunaria annua L.3-ketoacyl- CoA synthase(KCS)gene[J].Plant Mol Biol,2009,69:565 –575.
[10]彭 琦,张 源,双 桑,等.甘蓝型油菜Fad2与Fae1基因双干扰RNAi载体的构建[J].生物技术通报,2007,(5):163 -166.
[11]王 灏,王道杰.用于RAPD分析的油菜总DNA的快速提取[J].西北农业学报,2001,10(3):32-34.
[12]Han JX,Luhs W.Sonntag K,et al.Functional characterization of β - ketoacyl- CoA synthase genes from Barssica napus L[J].Plant Mol Biol,2001,46(2):229-239.
[13]Ghanevati M,Jaworski JG.Active-site residues of a plant membrane-bound fatty acid el ongase β-ketoacyl- CoA synthase,FAE1 KCS[J].Biochim Biophys Acta,2001,1530(l):77-85.
[14]Ghanevati M,Jan G.Engineering and mechanistic studies of the Arabidopsis FAE1 β - ket oacyl- CoA synthase,FAE1 KCS[J].Eur J Biochem,2002,269:3531-3539.
[15]Beisson F,Koo AJ,Ruuska S,et al.Arabidopsis genes involved in acyl lipid metabolism[J].Plant Physiol,2003,132:681 -97.
[16]Patricia Costaglioli,Jerome Joubes,Rene Lessire.Profiling candidate genes involved in wax biosynthesis in Arabidopsis thaliana by microarray analysi[J].Biochimica et Biophysica Acta,2005,1734(3):247 -258.
[17]Trenkamp S,Martin W,Tietjen K.Specific and differential inhibition of very-long-chain fatty acid elongases from Arabidopsis thaliana by different herbicides[J].Proc Natl Acad Sci USA,2004,101(32):11903-11908.
[18]Paul S,Gable K,Beaudoin F,et al.Members of the Arabidopsis FAE1-like 3-ketoacyl-coA synthase gene family substitute for the elop proteins of Saccharomyces cerevisiae[J].J Biol Chem,2006,281(14):9018 -9029.
[19]Rosska TJ,Lessire R,Puyaubert J,et a.l.Mutations in the fatty acid elongation 1 gene are associated with a loss of β - ketoacyl- CoA synthase activity in low erucic acid rapeseed[J].FEBS Letters,2001,492:107 -111.
[20]Tumham E,Nohrteote DH.Changes in the activity of acetyl- CoA carboxylase during rape - seed formation[J].Bioehem J,1983,212:223-229.
[21]潘 刚,周永明.甘蓝型油菜遗传转化的研究进展[J].中国油料作物学报,2003,25(3):90-98.
