瘦素缺乏小鼠椎间盘退变的组织学观察
2012-06-13李新锋戴力扬
郭 震,李新锋,戴力扬
椎间盘退变的确切机理并不清楚,目前认为是在遗传易感性、衰老、力学负荷及营养供应障碍等因素共同作用下逐渐形成的[1]。随着分子生物学及分子免疫学技术的发展,细胞因子、类激素等对椎间盘退变的作用逐渐被重视起来[2-3]。2007 年,Gruber等[4]发现人体椎间盘细胞表达瘦素;本研究组也发现人体椎间盘细胞表达瘦素及其受体,瘦素对体外培养的大鼠软骨细胞有增殖作用[5]。本研究采用HE 染色对比6 月龄的ob/ob 小鼠(瘦素缺乏小鼠)和野生型小鼠(C57BL)椎间盘形态学;免疫组织化学检测两者椎间盘Ⅱ型胶原、蛋白聚糖表达;定量PCR 检测椎间盘Ⅱ型胶原、Ⅹ型胶原及蛋白聚糖基因表达等方面的差异,进一步探讨瘦素在活体小鼠椎间盘退变中的可能作用。
1 材料与方法
1.1 标本及其处理
雄性6 月龄野生型小鼠(C57BL 小鼠)及ob/ob小鼠(瘦素缺乏小鼠)各12 只(6 只做组织学测定,6只做分子生物学测量),购自上海斯莱克动物中心。过量麻醉处死,分离腰椎(椎体及其椎间盘)。一部分立即放入多聚甲醛固定液中固定24 h,无菌蒸馏水冲洗后放入EDTA 中脱钙2 周,经不同梯度乙醇脱水,二甲苯透明,石蜡包埋,5 μm 连续切片,以备HE 染色和免疫组化检测用。另一部分标本在显微镜下分离椎间盘后放入研钵中的Trizol 中并快速液氮冷冻、充分研磨,放置-80℃冰箱中以备RNA 提取。
1.2 方法
切片光镜观察HE 常规染色。
免疫组织化学染色 组织切片60℃烤箱过夜,然后脱蜡、不同梯度乙醇脱水、PBS 漂洗3 次后采用本研究组先前报道的方法[5]进行免疫组化染色。具体方法为加入95℃、10 mmol/L 柠檬酸盐缓冲液(pH=6)内抗原修复10 min,室温冷却。1% H2O2室温下处理15 min 消除内源性过氧化物活性,室温下5%正常山羊血清孵育30 min 以减少非特异性着色。在4℃用Ⅱ型胶原、Ⅹ型胶原、蛋白聚糖(Abcom公司)兔多克隆抗体孵化12 h,彻底清洗(PBS 洗3 次,每次5 min)。加聚合物增强剂,常温下孵育20 min,彻底清洗。加对应的生物素化的羊抗鼠的IgG 聚合物,室温孵育30 min。彻底清洗。滴加ABC 复合物室温30 min,彻底清洗。DABH2O2显色,而后蒸馏水洗净,Gill 苏木精复染逐级脱水和透明后封片、镜检。切片用Olympus BX50 图片分析系统观察。
Realtime PCR 实验方法按课题组先前报道的方法[6]。具体方法为冷冻于-80℃Trizol 中的标本经充分研磨后按说明书进行RNA 提取;使用TaKa-Ra PrimescriptTM RT Reagent Kit (TaKaRa Japan)试剂盒配成10 μL 反应体系,按说明书提示进行逆转录合成cDNA ;Real-time PCR 引物设计经Genebank数据库检索Ⅱ型胶原、Ⅹ型胶原、蛋白聚糖基因基本信息,采用Oligo 4.0 软件设计,由上海皓嘉生物公司合成目的基因及内参基因(见表1)。Real-time PCR 反应采用SYBR Premix Ex Taq(Takara)试剂盒,按试剂盒说明书进行扩增,相关系数≥0.98。资料分析用RotorGene 6.0 分析软件。
1.3 统计学处理
采用SPSS 16.0 统计学软件处理,数据采用独立样本t 检验,P<0.05 表示差异有统计学意义。
2 结 果
2.1 形态学观察
显微镜检查野生型小鼠的L4/L5椎间盘及其毗邻的上下终板显示纤维环、终板及髓核结构相对完整、有序;ob/ob小鼠的椎间盘结构出现紊乱,椎间盘高度降低,纤维环的外围出现龟裂,局部甚至出现骨赘,失去了完整的椎间盘的环状结构(见图1)。
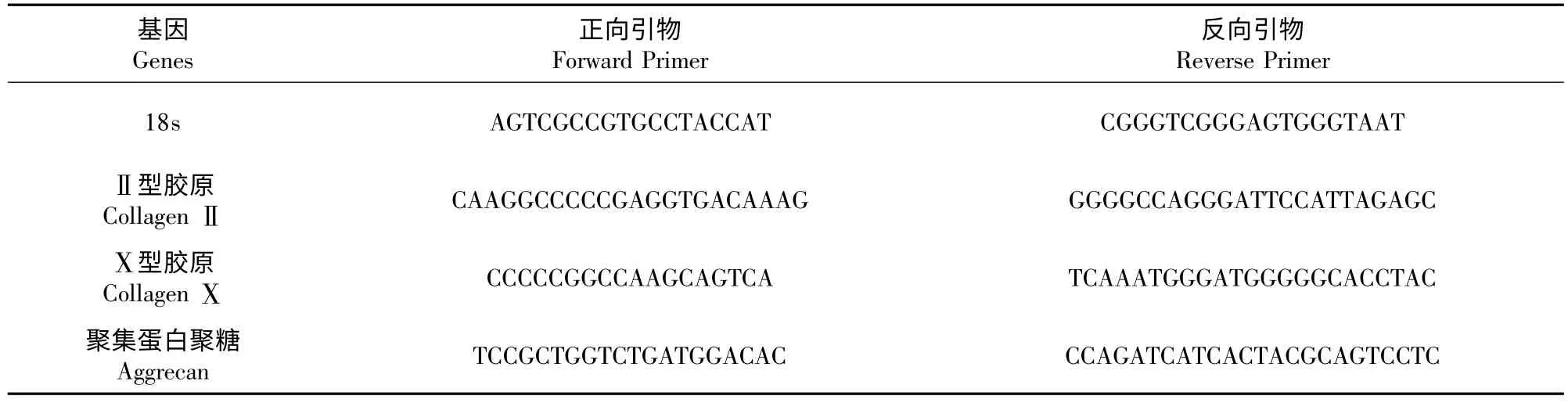
表1 Ⅱ型胶原、Ⅹ型胶原、蛋白聚糖引物序列Tab.1 Primer sequences of collagen Ⅱ,collagen Ⅹand aggrecan in Real-time PCR
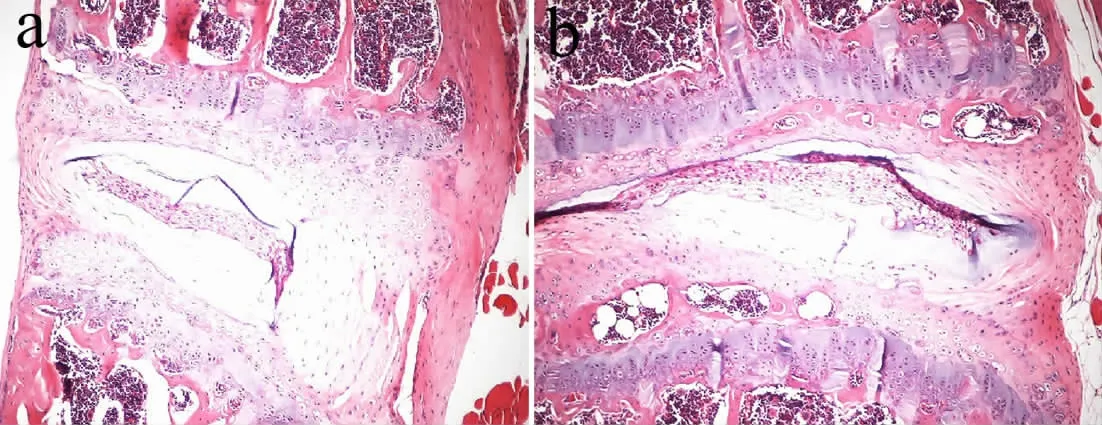
图1 组织学分析Fig.1 Histologic findings
2.2 免疫组化观察
免疫组化检验显示野生型小鼠的Ⅱ型胶原表达相对强烈,包括椎间盘纤维环的全层甚至髓核;而ob/ob 小鼠Ⅱ型胶原染色明显减弱。蛋白聚糖免疫组化检验显示野生型小鼠的椎间盘上下终板染色明显强烈,而ob/ob 小鼠椎间盘终板无论在钙化区还是非钙化区蛋白聚糖免疫着色都相对减弱(见图2)。
2.3 Real-time PCR 检测结果
Real-time PCR 检测发现,相对于野生型小鼠,ob/ob 小鼠Ⅱ型胶原的mRNA 表达明显下调,两者间比较差异有统计学意义(P<0.05);ob/ob 小鼠蛋白聚糖的mRNA 表达量明显下调,两者间比较差异有统计学意义(P<0.05);ob/ob 小鼠椎间盘Ⅹ型胶原mRNA 的表达量明显上调,两者间比较差异有统计学意义(P<0.01,见图3)。
3 讨 论
本研究的目的是评估瘦素对活体小鼠腰椎椎间盘退变的影响。研究结果提供的形态学、免疫组织化学及分子生物学的直接证据表明与野生型小鼠相比,ob/ob 小鼠椎间盘明显退变,体内瘦素缺乏可能加速小鼠椎间盘的退变。

图2 免疫组化分析Fig.2 Immunostaining results
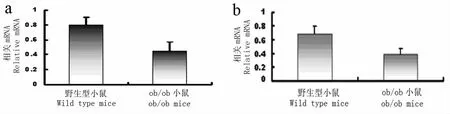
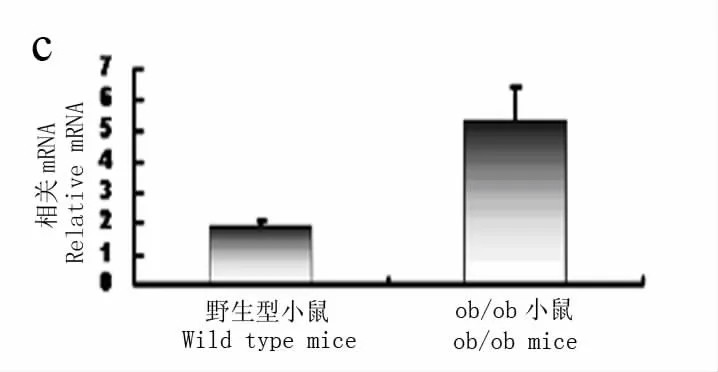
图3 Real-time PCR 检测Fig.3 Real-time PCR
实验中的ob/ob小鼠是野生型小鼠的基因突变小鼠,两者的区别仅仅是前者基因突变导致瘦素缺乏,而无其他差异。尽管ob/ob 小鼠体重较大,但Griffin 等[7]发现瘦素缺乏型小鼠尽管体重是正常小鼠的近3 倍,然而其骨关节炎发生率并未增加,此研究表明单纯体重增加并不能增加关节软骨退变。对小鼠膝关节(负重关节)如此,对于椎间盘这种非负重关节,体重增加更不会对比较结果产生影响。6月龄小鼠处于中壮年时期,因此选择对比观察6 月龄野生型小鼠与ob/ob 小鼠的椎间盘退变的差异可以明确瘦素对小鼠椎间盘退变产生的可能影响。
众所周知,椎间盘组织由细胞、细胞外基质和水组成。而细胞外基质主要由抵抗张力的胶原和抵抗压力的蛋白多糖共同组成。腰椎椎间盘退变的病理生理基础是椎间盘细胞基质合成和分解代谢的失衡。Cs-Szabo 等[8]发现,椎间盘退变时,蛋白多糖及Ⅱ型胶原的基因表达均下调。本实验形态学观察显示野生型小鼠椎间盘尽管局部产生龟裂,但其纤维环、终板及髓核结构相对完整、有序;ob/ob 小鼠的椎间盘结构出现紊乱,椎间盘高度降低,纤维环出现龟裂、局部甚至出现骨赘,失去了完整的椎间盘的环状结构。免疫组化及Real-time PCR 检测显示Ⅱ型胶原及蛋白多糖在椎间盘的退变中变化较为敏感,其含量对维持椎间盘的生物力学有重要影响[8-11]。免疫组化及Real-time PCR 检测显示,与野生型小鼠相比,ob/ob 小鼠的椎间盘Ⅱ型胶原、蛋白多糖的mRNA表达下调。从蛋白含量到基因表达都表明6月龄ob/ob 小鼠椎间盘退变明显。
本实验形态学检测中发现ob/ob 小鼠椎间盘局部甚至出现骨赘,于是继续检测了两者Ⅹ型胶原的基因表达变化,因为Ⅹ型胶原在软骨内成骨及基质钙化中起重要作用,而且它反映了退变终末期的开始[12-13]。实验中发现野生型小鼠Ⅹ型胶原稍有表达,而ob/ob 小鼠Ⅹ型胶原基因表达明显上调,提示6 月龄ob/ob 小鼠椎间盘局部骨化增加,而异常的局部骨化可能进一步影响小鼠椎间盘营养的供应,从而进一步加重椎间盘的退变。
本研究组发现人体椎间盘细胞表达瘦素及其受体,瘦素对体外培养的大鼠软骨细胞有增殖作用[5]。众所周知,成体生物细胞增殖的意义在于取代衰老死亡的细胞,维持个体细胞数量的相对平衡和机体的正常功能。机体的创伤愈合、组织再生、病理修复等都要依赖细胞增殖,所以生理状态下、可控的细胞增殖是有益的。资料显示软骨细胞移植是治疗椎间盘疾病的可选方式[14-15],这也证实了细胞增殖的有益性。Murad 等[16]认为瘦素是创伤愈合过程的自分泌或旁分泌调节物。Boos 等[17]也发现椎间盘细胞的增殖可以对局部龟裂的椎间盘起到创伤修复的作用。本组研究人员认为瘦素在活体小鼠椎间盘内可能有利于创伤修复,从而延缓椎间盘退变;因此瘦素可以被认作为防止椎间盘退变的潜在因素。
1994 年Zhang 等[18]发现并阐明ob 基因的蛋白产物瘦素的分子结构及生理作用后,关于瘦素的研究不断深入。Dumond 等[19]的研究证实瘦素在骨关节炎的病理生理中起重要作用,瘦素应用后可刺激IGF-β 和TGF-β 2 种生长因子的表达。近日Griffin等[7]发现瘦素缺乏型小鼠尽管体重是正常小鼠的近3 倍,然而其骨关节炎发生率并未增加。以上文献表明瘦素在四肢关节中可能加速了关节软骨的退变。而Hamrick 等[20]研究表明瘦素缺乏在中轴骨及四肢骨、皮质骨和小梁骨产生的效应是不同的,瘦素缺乏在中轴骨可使椎体长度增加、皮质增厚、密度增高、小梁骨容量增大。本实验亦显示瘦素缺乏加速了椎间盘软骨的退变。对于瘦素在四肢关节及中轴关节软骨的影响不同,考虑原因可能是椎间盘和关节软骨的营养来源不同。关节软骨营养主要来自正常滑液及软骨内缘和最深层的邻近的血管;椎间盘的营养供应则主要依靠穿过软骨下板、呈血管袢样终止于终板骨软骨界面的毛细血管网。
椎体骺板是位于椎体上下两端的软骨终板,随着骨骼发育成熟,骺板逐渐退化为透明软骨板,并通过钙化的软骨和椎体骨质接合,是椎间盘营养供应的主要途径,与椎间盘源性疾病密切相关[21]。在腰椎椎间盘退变的诸多危险因素中,营养障碍等后天因素对椎间盘退变的发病起着非常重要的作用[22]。近期Rutges 等[23]研究发现软骨下骨在椎间盘退变之前已出现明显退变。可见前者退变致后者营养因素变化而加速后者退变。因此本研究认为瘦素可能同时因影响椎体骨质代谢,从而进一步影响椎间盘的代谢,这也是本课题组进一步研究的方向。
[1]Hadjipavlou AG,Tzermiadianos MN,Bogduk N,et al.The pathophysiology of disc degeneration:a critical review[J].J Bone Joint Surg Br,2008,90(10):1261-1270.
[2]丁文元,李宝俊,海涌,等.前炎症因子在脊髓型颈椎病发病早期的表达[J].脊柱外科杂志,2006,4(4):219-222.
[3]翁习生,沈建中,邱贵兴,等.退变腰椎间盘组织中碱性成纤维细胞生长因子的表达研究[J].中华骨科杂志,2002,22(1):7-10.
[4]Gruber HE,Ingram JA,Hoelscher GL,et al.Leptin expression by annulus cells in the human intervertebral disc[J].Spine J ,2007,7(4):437-443.
[5]Zhao CQ,Liu D,Li H,et al.Expression of leptin and its functional receptor on disc cells:contribution to cell proliferation[J].Spine (Phila Pa 1976),2008,33(23):E858-E864.
[6]Li H,Jiang LS,Dai LY.High glucose potentiates collagen synthesis and bone morphogenetic protein-2-induced early osteoblast gene expression in rat spinal ligament cells[J].Endocrinology,2010,151(1):63-74.
[7]Griffin TM,Huebner JL,Kraus VB,et al.Extreme obesity due to impaired leptin signaling in mice does not cause knee osteoarthritis[J].Arthritis Rheum,2009,60(10)2935-2944.
[8]Cs-Szabo G,Ragasa-San Juan D,et al.Changes in mRNA and protein levels of proteoglycans of the anulus fibrosus and nucleus pulposus during intervertebral disc degeneration[J].Spine(Phila Pa 1976),2002,27(20):2212-2219.
[9]Oegema TR Jr.The role of disc cell heterogeneity in determining disc biochemistry:a speculation[J].Biochem Soc Trans,2002,30(Pt 6):839-844.
[10]Sive JI,Baird P,Jeziorsk M,et al.Expression of chondrocyte markers by cells of normal and degenerate intervertebral discs[J].Mol Pathol,2002,55(2):91-97.
[11]Roughley PJ,Alini M,Antoniou J.The role of proteoglycans in aging,degeneration and repair of the intervertebral disc[J].Biochem Soc Trans,2002,30(Pt 6):869-874.
[12]Grant ME.From collagen chemistry towards cell therapy-a personal journey[J].Int J Exp Pathol,2007,88(4):203-214.
[13]Xi YM,Hu YG,Lü ZH,et al.Gene expression of collagen types IX and X in the lumbar disc[J].Chin J Traumatol,2004,7(2):76-80.
[14]Meisel HJ,Ganey T,Hutton WC,et al.Clinical experience in cell-based therapeutics:intervention and outcome[J].Eur Spine J,2006,15(Suppl 3):S397-405.
[15]Meisel HJ,Siodla V,Ganey T,et al.Clinical experience in cellbased therapeutics:disc chondrocyte transplantation A treatment for degenerated or damaged intervertebral disc[J].Biomol Eng,2007,24(1):5-21.
[16]Murad A,Nath AK,Cha ST,et al.Leptin is an autocrine/paracrine regulator of wound healing[J].FASEB J,2003,17(13):1895-1897.
[17]Boos N,Weissbach S,Rohrbach H,et al.Classification of agerelated changes in lumbar intervertebral discs[J].Spine (Phila Pa 1976),2002,27(23):2631-2644.
[18]Zhang Y,Pronenca R,Maffei M,et al.Positional cloning of mouse obese gene and its human homologue[J].Nature,1994,372(6505):425-432.
[19]Dumond H,Presle N,Terlain B,et al.Evidence for a key role of leptin in osteoarthritis[J].Arthritis Rheum,2003,48(11):3118-3129.
[20]Hamrick M W,Penning C,Newton D,et al.Leptin deficiency produces contrasting phenotypes in bones of the limb and spine[J].Bone,2004,34(3):376-383.
[21]Freemont AJ.The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain[J].Rheumatology(Oxford),2009,48(1):5-10.
[22]Battié MC,Videman T,Lev¨alahti E,et al.Genetic and environmental effects on disc degeneration by phenotype and spinal level:a multivariate twin study[J].Spine(Phila Pa 1976),2008,33(25):2801-2808.
[23]Rutges JP,Jagt van der OP,Oner FC,et al.Micro-CT quantification of subchondral endplate changes in intervertebral disc degeneration[J].Osteoarthritis Cartilage,2011,19(1):89-95.
