雷公藤内酯醇对Aβ1-42激活的小胶质细胞一氧化氮释放和诱导型一氧化氮合酶表达的影响
2012-06-12王会玲周晓春马春虎王晓民
王会玲 周晓春 马春虎 王 冰 王晓民
(1.承德医学院生理教研室,河北承德 067000;2.承德医学院附属医院,河北承德 067000;3.首都医科大学,北京 100069)
AD是一种多发于中老年期的中枢神经系统退变性疾病,β-淀粉样蛋白(β-amyloid peptide,Aβ)沉积激活胶质细胞引发的脑内炎性反应,在AD的发生发展中扮演着重要角色,而抑制胶质细胞活化的药物具有神经保护作用。雷公藤在我国已有上千年的药用历史,其抗炎免疫有效组分雷公藤多甙在治疗类风湿性关节炎、系统性红斑狼疮等炎性、变态性、自身免疫性疾病等方面已取得肯定效果[1]。雷公藤内酯醇(triptolide,T10)是从雷公藤中提取的小分子单体活性成分,其主要药理活性为抗炎和免疫抑制。通常,小胶质细胞维持神经系统的正常功能,但其过度激活可导致或加重神经元损伤,从而参与多种神经系统退行性疾病的发生、发展过程。近年来,研究[2]显示,小胶质细胞的异常激活可产生大量细胞因子及活性氧产物,从而在AD的发生发展中起着重要的作用。本研究通过观察T10对AD细胞模型中小胶质细胞iNOS蛋白的表达及NO释放的影响,以期阐明小胶质细胞的激活在AD病变中的作用,并希望为AD的天然药物治疗提供一定的实验依据。
1 材料与方法
1.1 材料
1)药物与试剂:雷公藤内酯醇(T10)由北京大学药学院屠鹏飞教授提供。Griess试剂为瑞典Fluka公司产品,抗iNOS抗体购自美国Sigma公司,BCA蛋白定量试剂盒、ECL化学发光试剂盒为美国Pierce公司产品,Aβ1-42由美国多肽公司生产。
2)主要仪器:超净工作台(北京半导体设备厂)、恒温摇床(德国HEIDOLPH)、超低温冰箱(德国NUAIR)、CO2孵箱(SANYO)、酶标仪(美国 BIO-RAD)。
1.2 方法
1)小胶质细胞培养:SD乳鼠在出生24 h之内断头取脑,剥离软脑膜和血管,用Pasteur滴管轻轻吹打至组织块完全消散,离心5 min(1 000 r/min),按每瓶1.5只脑(10 mL)的密度将细胞悬液接种到Poly-D-lysine处理过的75 cm2细胞培养瓶中,置于37℃,5%CO2孵箱中培养,24 h后更换含血清培养基,以后每3 d半量换液1次。细胞培养到第14天时,将细胞培养瓶置于37℃恒温摇床,180 r/min震摇2 h,取上清液,离心10 min(1 000 r/min),细胞用含血清培养基重悬,调整细胞密度至5×105/mL。将细胞接种于Poly-D-lysine处理过的孔板或培养皿中,稳定24 h后用于试验。
2)细胞存活率测定:将小胶质细胞接种于96孔板,接种密度为(5×105/mL),每孔接种体积为200 μL。细胞稳定24~72 h后加入药物处理,药物处理至相应时间后,移去培养液,加入0.5 g/L MTT溶液,100 μL/孔,孵育4 ~6 h;加入助溶剂100 μL/孔,孵育 6 h,用酶标仪检测蓝色甲瓒的生成量,检测波长为570 nm。
3)细胞上清NO的测定:依据Griess反应,测定波长为540 nm,参照试剂盒说明书进行。
4)细胞iNOS蛋白表达的测定:细胞以5×105/孔接种于6孔板,给予相应处理后弃去培养液,裂解细胞,收集上清,BCA法测定蛋白浓度。取等量蛋白,7.5%SDS-PAGE分离后将蛋白转至硝酸纤维素膜上,用含5%脱脂牛奶的TBST溶液封闭膜2 h,抗iNOS(1:500)抗体4℃孵育过夜,TBST充分洗涤膜后用二抗(羊抗鼠IgG/HRP,1:1 000)室温孵育1 h,ECL试剂显色,实验重复3次,结果用凝胶图像分析仪拍摄照片后,软件分析蛋白质条带的灰度值,计算目的条带与内参条带(β-actin)的比值。
1.3 统计学方法
统计分析采用Prism4.0版软件进行,多组计量数据间均数比较用单因素方差分析(ANOVAs)和Newman-Keuls检验,以P<0.05为差异有统计学意义。
2 结果
2.1 T10对Aβ1-42激活小胶质细胞的影响
2.2.1 T10对小胶质细胞存活率的影响
不同浓度的T10分别与小胶质细胞共孵育24 h,MTT法检测细胞存活率,其结果如图1。由图可知,10-11~10-8mol/L T10对小胶质细胞均未见明显的毒性作用,而10-7mol/L T10会使小胶质细胞存活率明显下降(P<0.05)。
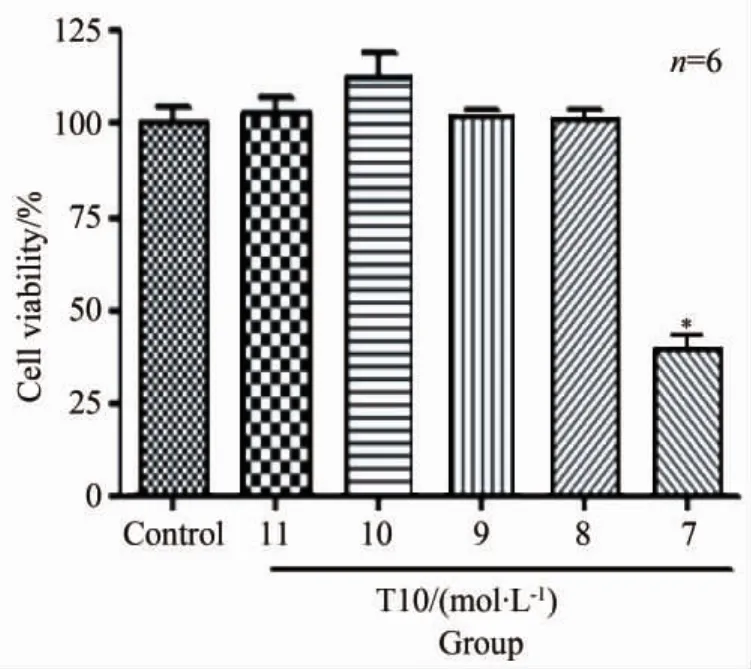
图1 T10对小胶质细胞存活率的影响Fig.1 Effects of T10 on survival rate of microglia*P <0.05 vs control group;T10:triptolide.
2.2.2 T10对Aβ1-42刺激小胶质细胞释放NO的影响
用不同浓度的T10预处理小胶质细胞12 h,然后加入10 μmol/L Aβ1-42共孵育12 h,收集细胞培养上清液,Griess反应检测NO的含量。结果显示:10 μmol/L Aβ1-42可使小胶质细胞释放NO明显增加(P<0.01),而10-11~ 10-8mol/L 的 T10 均可抑制 10 μmol/L Aβ1-42所诱导小胶质细胞 NO的释放(P<0.01)(图2)。
2.2.3 T10对 Aβ1-42刺激小胶质细胞 iNOS表达的影响
Western blotting的实验结果显示,Aβ组iNOS条带比对照组明显增粗,Aβ1-42可诱导小胶质细胞表达iNOS明显增加(P<0.01),10-11~10-8mol/L的 T10可抑制Aβ1-42诱导的小胶质细胞iNOS表达增加(P<0.05)(图3)。

图2 T10对Aβ1-42刺激小胶质细胞释放NO的影响Fig.2 Effects of T10 on Aβ1-42induced release of NO from microglia
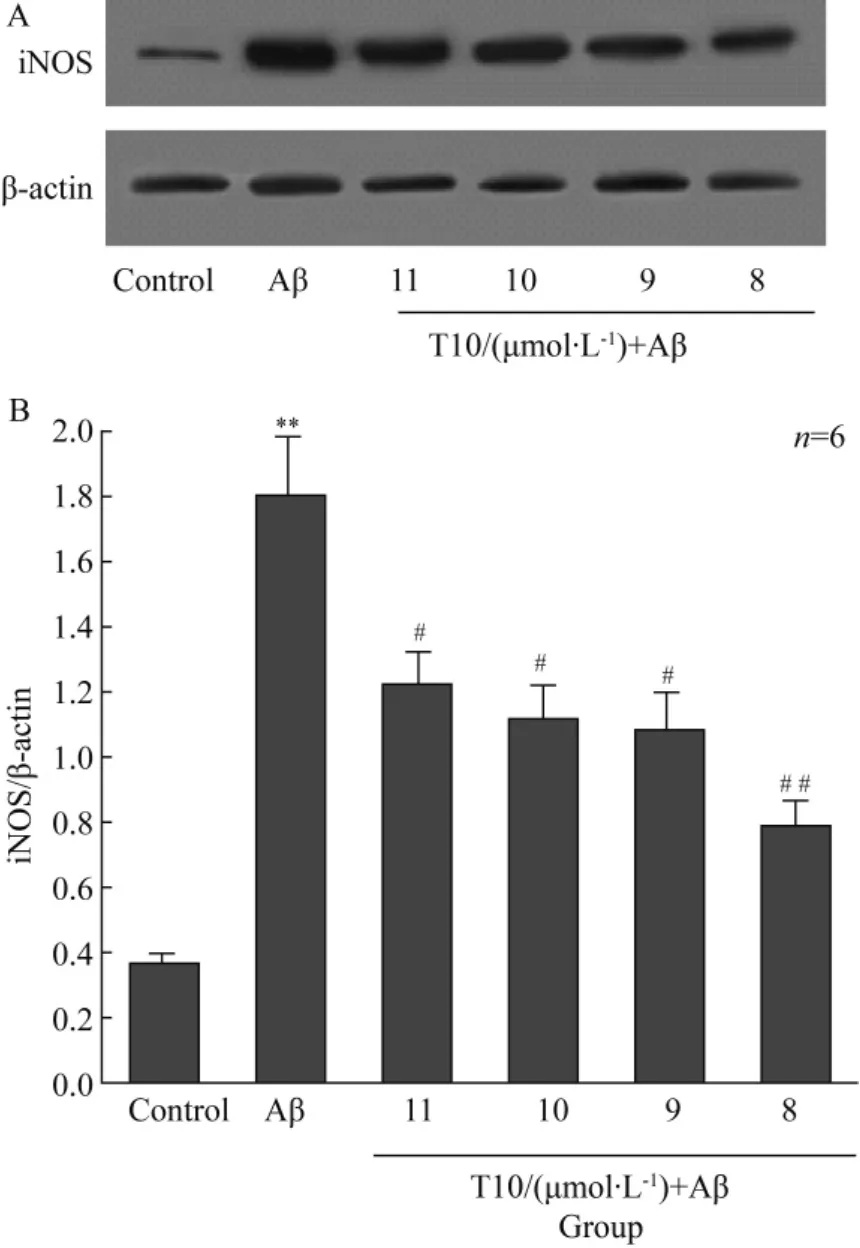
图3 T10对Aβ1-42刺激小胶质细胞iNOS表达的影响Fig.3 Effects of T10 on Aβ1-42induced expression of iNOS from microglia
3 讨论
Aβ沉积引起的脑内炎性反应是AD最重要的致病原因之一。栖居于脑内的免疫细胞,特别是小胶质细胞在脑内炎性反应过程中发挥了关键作用[2],激活的小胶质细胞产生多种细胞因子和神经毒性物质,从而损害神经元。退变死亡的神经元碎片及有毒物质反过来又刺激其他胶质细胞释放神经毒性物质和炎性细胞因子。这样在脑内就形成一个不断增强的自身毒性环路,使炎性反应不断加强,最终导致患者出现痴呆症状。
NO[3]具有双重活性:一方面作为特殊神经递质参与突触可塑、神经元发育、学习记忆和行为等众多生理机制;另一方面,过量的NO可通过氧化应激、破坏能量代谢过程中的多种酶类减少ATP生成、损伤膜性结构、蛋白质及DNA,导致神经元坏死或凋亡等从而损伤神经系统。目前普遍认为,由于NO释放过量,它在AD中的神经毒性作用已远远超过其保护作用。
NO作为氧自由基的一种,大量的证据[4-6]表明它的神经毒性在神经系统退行性疾病中起重要的作用。NO可刺激 NMDA受体(一种兴奋性氨基酸受体)产生谷氨酸,直接杀伤培养的人类胚胎皮质神经元,并能使少突胶质细胞溶解;高浓度的NO还可透过细胞膜、线粒体膜,修饰某些蛋白质的巯基、血红素辅基及铁硫中心,从而抑制线粒体呼吸链各种复合体的活力;NO与超氧阴离子 (O-2)发生快速反应,生成强氧化性的过氧化亚硝基 (peroxynitrite,ONOO-),而引起蛋白质、类脂质及DNA氧化,或分解转化为OH-自由基,对细胞造成不可逆的氧化损伤[7-8]。
iNOS是一种诱导酶,正常无表达,但在病理条件下可不依赖Ca2+/CaM表达。iNOS一旦表达其活性便可持续相当长时间,从而大量、持续产生NO,介导广泛的毒性作用。本研究证实:在Aβ1-42作用下NO的释放明显增加,与iNOS的表达增加相对应。
T10是我国传统中药雷公藤的主要药理活性成分之一。本研究室前期研究[9-11]发现,T10在 PD炎性反应模型上具有明确的抗炎作用,能够抑制LPS引起的小胶质细胞激活及炎性因子的释放,从而改善PD模型大鼠的旋转行为。为探讨T10在Aβ1-42激活胶质细胞的AD炎性反应模型上是否同样具有抗炎活性,我们选用不同浓度T10预孵育小胶质细胞12 h,然后加入 10 μmol/L Aβ1-42共同作用 12 h,检测了细胞上清中NO的含量及小胶质细胞iNOS的表达。结果发现:T10可明显拮抗Aβ1-42诱导的小胶质细胞NO的释放及iNOS的表达。
在此基础上,我们还想进一步探索以下问题:①T10抗炎作用的具体机制。iNOS的表达受NF-κB的转录调控,T10拮抗Aβ1-42引起小胶质细胞激活的分子机制是否与抑制NF-κB的活性有关?②T10除了通过抑制小胶质细胞活化而保护神经元外,是否可促进神经元或胶质细胞分泌神经营养因子来发挥其神经保护作用?
[1]Tao X,Ma L,Mao Y,et al.Suppression of carrageenaninduced inflammationin vivoby an extract of the Chinese herbal remedy tripterygium wilfordii Hook F[J].Inflamm Res,1999,48(3):139-148.
[2]Liu B,Hong J S.Role of microglia in inflammation-mediated neurodegenerative diseases:mechanisms and strategies for therapeutic intervention[J].J Pharmacol Exp Ther,2003,304(1):1-7.
[3]Munoz Femandez M A,Fresn M.The role of tumour necrosis factor,interleukin 6,interferon γ and inducible nitric oxide synthase in the development and pathology of the nervous system[J].Prog Neurobiol,1998,56(3):307-340.
[4]Wong A,Luth H J,Deut her Conrad W,et al.Advanced glycation end products co-localize with inducible nitric oxide synthase in Alzheimer's disease[J].Brain Res,2001,920(1-2):32-40.
[5]Golde S,Chandran S,Brown G C,et al.Different path ways for iNOS mediated toxicityin vitrodependent on neuronal maturation and NMDA receptor expression[J].J Neurochem,2002,82(2):269-282.
[6]Merrill J E,Ignarro L J,Sherman M P,et al.Microglial cell cytotoxicity of oligodendrocytes is mediated through nitric oxide[J].J Immunol,1993,151(4):2132-2141.
[7]Guzy R D,Schum acker P T.Oxygen sensing by mitochondria at complexⅢ:the paradox of increased reactive oxygen species during hypoxia[J].Exp Physiol,2006,91(5):807-819.
[8]Wei T,Chen C,Zhao B,et al.EPC-K1 attenuates peroxynitrite-induced apoptosis in cerebellar granule cells[J].Biochem Mol Biol Int,1998,46(1):89-97.
[9]Zhou H F,Niu D B,Xue B,et al.Triptolide inhibits TNF-alpha,IL-1 beta and NO production in primary microglial cultures[J].Neuroreport,2003,14(7):1091- 1095.
[10]Zhou H F,Liu X Y,Niu D B,et al.Triptolide protects dopaminergic neurons from inflammation-mediated damage induced by lipopolysaccharide intranigral injection[J].Neurobiol Dis,2005,18(3):441-449.
[11]崔艳秋,陆莉,王晓民.雷公藤内酯醇及其衍生物的神经保护作用及机制[J].首都医科大学学报,2011,32(6):859-864.
