恶性脑胶质瘤同步放化疗中替莫唑胺化疗的不良反应及对策
2012-06-12谢铮铮赵艳杰李文斌
康 勋 李 珊 谢铮铮 赵艳杰 姜 妮 周 蕾 李文斌*
(1.首都医科大学附属北京世纪坛医院肿瘤科,北京 100038;2.首都医科大学附属世纪坛医院药剂科,北京 100038)
脑胶质瘤在颅内各种肿瘤中最为多见,且预后较差,具有高复发率和高病死率的特点[1]。因其血管丰富且具有高度的侵袭性,即使医师在显微镜下操作也难以做到全部切除[2]。特别是胶质母细胞瘤(glioblastoma,GBM),术后患者的两年生存率只有27.2%,中位生存时间为14.6个月[3]。目前国内外对术后恶性胶质瘤多采用以替莫唑胺联合放射治疗为主的同步治疗。替莫唑胺(Temozolomide,TMZ),是一种新型咪唑四嗪类口服抗肿瘤药物[4]。TMZ的优点是口服吸收完全、生物利用度近乎100% 、组织分布好、易透过血脑脊液屏障,较好的安全性,与其他药物没有叠加毒性,可用于对亚硝基脲耐药的患者,正是由于以上优点,TMZ是目前治疗恶性脑胶质瘤的主要药物[3,5]。替莫唑胺不仅对脑胶质瘤有较好疗效,对白血病、黑色素瘤、淋巴瘤和实体瘤也有较好的疗效,目前临床主要应用于人脑胶质瘤的化学治疗[6]。
本文回顾性总结了首都医科大学附属北京世纪坛医院肿瘤科自2010年2月~2011年5月应用替莫唑胺联合放射治疗的95例患者化学治疗不良反应发生及治疗情况,以便了解该药的临床安全性,以期出现相关不良反应时能够给予合理的治疗策略,指导临床应用。现将其不良反应及防范措施报道如下。
1 资料与方法
1.1 一般资料
95例病例中,男性59例,女性36例,中位年龄为45岁(年龄处于13~75岁)。所有患者均为手术后经病理诊断,证实符合恶性神经后瘤,且按神经胶质瘤的WHO(1999)分级标准评为Ⅲ~Ⅳ级的恶性胶质瘤患者,其中间变性星形细胞瘤30例,间变少枝细胞瘤18例,间变少枝星形细胞瘤17例,大脑胶质瘤病3例,胶质母细胞瘤27例。术后均予以放射治疗联合替莫唑胺的同步治疗。入选患者一般状态良好,KPS(Karnofsky)评分60分以上,全身其他各系统无严重疾病存在,无严重术后肢体活动障碍、精神障碍存在,血、尿、便常规及其他生化指标基本正常。评价标准:不良反应评价根据2009年美国卫生与公共服务部制定的药物常见不良事件评价标准第四版(CTCAE-V4.0)。
1.2 治疗方法
采用钴60伽马射线外照射联合替莫唑胺胶囊(美国先灵葆雅公司或天津天士力公司)。放射治疗采用精确调强技术或三维适行技术,依患者及家属选择。放射治疗剂量为2 Gy/d,5 d/week,共持续6周,总剂量60 Gy。替莫唑胺实际剂量为75 mg/m2·d-1,持续6周。替莫唑胺给药方式为:放射治疗前1 h左右,口服,同时给予小剂量激素及第一代5-HT3拮抗剂预防性治疗,给药时间为替莫唑胺服用前半小时。并长期给予患者口服保肝、升血药物辅助治疗。小剂量激素的具体使用方法为同步放射治疗化学治疗第一天始给予醋酸地塞米松片3片,每片0.75mg,口服,每日一次,服用时间为放射治疗前1 h,以后每日递减半片,直至最后一次用药量为半片,停药。第一代5-HT3拮抗剂常选用昂丹司琼片,口服时间与激素同时,剂量为1片,每片剂量为4mg,本药的用药时间与剂量根据患者反应情况酌情增减。保肝、升血药物长期口服,剂量及使用方法随所选药物本身。治疗过程中,密切观察患者临床表现,每周复查患者血、尿、便常规,隔周复查患者主要生化物学指标。根据患者所出现的不良反应程度给予相应的对症处理。若不良反应较为严重,且对症治疗无明显效果,给予减量或者停药处理。

表1 患者一般特征Tab.1 Patient characteristics
2 结果
本组患者中,出现的不良反应涉及胃肠道、血液系统、皮肤黏膜及心血管系统,详情如下。
2.1 胃肠道反应
1)不良反应:给予替莫唑胺治疗的患者,胃肠道不良反应主要表现为恶心、呕吐、反酸、食欲不振,多由药物对胃肠道黏膜的直接损伤或损伤后相关化学递质释放所引起。由于第一代5-HT3拮抗剂的预先应用,本组95例患者中有只有20例患者出现胃肠道不良反应,发生率为21.0%,根据 CTCAE-V4.0,本组患者胃肠道不良事件评级为1级的有12例,2级的有8例;无3、4、5级的严重不良事件发生。患者出现胃肠道反应开始于治疗后2~5 d出现,中位时间为3 d。
2)处理方法及效果:①增加服药后活动量,调整饮食结构;②变更替莫唑胺胶囊的给药时间,由放射治疗前改为睡前口服;③加用5-HT3拮抗剂的给药剂量或变更为其他一代5-HT3拮抗剂类药物;经过非药物处理后,8例患者症状得到缓解。未能缓解的12例患者中,经过追加5-HT3拮抗剂的剂量或变更药物后10例患者症状完全缓解,2例缓解明显,不影响正常饮食、睡眠。经过止吐治疗的患者中,多有便秘症状的出现,给予饮食调整,部分患者症状缓解,不能缓解者给予中药缓泻剂治疗,效果较好。
2.2 对造血系统的影响
1)不良反应:本组患者中,由于预先升血药物的应用,发生中性粒细胞减少的共计9例,根据CTCAEV4.0标准,评价为1级的共6例,评价为2级的共3例,无3、4、5级不良反应发生;发生血小板减少者共4例,根据CTCAE-V4.0标准,评价为1级的有3例,评价为2级的1例,无3、4、5级不良反应发生。总体发生率为:13.7%。
2)对中性粒细胞减少的处理方法及效果:①当患者血常规检查出现白细胞Ⅰ度减少,暂予观察处理,并间断复查血常规,期间坚持口服升血药物;②若患者白细胞出现Ⅱ度减少但白细胞总数高于2.5×109/L、中性粒细胞绝对值大于1.6×109/L,可将药物剂量减半,并坚持口服升血药,间断复查血常规;③经过上述处理后患者白细胞仍进一步减低,暂停替莫唑胺胶囊,选用颗粒细胞集落刺激因子(granulocyte colorry-stimulating-factor,G-CSF)皮下注射,每日1次,用药3~5 d。经过上述处理后所有白细胞减少患者骨髓抑制完全缓解,完成整个疗程的治疗。
3)对血小板减少的处理及效果:4例血小板减少者3例为1级,1例为2级。处理办法为:①当患者出现1级减少时,给予花生衣1 g,泡水口服,并继续口服化疗,间断复查血常规,若血小板维持稳定或上升,继续治疗至血小板正常;②经上述治疗方法患者血小板仍继续下降,减少替莫唑胺剂量至原剂量一半,定期复查血小板待回复至正常加用替莫唑胺至原剂量;③当患者减药后仍不能回升,停药并给予重组血小板生成素皮下注射;④当患者血小板进一步出现4级减少或者出现出血现象时,立即停药并给予输注血小板治疗。本组观察所有4例血小板减少患者,3例出现1级血小板减少,给予口服花生衣处理后缓解,1例出现2级血小板减少,给予减药量并持续口服花生衣,患者完成治疗。未出现3、4级血小板减少。
2.3 对皮肤黏膜的影响
1)不良反应:患者主要表现为脱发,局部或者全身皮疹、斑丘疹。因脑胶质瘤患者术后常规用口服抗癫痫药,部分抗癫痫药引起的皮疹现象较为常见,加之放射治疗以及部分患者局部皮肤卫生状况较差,皮疹发生相较于替莫唑胺引起者为多。在本组患者中,发生脱发者53例,发生率为55.9%。根据CTCAEV4.0,评级为1级的有41例,2级有12例。发生皮疹、斑丘疹共7例,根据CTCAE-V4.0评价为1级的为6例,2级的为1例,无3、4级出现。6例表现为局部丘疹,色红,指压不退色,伴有皮肤瘙痒不适,无破溃、渗出表现;1例出现全身皮疹症状,皮疹累及颈、胸、背部,表现如局部征象。
2)治疗策略及效果:由于放射治疗化学治疗结束后患者多能生新发,因此脱发患者未予特殊处理。对皮疹患者的处理:给予7例患者局部清洁并醋酸氟轻松软膏治疗后症状完全缓解,局部皮肤无色素沉着。上诉发生皮肤不良事件的患者均完成同步放射治疗化学治疗。
2.4 对心血管系统的影响
1)本组治疗患者中有1例发生心悸症状,且检索联合替莫唑胺的同步放射治疗化学治疗相关文献未见有此不良反应报道。根据CTCAE-V4.0评价为2级。患者既往无心血管系统相关病史可查,术后至放射治疗前患者血压、心率、心电图未见明显异常,肿瘤发生部位为双额叶,未侵及脑干,无沿神经纤维束播散情况,无明显瘤周水肿带形成,患者病理类型为间变少枝胶质细胞瘤。心悸症状发生在治疗开始后第14天,渐进性出现心率增快,最快时136次/分,心电图表现为窦性心动过速,静息、睡眠时仍维持在110次/分左右。
2)给予停药并予美托洛尔25 mg,一日2次,治疗后3 d患者基础心率降至95~98次/分,11 d后基础心率降至78~87次/分。每日半片递减美托洛尔用量,之后患者未再发生心悸症状,完成同步治疗。
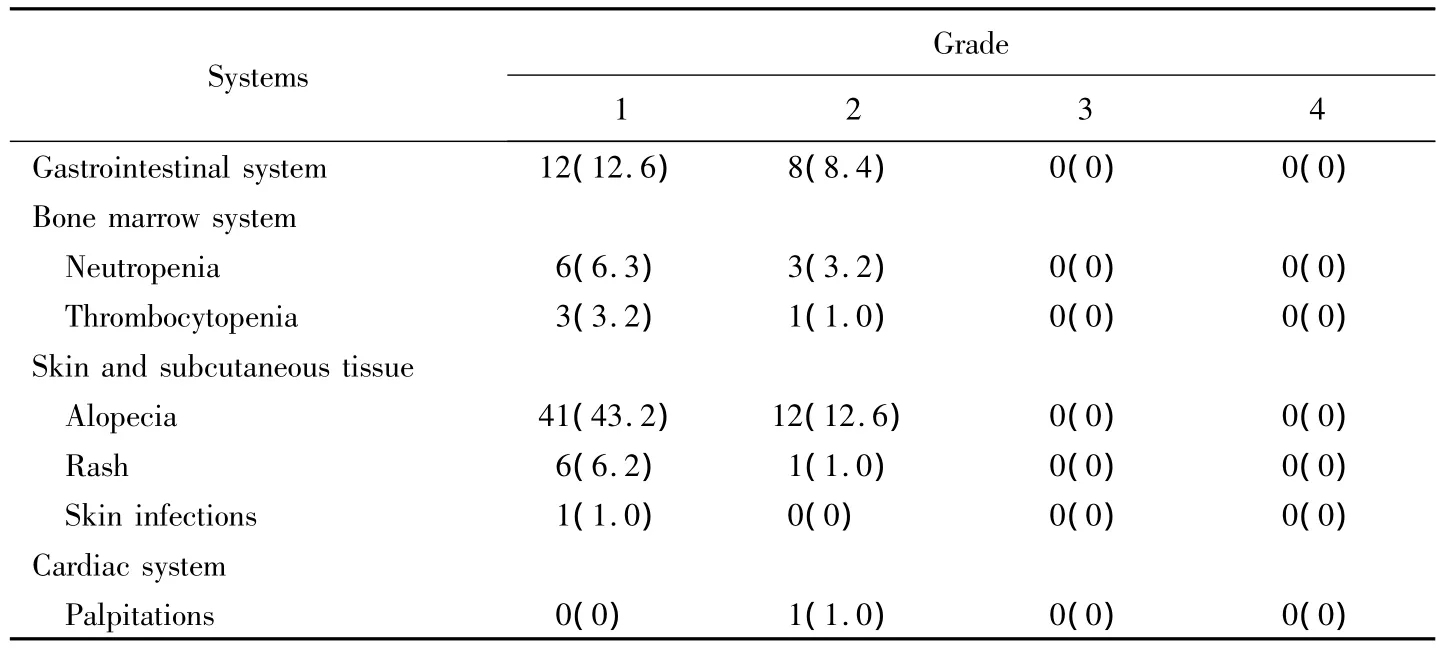
表2 患者出现不良反应的情况Tab.2 Number of patients with adverse events n(%)
3 讨论
化学疗法是恶性脑胶质瘤重要的辅助治疗方法,对延长患者生存时间有一定作用。Meta分析[2]证实辅助化疗可以延长大约10%的脑肿瘤患者的生存时间,因此成为胶质瘤治疗的重要方式之一。替莫唑胺易透过血脑屏障进人脑脊液,脑脊液及血浆药物浓度比例为 30% ~40%[3-4,7-8]。正是由于替莫唑胺的应用,胶质母细胞瘤的1年生存率由2000年的10%提高到2010年的27.2%[3-4]。口服替莫唑胺的同时与放射治疗联合应用可增加放射治疗敏感性,有效延长患者的生存时间[9]。当然在脑胶质瘤的同步放射治疗化学治疗中还有一些其他的化学治疗药物,卡莫司汀植入膜就是其中一种,临床中多有应用,并取得了很好的疗效,其中位生存时间为13.9个月。因其治疗效果接近替莫唑胺,是高级别神经胶质瘤治疗的一种可选药物[10]。尽管有着很好的治疗效果,但植入后会显著增加脑脊液漏、颅高压以及重度脑水肿的发生风险[11]。正因如此,该药的临床应用相对受限。
同步放射治疗化学治疗患者在治疗过程中,除替莫唑胺化疗引起的相关不良反应外,仍有放射治疗、辅助药物引起的不良反应。放射治疗相关的损伤按发生的早晚可分为以下几期:急性期、早迟发期和晚迟发期[12]。急性期的放射性损伤主要发生在照射后即刻到一月内,患者主要临床表现为头疼、恶心、呕吐,给予小剂量激素可以缓解;早迟发期是指患者照射后1~6个月,病理改变以脱髓鞘为主,临床表现为厌食、嗜睡、少动,给予适量的激素治疗后,一般在1~2个月症状可以完全消失;晚迟发期出现于照射后6个月,呈进行性,不可逆转,虽使用大剂量激素也不能完全缓解。同步放射治疗化学治疗患者的治疗周期一般为6周,因此与放射治疗损伤相关的鉴别主要是与急性期损伤和早迟发期损伤相鉴别,以胃肠系统不良反应鉴别为主。由于放射治疗期开始时小剂量激素的应用以及严格的不良反应判定标准,因此在与化疗相关不良反应的鉴别上并不十分困难。辅助药物应用在缓解替莫唑胺化疗不良反应的同时也会使患者产生辅助药物相关的不良反应。由于以上因素的存在,让作者在判定替莫唑胺相关合并症时并不能做到完全排除,可能存在部分假阳性现象。因此,在同步放射治疗化学治疗中完全由替莫唑胺所引起的不良反应会更少一些。
4 结论
替莫唑胺作为一种新型的烷化剂,是目前治疗脑胶质瘤的唯一口服制剂,具有服用方便、患者用药依从性高,生物利用度好、易透过血脑屏障,能增加放射治疗的敏感性,因此替莫唑胺是一个有效的抗脑胶质瘤药物。此外在同步放射治疗化学治疗中,替莫唑胺引起的化学治疗相关反应轻微,易于控制,患者治疗过程中生存质量好。综上所述,替莫唑胺是一个安全有效的脑胶质瘤化疗药物。
[1]Ducray F,Idbaih A,Wang X W,et al.Predictive and prognostic factors for gliomas[J].Expert Rev Anticancer T-her,2011,11(5):781-789.
[2]Stewart L A.Chemotherapy in adult high-grade glioma:a systematic review and meta-analysis of individual patient da-ta from 12 randomized trials[J].Lancet,2002,359(9311):1011-1018.
[3]Stupp R,Hegi M E,Mason W P,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomized phaseⅢstudy:5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10(5):459- 466.
[4]Villano J L,Seery T E,Bressler L R.Temozolomide in malignant glioma:current use and future targets[J].Cancer Chemother Pharmacol,2009,64:647-655.
[5]Stupp R,Mason W P,van den Bent M J,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352:987-996.
[6]孙燕.肿瘤内科治疗的发展、现状和未来展望[J].中国医院用药评价与分析,2007,7(1):4.
[7]曾宪起,申长虹,浦佩玉,等.替莫唑胺与司莫司丁对恶性脑胶质瘤的疗效对比观察[J].中国临床神经外科杂志,2006,11(6):333-335.
[8]赵彩霞,刘军.替莫唑胺治疗脑胶质瘤的临床应用进展[J].临床误诊误治,2009,22(3):70-73.
[9]Middlenton M R,Grob J J,Aaronson N,et al.Randomized phaseⅢstudy of Temozolomi-de versus dacarbazine in the treatment of patients with advanced metastacic malignant melanoma[J].Clin Oncol,2008,18(1):158.
[10]Lawson H C,Sampath P,Bohan E,et al.Interstitial chemotherapy for malignant gliomas:The Johns Hopkins experience[J].J Neurooncol,2007,83(1):61- 70.
[11]Weber E L,Goebel E A.Cerebral edema associated with Gliadel wafers:Two case studies[J].Neuro Oncol,2005,7(1):84-89.
[12]江涛,刘福生.脑胶质瘤[M].北京:人民卫生出版社,2006:217.
