日本脑炎病毒NS3基因截短表达及其在神经细胞定位研究
2012-06-08邓绪芳史子学魏建超邵东华王少辉李蓓蓓马志永
邓绪芳,史子学,魏建超,邵东华,王少辉,李蓓蓓,马志永
(中国农业科学院上海兽医研究所,上海200241)
日本脑炎又称流行性乙型脑炎,是由日本脑炎病毒(Japanese encephalitis virus,JEV)引起的一种严重损害中枢神经系统的人畜共患传染病,可引起人的致死性脑炎,重症患者康复后有严重的神经系统后遗症。该病主要流行于东南亚,在中国除青海和新疆外,其他省均有流行。自使用弱毒疫苗免疫预防后,中国该病的发病率显著降低,得到了很好的控制[1],但每年仍有一定数量的发病病例。据世界卫生组织(WHO)估计,目前全球每年报告的发病人数在5万例左右,其中约1/3的病例死亡,存活者20%~40%留有神经麻痹和心理改变等严重后遗症[2]。因此,开发治疗性的抗病毒的药物显得尤为重要[3]。
JEV基因组全长10 976个核苷酸,除5'端95个核苷酸和3'端585个核苷酸为非编码区外,其余10 296个核苷酸形成一个开放阅读框(open reading frame, ORF),编码一个3432个氨基酸的多蛋白前体,经过酶切形成3个结构蛋白(C、prM和E)和 7个非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b和NS5)[1]。NS3是黄病毒科中最保守的非结构蛋白,至少具有3种酶活性,参与了病毒蛋白的水解加工以及病毒的复制,是病毒复制的必需蛋白。NS3蛋白已成为研究抗该病毒药物的重要靶标分子[4]。在本研究中,我们克隆了NS3基因C端,在大肠杆菌中获得高效表达,并制备了抗NS3的多克隆抗体,利用该抗体观察了NS3在神经细胞中的亚细胞定位,为进一步研究JEV的致病机制提供有价值的数据。
1 材料与方法
1.1 材料 JEV为本研究室的猪源分离株(病毒滴度为4×108PFU/mL);大肠杆菌DH5α和BL21(DE3)、原核表达载体pET-28a(+)为本室保存;小鼠神经瘤母细胞系Neuro-2A(ATCC No.CCL-131)购自中国科学院细胞库;昆明系小鼠购于中科院上海实验动物中心;rTaq酶、AMV反转录酶、各种限制性内切酶、T4 DNA连接酶、TA克隆试剂盒均购自大连宝生物公司;质粒提取和DNA片段回收试剂盒购自天根生物技术公司;His-Band 蛋白质纯化试剂盒购自Novagen公司;HRP标记羊抗小鼠IgG二抗和FITC标记羊抗小鼠IgG二抗购自Santa Cruz公司;羊抗小鼠IgG Alexa Flour 594二抗购自Invitrogen公司;其他所需试剂和溶液参照《分子克隆实验指南》准备。
1.2 方法
1.2.1 NS3基因C端(NS3C)的克隆与原核表达 根据GenBank已发表的日本脑炎病毒全基因组序列(登录号:AF315119)设计NS3基因C端(955~1857 bp)特异性引物,上下游引物分别引入EcoR I和Sal I位点:上游5'-ATGGAAAATTTTCATGCC GCCTGGAACCACGG-3';下游5'- GCGGTTCCGGAACTTAT CTCTTCCCTGC TGCA-3'。
提取JEV感染Vero细胞total RNA,RT-PCR产物经琼脂糖电泳分离,试剂盒快速回收DNA片段。DNA片段经克隆测序验证后,构建重组表达载体pET-28a-NS3C,并转化BL(DE3)细菌,用IPTG诱导后,12%SDS-PAGE分析蛋白表达。
1.2.2 原核表达产物的纯化及动物免疫 将1.2.1中鉴定表达的重组阳性克隆菌扩大培养,裂解细菌提取包涵体,用His-Band Ni+柱进行亲和层析纯化。纯化的His-NS3C蛋白免疫昆明系小鼠(50~100μg/只)。初免用重组蛋白与完全弗氏佐剂(1:1),二次免疫用重组蛋白与不完全弗氏佐剂(1:1),以后直接免疫重组蛋白。连续免疫4次,间隔2周,末次免疫后7 d采血分离血清。
1.2.3 细胞感染病毒 Neuro-2A或Vero细胞用DMEM(含10%胎牛血清)培养。当细胞生长到50%~70%密度时感染病毒,37℃吸附90 min,用PBS轻柔漂洗2次,再加入维持培养液(含1%胎牛血清DMEM)。感染24 h后,收获细胞,进行Western blot和间接免疫荧光试验。
1.2.4 抗血清特异性鉴定 抗血清特异性鉴定采用间接免疫荧光效价(indirect immunofluorescence assay, IFA)和Western blot方法,详细步骤均见参考文献[5]。
1.2.5 小鼠攻毒 取约1周龄的昆明系乳鼠6只:攻毒组3只乳鼠,将乙脑种毒液用PBS适度稀释,每只小鼠腹腔注射病毒液0.25 mL(含病毒1.0×106PFU)。对照组小鼠3只,腹腔注射同样体积的PBS。攻毒后每天观察,当攻毒组小鼠出现明显神经症状时,分别取攻毒组和对照组小鼠脑组织,进行免疫组化试验。
1.2.6 免疫组化 组织固定按照常规进行,新鲜组织用10%中性甲醛固定24 h后脱水,石蜡包埋,5μm连续切片,切片烘干后4℃备用。免疫组化采用DAB显色。切片经0.3%H2O2灭活内源性过氧化酶,抗原修复后用10%山羊血清封闭,然后逐步进行一抗和二抗孵育、DAB显色,封片后在光镜下观察。
2 结果
2.1 NS3C克隆和原核表达载体的构建 NS3基因位于JEV基因组4608~6464 bp间,全长为1857 bp,编码68~70 kDa蛋白。本研究为了获得针对NS3的抗体,用DNAStar-Protean软件分析了NS3蛋白的抗原性(图1),截取了抗原指数和亲水性分值较高的C端(319~619 aa)进行表达。将JEV感染Vero细胞24 h后收取细胞样品,提取总RNA进行反转录,以cDNA为模板扩增编码NS3蛋白C端的基因片段(约900 bp)(图2A)。将PCR扩增的片段插入TA克隆载体pMD-18T中测序,测序正确后,双酶切下NS3C片段并插入pET-28a(+)载体,命名为pET-28a-NS3C(图2B)。
2.2 NS3C在大肠杆菌中的表达及纯化 将重组表达质粒pET-28a-NS3C转化BL21(DE3),挑取单细菌进行诱导表达,结果发现在诱导细菌中有大小约38 kDa的蛋白条带,与目的蛋白大小相符(图3)。将成功获得表达的重组菌扩大培养,使用His-Band蛋白纯化试剂盒对重组蛋白进行提纯。软件分析显示纯化的重组蛋白纯度达到95%(图3)。

图1 NS3示意图及其部分特性分析Fig.1 NS3 and its characteristics

图2 NS3C克隆及其重组表达载体的构建Fig.2 Cloning of NS3C and construction of its recombinant expressing plasmid
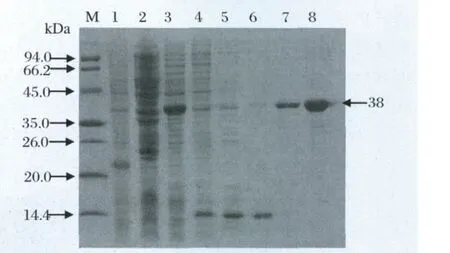
图3 NS3C重组蛋白的表达与纯化Fig.3 Expression and purification of NS3C
2.3 NS3C抗血清的制备及特异性鉴定 将重组蛋白免疫昆明系小鼠,5免后收取血清。取等量的感染和未感染JEV的Vero细胞蛋白样品进行Western blot分析,一抗为适当比例稀释的NS3C抗血清,化学发光法进行显色。如图4所示,在JEV感染组出现一条大小约72 kDa大小的条带,与预计NS3蛋白大小相符,而未感染细胞样品(mock)中没有相应的条带出现,说明该抗血清能特异识别病毒感染细胞中的NS3蛋白。
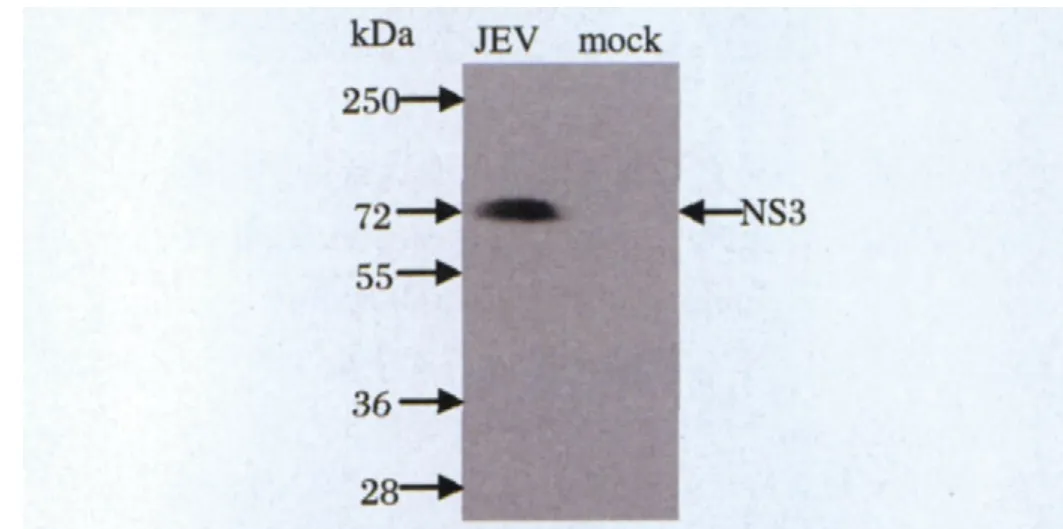
图4 NS3C抗血清识别病毒感染Vero细胞中的NS3蛋白(Western blot)Fig.4 NS3C antiserum reacted with NS3 expressed in JEV-infected Vero cells (Western blot)
将96孔中的Vero细胞感染JEV,24 h后固定,进行IFA分析,一抗为适当比例稀释的NS3C抗血清。荧光显微镜观察发现在JEV感染组细胞中有特异性亮绿色荧光,而且主要集中在胞浆中,而未感染组细胞(mock)仅见微弱的绿色背景,无亮绿荧光(图5),表明抗血清能特异识别病毒感染细胞中的NS3蛋白。
2.4 NS3在小鼠神经母瘤细胞中的亚细胞定位 JEV具有嗜神经特性,能在神经元细胞中复制并引发细胞凋亡。本试验将JEV感染小鼠神经瘤母细胞系Neuro-2A,用NS3C抗血清检测NS3蛋白的亚细胞定位。从图6可以看出,NS3蛋白主要定位于细胞质中,且可在细胞延伸出的突触中检测到(图6A,箭头指示)。进一步观察发现,NS3蛋白在细胞核周围分布明显(图6D,箭头指示)。
2.5 NS3在小鼠大脑神经细胞定位 JEV感染小鼠的脑组织石蜡切片,用NS3C抗血清进行免疫组化染色,观察NS3在脑组织中的表达定位。显微镜观察发现,在大脑免疫组化切片中可以看到NS3染色明显(棕褐色),多种细胞中呈现NS3染色,主要细胞为椎体神经元细胞,NS3主要定位于胞浆(图7A和7B,箭头所示)。而未感染小鼠脑组织切片内,未观察到明显棕褐色染色(图7C和7D)。
3 讨论
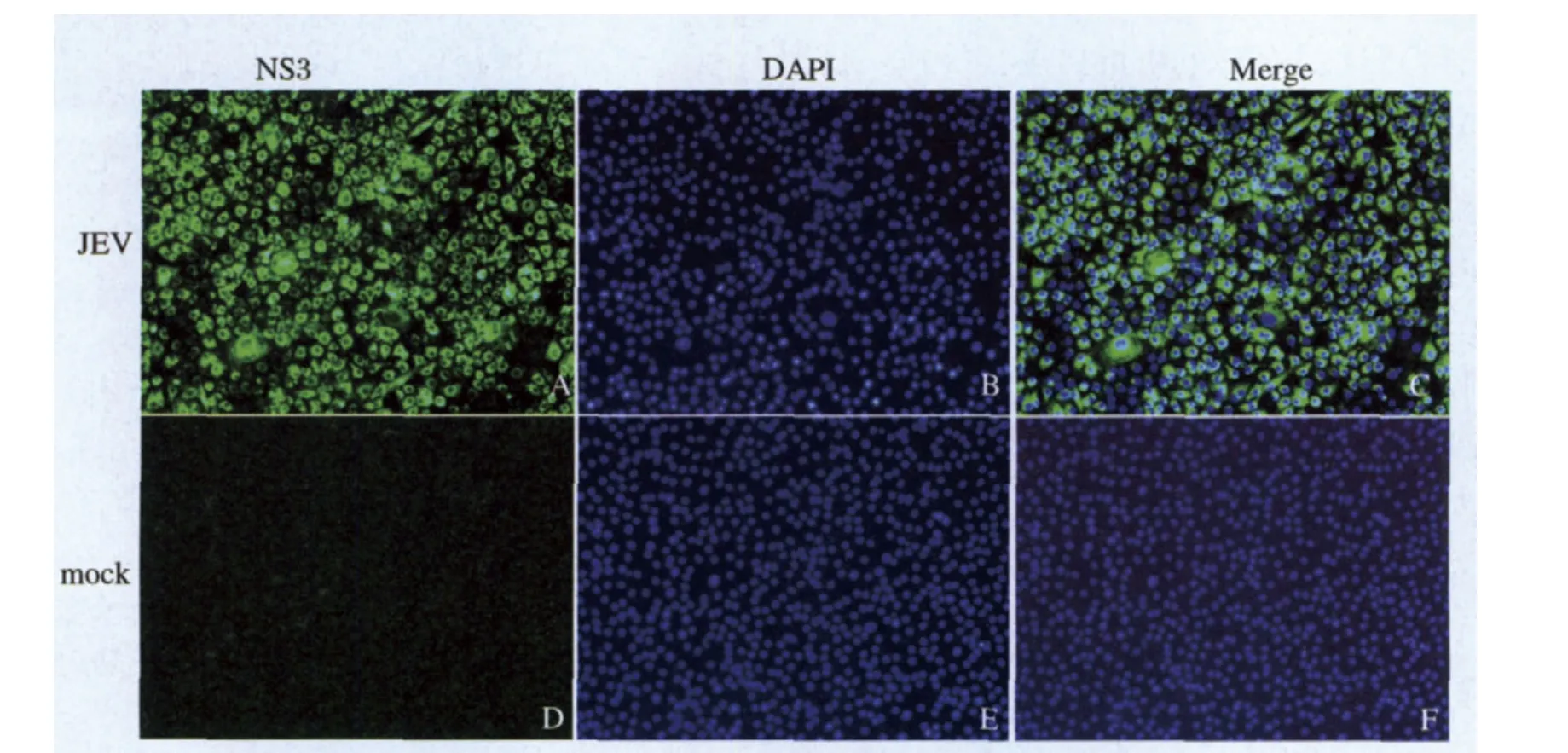
图5 NS3C抗血清识别病毒感染细胞中的NS3蛋白(IFA)Fig.5 NS3C antiserum reacted with NS3 expressed in JEV-infected Vero cells (IFA)
日本脑炎病毒是一个具有重要公共卫生学意义的病原,开发抗该病毒的治疗性药物具有重要的意义。由于JEV的非结构蛋白在病毒的复制中发挥重要的作用,因此这些非结构蛋白成为药物靶标分子的重要研究对象。

图6 NS3蛋白在小鼠神经母瘤细胞Neuro-2A中的亚细胞定位Fig.6 Subcellular localization of NS3 protein in Neuro-2A
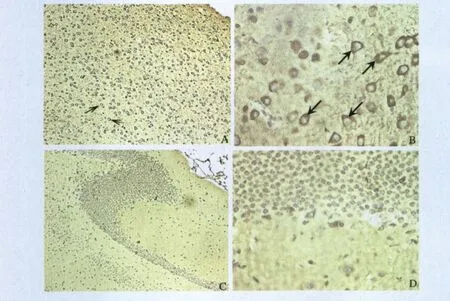
图7 免疫组化分析NS3在小鼠大脑神经细胞定位Fig.7 Localization of NS3 in mouse brain by immunohistochemistry assay
NS3是一个多功能蛋白,至少具有3种酶活性:丝氨酸蛋白酶活性、核苷酸磷酸酶活性(NTPase)和RNA解旋酶活性(helicase)[6,7]。其中,丝氨酸蛋白酶活性位于蛋白N端,NTPase和helicase活性位于蛋白的C端。研究者们以NS3蛋白的这些酶活性作为靶标,开始抗病毒研究。此外,有研究报道HCV NS3蛋白与肿瘤抑制因子p53蛋白有相互作用,具有抗凋亡功能,并能够抑制p53的生物学活性[8,9]。这些数据都表明,NS3蛋白在病毒复制过程中,不仅作用于自身,也作用于其宿主细胞因子。遗憾的是,这些作用的详细机制尚未明了。
为了获得高效表达的重组蛋白和特异性好的抗体,用于开展NS3与宿主细胞的互作的研究,我们分析了NS3蛋白的抗原性和亲水性,选择克隆了NS3基因的C端,并在大肠杆菌中获得了高效表达。通过免疫小鼠,成功研制出具有良好特异性的抗血清,为进一步研究NS3生物学功能提供了有利的工具。我们利用所制备的NS3C抗血清初步分析了NS3蛋白在神经细胞内的亚细胞定位,观察到NS3主要定位于细胞质中,并也可在神经细胞的突触中检测到NS3,这些结果为研究NS3蛋白的生物学功能提供了参考。
[1]殷震, 刘景华. 动物病毒学[M]. 2版. 北京:科学出版社,1997:631.
[2]Mackenzie J S. The ecology of Japanese encephalitis by vaccination: Minutes of a WHO/CVI meeting, Bangkok,13-15 October 1998[J].Vaccine, 2000, 18(Suppl2):1- 25
[3]Gould E A, Solomon T, Mackenzie J S. Does antiviral therapy have a role in the control of Japanese encephalitis?[J]. Antiviral Res, 2008,78(1):140-149.
[4]曾雅梅, 肖明, 张楚瑜. NS3蛋白在黄病毒科病毒生命活动中的作用[J]. 中国病毒学, 2003,15(5):508-512
[5]王晓杜, 陈培君, 沈阳, 等. H3N2型猪流感病毒M2蛋白表达分析[J]. 生物工程学报, 2009, 26(1):16-21
[6]Paola G A, Debra B R, Chiara N A, et al. Multiple enzymatic activities with recombinant NS3 protein of hepatitis C virus [J]. J Virol, 1997, 71: 2583-2590.
[7]Kadare G Haenni A L. Virus-encoded RNA helicase [J]. J Virol, 1997, 7l(14): 2583—2590.
[8]Deng L, Fuji M N, Tanaka M, et al. NS3 protein of Hepatitis C virus associates with the tumour suppressor p53 and inhibits its function in an NS3 sequence-dependent manner [J]. J Gen Virol, 2006, 87(6):1703-1713.
[9]Tanaka M, Fuji M N, Deng L, et al. Single-point mutations of hepatitis C virus NS3 that impair p53 interaction and anti-apoptotic activity of NS3 [J]. Biochem Biophys Res Commun, 2006, 340(3):792-799.
