密码子优化型鹅细小病毒病毒样颗粒的表达与鉴定
2012-06-08陈宗艳李传峰高景鹏朱英奇王玢瑸杨宗伟刘光清
陈宗艳,李传峰,高景鹏,朱英奇,王玢瑸,杨宗伟,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
鹅细小病毒(Goose parvovirus,GPV)能引起雏鹅发生一种急性或亚急性的败血性传染病,以急性肠炎以及心、肝、肾等实质脏器发生炎症为主要特征,病死率较高,俗称“小鹅瘟”[1,2]。GPV为细小病毒科依赖病毒属成员,基因组为单股线性DNA,由5106个核苷酸组成,含有2个主要开放阅读框架(open reading frame, ORF)[3,4]。ORF1编码2个非结构蛋白:Rep1和Rep2,ORF2编码3个结构蛋白:VP1、VP2、VP3。其中,VP2基因全长1764 bp,是组成GPV衣壳的主要成分,可以自我装配成病毒样颗粒(virus-like particles,VLPs)[5,6]。此外,研究表明,VP2内含有病毒的主要抗原决定簇,可以诱导机体产生免疫反应,同时也是中和抗体作用的靶蛋白[7]。
由于GPV具有严格的种属特异性,无合适的传代细胞系培养。因此,不能用传统方法研制其细胞灭活疫苗。通过禽胚连续传代方法,致弱GPV以研制的弱毒疫苗则存在毒力返强的潜在风险,同时生产成本也偏高,加之种鹅和雏鹅所用疫苗不同,大大限制了此类疫苗的生产和应用。因此,研制新型GPV疫苗已成为必然趋势[8,9]。大量研究证明,VLPs在形态上与真正病毒粒子相同或相似,可以模拟成熟病毒刺激机体产生强烈的特异性体液免疫和细胞免疫;此外,由于VLPs不含有核酸,在体内无引发感染和发生病毒基因与宿主染色体基因整合等优点,因此,以之作为预防性疫苗非常安全,具有较好的应用前景[6,10]。本研究即根据GPV VP2蛋白可以自我组装成VLPs的特性,利用Bac-to-Bac表达系统在昆虫细胞中表达GPV的病毒样颗粒。同时,为了提高VLPs的表达量,我们还对VP2的密码子进行了优化,并鉴定了所表达的蛋白。
1 材料与方法
1.1 主要材料及试剂 Bac-to-Bac杆状病毒表达系统、转染试剂Cellfectin及Grace昆虫细胞培养基购自美国Invitrogen 公司;pMD18-T 载体、Primer star聚合酶、限制性内切酶、PCR 引物均为大连TaKaRa 公司产品;鼠抗鹅细小病毒GPV VP2抗体由本实验室制备;ECL Western blot Substrate试剂盒购自Thermo scientific公司;山羊抗小鼠IgG购自北京中衫金桥公司。
1.2 VP2 基因的克隆 根据GenBank (登录号:JF333590)中的GPV VP2 基因序列设计引物,并在引物两端分别加上EcoRⅠ及Hind Ⅲ酶切位点。运用常规PCR方法,使用Primer star聚合酶扩增VP2 基因,然后克隆至pMD18-T载体中,获得重组质粒pMD-rVP2,将其送至上海基因生物技术公司进行测序鉴定。
根据昆虫细胞对密码子的偏嗜性,对GPV VP2基因进行优化,然后将密码子优化的VP2基因送交南京金斯特生物工程公司合成,并克隆至pMD18-T载体,获得重组质粒pMD-mVP2。
1.3 重组杆状病毒表达载体Bac-VP2的构建 首先,使用EcoRⅠ 、Hind Ⅲ双酶切重组质粒pMD-rVP2和pMD-mVP2,然后将释放出的VP2 基因插入pFastBac1质粒载体中,分别得到重组质粒pFast-rVP2 和 pFast-mVP2。 再 将 pFast-rVP2 和pFast-mVP2分别转化含杆状病毒穿梭载体Bacmid的E. coli DH10Bac 感受态细胞,通过与Bacmid发生位点特异性转座,获得两种重组杆状病毒表达质粒Bacmid-rVP2和Bacmid-mVP2。采用PCR 方法对上述重组质粒进行鉴定,预期扩增产物为4064 bp。 引 物 序 列:M13F:5'-gttttcccagtcacgac-3',M13R:5'-caggaaacagctatgac-3'。扩增条件: 93℃预变性 3 min; 94℃ 变性 45 s,55℃退火 45 s,72℃延伸 5 min,共30个循环;72℃ 延伸7 min。
1.4 重组杆状病毒rBac-VP2 的制备及病毒滴度测定 按照Bac-to-Bac表达系统说明书,将鉴定正确且纯化除菌的Bac-rVP2和Bac-mVP2分别用转染试剂(Cellfectin)转染对数生长期的Sf9 细胞,27℃培养5 d,待出现典型致细胞病变效应(cytopathic effect ,CPE)时收获第1 代重组杆状病毒,分别命名为Bac-rVP2、Bac-mVP2。随后,再用收获的第1代病毒感染Sf9 细胞,扩增并获得高滴度的第2 代重组病毒。用终点稀释法测定重组病毒的滴度,具体程序:将rBac-rVP2和rBac-mVP2分别进行10倍梯度稀释,感染96 孔板Sf9 细胞,27 ℃ 培养5 d 后,在显微镜下观察并记录发生CPE 的孔数,对于临界稀释倍数的所有孔(该稀释倍数病毒感染孔中有部分孔发生CPE)用免疫荧光法检测VP2 的表达(参见1.5),以进一步确定有发生病毒复制的孔数,利用下列公式来计算病毒滴度:
[病毒复制孔数/(该稀释度总孔数×单孔病毒液体积)]×稀释倍数。
1.5 VP2 在Sf9 细胞中的表达与检测 分别用第2代rBac-rVP2和rBac-mVP2以10倍感染复数(multiplicity of infection,MOI))接种2份Sf9细胞,27℃培养72 h后,一份用于SDS-PAGE 及Western blot检测,另一份用于IFA检测。IFA试验过程如下:Sf9细胞去除上清后,加入冷固定液 (甲醇与丙酮1:1混合,-20℃保存)固定15 min,吸去固定液,用含1% BSA的PBS缓冲液漂洗3次,每次5 min;加入稀释的鼠抗VP2 蛋白抗体(1:200稀释)37℃孵育1 h,漂洗3次,每次5 min;加入FITC标记的山羊抗小鼠IgG (1:100稀释),37℃孵育1 h,漂洗3次后于荧光显微镜下观察、拍照。
1.6 GPV VLPs 的纯化及电子显微镜鉴定 10 MOI Bac-mVP2感染Sf9 3~4 d,待细胞病变明显,收集细胞;超声破碎后,于15 000×g 离心10 min,除去细胞碎片;将上清转移至铺有蔗糖(40%,W/W;TNE配制)垫层的离心管中,于4 ℃、45 000 ×g (SW32 Ti 转子,Beckman)离心3 h。超离后的沉淀用TNE缓冲液重悬,接着使用非连续CsCl 梯度(1.15、1.20、1.25 g/mL;TNE配制)于4 ℃、160 000× g(SW41 Ti 转子,Beckman)离心15 h。分管收集白色致密条带,用TNE稀释后,再次于4 ℃、45 000× g (SW32 Ti 转子,Beckman)离心3 h除盐,溶解沉淀,使用磷钨酸负染,于透射电镜下观察VLPs。
2 结果

图1 密码子优化前后的基因序列Fig.1 The sequences of the original and codon-optimized VP2 genes
2.1 携带VP2 基因重组杆状病毒的制备 用常规PCR方法成功扩增出VP2基因,其长度为1776 bp。酶切鉴定与测序结果均证明扩增的VP2基因与参考序列一致,其氨基酸同源性为100%。将VP2基因及密码子优化的VP2基因(图1)分别亚克隆至pFastBac1中,成功获得pFast-rVP2和pFastmVP2。用此两种重组质粒分别转化DH10Bac 感受态细胞,获到Bac-rVP2和Bac-mVP2两种重组质粒。由于杆状病毒载体的基因组较大,远远超过靶基因的长度 (1764 bp),因此,不便于利用限制性内切酶酶切的方法进行鉴定,在此,我们采用了说明书推荐的PCR 方法对重组质粒进行鉴定。检测结果表明,成功获得了携带VP2基因的重组杆状病毒(图2)。Bac-rVP2转染Sf9 细胞获得的第1 代重组杆状病毒Bac-rVP2感染Sf9 细胞后,得到第2代 Bac-rVP2,滴度为 3.5×107; Bac-mVP2转染Sf9细胞获得的第2代毒的滴度为8.5×107。将第2代Bac-rVP2、Bac-mVP2保存于-80℃备用。
2.2 GPV VP2 蛋白在昆虫细胞中的表达 10 MOI Bac-rVP2及Bac-mVP2感染Sf9 3~4 d后,用IFA法可检测到VP2在昆虫细胞中的表达。如图3所示,Bac-rVP2及Bac-mVP2 感染的Sf9细胞均出现特异的绿色荧光(图3a、3b),而对照的Sf9细胞中未见荧光(图3c)。
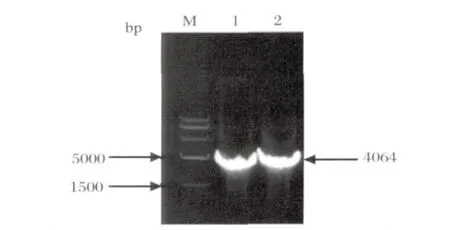
图2 PCR法检测Bac-rVP2和Bac-mVP2结果Fig.2 PCR results of Bac-rVP2 and Bac-mVP2

图3 IFA法检测GPV VP2蛋白在昆虫细胞中的表达Fig.3 Detection GPV VP2 proteins expressed in Sf9 cells by IFA
将收获的重组病毒进行SDS-PAGE电泳,检测结果显示野生型VP2和密码子优化的VP2(mVP2)都得到了成功表达,其分子量均约为65 kDa (图4a)。Western blot检测结果则证明表达的VLPs不仅特异而且具有良好免疫原性 (图4b)。此外,根据SDS-PAGE电泳及蛋白免疫电泳结果也可推知,VP2的密码子优化后,其在昆虫细胞中的表达量获得了显著提高。
2.3 VLPs 的电镜观察 Bac-mVP2 感染Sf9 所收集的细胞,经离心纯化、负染,电镜观察,可见VLPs,背景清晰(图5)。
3 讨论

图4 rBac-rVP2及rBac-mVP2在昆虫细胞中表达的蛋白的SDS-PAGE(a)及Western blot(b)检测结果Fig.4 SDS-PAGE(a)and Western blot(b)analysis of Sf9 cell extracts expressing VP2 protein using a polyclonal anti-GPV mouse serum
由于GPV具有严格的种属特异性,目前尚无合适的增殖GPV的传代细胞系,因此, 通过体外培养方式获得GPV很困难,而制备相应的诊断抗原或有效新型疫苗的候选抗原,也只能凭借基因工程手段获得。研究表明,VP2是GPV最重要的免疫原基因,无论是在诊断和抗病毒感染方面都具有较大的开发潜力。所以大量获得具有良好免疫原性的VP2蛋白在GPV基础与应用研究方面都具有重要意义[7]。目前,用来生产VP2 蛋白的表达系统主要是原核表达系统和杆状病毒-昆虫细胞表达系统,前者虽然能大量表达VP2蛋白,但VP2自聚成VLPs的能力丧失,而且由于缺乏必要的翻译后修饰,重组蛋白的抗原性不如天然抗原优越,因此用原核细胞表达VP2蛋白具有一定的局限性。相比之下,以Bac-to-Bac 表达系统为代表的杆状病毒-昆虫细胞表达体系则具有与动物细胞类似的转录、翻译及翻译后加工等优势,使得表达产物能拥有接近天然蛋白的生物学活性[5,6]。因此,该系统被广泛用于外源蛋白的表达,并逐渐发展为成熟的商品化的真核表达系统。
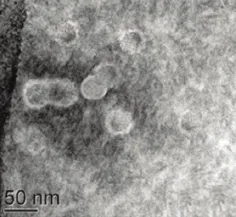
图5 电子显微镜观察mVP2形成的VLPs(53 000×)Fig.5 Electron micrographs of GPV VLPs derived from mVP2 (53 000×)
Ghislaine等[5]首次利用杆状病毒-昆虫细胞表达系统表达了GPV VP2蛋白,并获得了具有良好免疫原性的VLPs,但其不足之处是蛋白的表达量偏低,限制了该抗原的扩大生产。我国是水禽养殖业大国,GPV感染对我国的水禽养殖业构成了较大威胁[11],无论是快速诊断GPV感染,还是预防GPV疫情,都需要大量制备具有良好免疫原性的GPV抗原。为适应这一生产需要,根据昆虫细胞密码子的偏嗜性,我们尝试通过优化GPV VP2密码子的方法,以改变tRNA作用强度增加合成基因的表达量[12],克服天然VP2蛋白在昆虫细胞中表达量偏低的局限性。通过比较昆虫细胞及GPV的密码子使用频率表,发现其中编码Ala、Asp、Leu、Lys、Val氨基酸的密码子使用频率差异超过13次以上,我们推测由于GPV基因密码子的偏嗜性与所选表达宿主细胞的tRNA含量不匹配,可能是导致GPV VP2在昆虫细胞中表达受到限制的原因。据此,我们在不改变GPV VP2氨基酸序列的前提下,将其密码子替换为昆虫细胞偏嗜的密码子,并根据影响表达的其他因素作个别位点调整,如降低VP2的GC含量,消除VP2编码区内可能导致翻译提前终止的潜在加尾信号(AT富含区)等抑制元件[13]。
本研究结果证实,在不改变VP2氨基酸序列的前提下,通过优化VP2密码子途径以提高其在昆虫细胞中的表达量是可行的。虽然,我们没有对表达产物进行定量分析,但是根据SDS-PAGE电泳和Western blot检测结果,仍能判断密码子优化的VP2的表达量要远远高于野生型VP2的表达。此外,间接免疫荧光检测和蛋白免疫电泳试验结果也显示,本研究表达的VP2蛋白具有良好的免疫原性。更重要的是,通过电子显微镜观察,发现密码子优化的VP2 蛋白能够在昆虫细胞中自行装配成VLPs,其直径为20~30 nm,形状大小与全病毒粒子相似。这说明密码子的优化不仅不影响VP2的折叠功能,而且可以显著提高其表达量。
综上所述,本研究通过优化GPV VP2密码子,实现了VP2蛋白在昆虫细胞的大量表达,并成功获得了具有良好免疫原性的密码子优化型VLPs,为进一步建立检测GPV感染的血清学方法以及研制有效的基因工程疫苗等奠定了良好基础。
[1]Derzsy D. A viral disease of goslings Epidemiological,clinical, pathological and aetiological studies [J]. Acta Vet Acad Sci Hung, 1967, 17(4): 443-448.
[2]Schettler C H. Virus hepatitis of geese host range of goose hepatitis virus [J]. Avian Dis, 1971,15(4): 809-823.
[3]Smith D H, Ward P, Linden R M. Comparative characterization of Rep proteins from the helper-dependent adeno-associated virus type 2 and the autonomous goose parvovirus [J]. J Virol, 1999,73(4): 2930-2937.
[4]Zádori Z, Stefancsik R, Rauch T, et al. Analysis of the complete nucleotide sequences of goose and muscovy duck parvoviruses indicates common ancestral origin with adeno-associated virus 2 [J]. Virology, 1995, 212(2): 562-573.
[5]Ghislaine G R, Jestin V, Chagnaud P, et al. Expression of muscovy duck parvovirus capsid proteins (VP2 and VP3)in a baculovirus expression system and demonstration of immunity induced by the recombinant proteins. [J]. J Gen Virol, 1996, 77(9): 2159-2163.
[6]Ju H, Wei N, Wang Q, et al. Goose parvovirus structural proteins expressed by recombinant baculoviruses self-assemble into virus-like particles with strong immunogenicity in goose [J]. Biochem Bioph Res Co,2011, 409(1): 131-136.
[7]Lee J W, Lin Y M, Yen T Y, et al. CpG oligodeoxynucleotides containing GACGTT motifs enhance the immune responses elicited by a goose parvovirus vaccine in ducks [J].Vaccine, 2010, 28(50): 7956-7962.
[8]Irvine R, Ceeraz V, Cox B, et al. Goose parvovirus in Great Britain [J]. Vet Rec, 2008, 163(15): 461.
[9]Poonia B, Dunn P A, Lu H, et al. Isolation and molecular characterization of a new Muscovy duck parvovirus from Muscovy ducks in the USA[J]. Avian Pathol, 2006, 35(6):435-441.
[10]Rueda P, Fominaya J, Langeveld J P, et al. Effect of different baculovirus inactivation procedures on the integrity and immunogenicity of porcine parvovirus-like particles [J]. Vaccine, 2000, 19(7-8): 726-734.
[11]刘宇卓, 李银, 魏雪涛, 等. 鹅细小病毒LH株的分离鉴定 [J]. 江苏农业学报, 2009, 25(5): 1091-1094.
[12]Zhou J, Liu W J, Peng S W, et al. Papillomavirus capsid protein expression level depends on th match between codon usage and tRNA availability [J]. Virology, 1999,73(6): 4972-4982.
[13]Rollman E, Arnheim L, Collier B, et al. HPV-16 L1 genes with inactivated negative RNA elements induce potent immune responses [J]. Virology, 2004, 322(2): 182-189.
