TGFβ1,CTGF信号传导通路在小鼠肝纤维发生中的作用
2012-06-05胡云龙
胡云龙,孔 丽
(1.河北医科大学第三医院医教科;2.中西医结合肝病科,河北石家庄 060051)
TGFβ1,CTGF信号传导通路在小鼠肝纤维发生中的作用
胡云龙1*,孔 丽2
(1.河北医科大学第三医院医教科;2.中西医结合肝病科,河北石家庄 060051)
目的 探讨实验性肝纤维化小鼠肝组织中TGFβ1,CTGF信号传导通路的变化及意义。方法 将小鼠随机分为对照组、肝纤维化模型组(腹腔注射10%的CCl4橄榄油),8周后应用酶法和放射免疫法检测血清ALT、HA水平,HE染色、Masson染色观察肝组织炎性反应及纤维化程度,免疫组化法和RT-PCR法检测肝组织α-SMA、TGFβ1、TGFβRⅡ、Smad3、Smad7、CTGF蛋白和mRNA水平。结果 模型组血清ALT及HA水平明显高于对照组;肝组织 α-SMA、TGFβ1、TGFβRII、Smad3 及 CTGF(8.21 ± 1.48、5.52 ±0.89、0.52 ±0.04、5.86 ±1.49、5.49 ±0.29)蛋白表达明显高于对照组(1.51±0.95、1.31±0.81、0.37±0.04、1.41±0.95、0.31±0.19)(P<0.01);而模型组肝组织Smad7(1.83±0.62)蛋白和mRNA表达较对照组(6.32±1.18)显著降低(P<0.01)。各指标mRNA表达与蛋白表达一致。结论 TGFβ1和CTGF信号传导通路过度活化,Smad7表达和负调节TGFβ、CTGF信号传导通路的功能被抑制可能与肝纤维化的发生和发展密切相关。
肝纤维化;转化生长因子β1;Smad蛋白;结缔组织生长因子;信号传导通路
肝纤维化是指各种致病因素持续或反复损伤肝脏所导致的肝脏内结缔组织增生,细胞外基质(extracellular matrixc,ECM)合成大于降解,导致ECM过度沉积的病理过程。研究发现,肝星状细胞(hepatic stellate cell,HSC)激活及表型转化是肝纤维化形成的中心环节[1],转化生长因子β1(transforming growth factor-β,TGFβ1)是激活HSC的主要细胞因子[2],Smad蛋白是其下游信号传导因子,在肝纤维化中发挥重要作用。结缔组织生长因子(connective tissue growth factor,CTGF)是近年发现的与肝纤维化形成相关的细胞因子,可能为TGFβ1信号下游高效反应元件,可特异性介导TGFβ1刺激成纤维细胞增生,促进组织器官纤维化形成等生物学作用,但其在肝纤维化发生中的确切机制尚不清楚,因此本研究观察肝组织中TGFβ1、CTGF信号传导通路中相关信号分子蛋白和mRNA表达,阐明其在肝纤维化发病机制中的作用。
1 材料与方法
1.1 肝纤维化小鼠模型的建立
SPF级8周龄雌性C57BL/6J小鼠30只,体质量18~22 g(河北医科大学实验动物中心,合格证号1008169),随机均分为对照组(control group)给予腹腔注射0.9%氯化钠注射液和肝纤维化模型组(model group)给予腹腔注射10%的CCl4橄榄油,每周2次,共8周,8周后留取血清及肝组织标本。部分肝组织用10%中性甲醛固定,其余肝组织用液氮快速冷冻、-80℃冰箱保存备提取RNA。
1.2 药品及试剂
CCl4(天津市北宏试剂厂),TGFβ1、TGFβRII、Smad3、Smad7和CTGF等(北京中杉生物技术有限公司)。RT-PCR试剂盒及相关试剂(北京赛百盛公司)。
1.3 方法
1.3.1 血清ALT和HA检测:采用Olympas7100全自动生化仪酶法和放射免疫法检测。
1.3.2 肝组织病理学分析:常规制片,HE和Masson染色,炎性反应分级及纤维化分期参见2000年中华医学会传染病和寄生虫病分会修订的《病毒性肝炎防治方案》[1]
1.3.4 肝组织免疫组化检测:用 SP法,α-SMA、TGFβ1、TGFβRII、Smad3、Smad7 和 CTGF 等一抗工作液浓度分别为1∶200、1∶150、1∶100、1∶100、1∶50和1∶50,PBS 代替一抗作阴性对照,TGFβ1、Smad3、Smad7和CTGF蛋白在肝组织中的阳性表达为相应的细胞质内呈现棕褐色颗粒,TGFβRII蛋白在肝组织中的阳性表达为相应的细胞膜呈现棕褐色颗粒。应用Olympus BX51光学显微镜摄片(物镜×20)。采用北京航空航天大学真色彩病理图像分析系统分析结果,每个样本取3张切片,每张切片取5个视野进行图像分析,分析各图象阳性面密度(阳性细胞所占面积/视野总面积×100%)进行半定量分析。
1.3.5 肝组织 TGFβ1、Smad3、Smad7、CTGFmRNA表达检测:用RT-PCR法,采用Trizol试剂一步法提取肝组织总RNA,合成cDNA,PCR扩增。PCR引物设计、反应条件等如表1所示。扩增产物进行琼脂糖凝胶电泳,紫外透射仪观察,应用法国VL公司BIO-PROFIF凝胶图象分析系统Bio-1D++分析软件对目的电泳条带进行分析,以目的基因条带与内参照GAPDH条带吸光度值之比表示表达量。
1.4 统计学分析

表1 TGFβ1、Smad3、Smad7、CTGF 和 GAPDH 引物序列Table 1 Primer of TGFβ1,Smad3,Smad7,CTGF and GAPDH
2 结果
2.1 小鼠血清ALT、HA水平
模型组血清ALT(169±14 U/L)、HA(1610±126 μg/L)分别高于对照组的47.90±8.10 U/L和759 ±77 μg/L(P<0.01)。
2.2 小鼠肝组织病理观察
对照组小鼠肝小叶结构正常,无肝细胞坏死及纤维组织增生;模型组小鼠肝组织小叶内可见点状或灶状肝细胞坏死伴炎性细胞浸润,汇管区及窦周可见大量纤维组织增生,形成纤维间隔分割肝小叶。
2.3 小鼠肝组织α-SMA蛋白表达
对照组小鼠肝组织内无α-SMA阳性染色。模型组小鼠肝组织中α-SMA表达明显升高,可见于汇管区血管壁、肝纤维组织与肝实质交界处,窦周间隙,中央静脉壁中。模型组肝组织α-SMA阳性面密度值为8.21±1.48明显高于对照组的1.51±0.95(P<0.01)。
2.4 小鼠肝组织TGFβ1、TGFβRII、Smad3、Smad7和CTGF蛋白表达
对照组小鼠TGFβ1少量表达于肝组织,模型组TGFβ1阳性表达明显增多,可见于汇管区周围细胞、中央静脉血管壁、增生的纤维间隔、窦周细胞等;TGFβRII在对照组小鼠肝组织少量表达于肝细胞及HSC细胞膜上,模型组TGFβRII在上述部位的表达显著增加;对照组小鼠肝组织Smad3少量表达于汇管区基质及间质细胞质,Disse间隙等,而模型组肝组织中汇管区、纤维间隔间质细胞、炎性反应细胞、成纤维细胞、窦周细胞等胞质大量表达;Smad7大量分布于对照组小鼠肝细胞胞质及部分肝细胞核膜,模型组肝组织Smad7阳性细胞数显著减少,见于少部分肝细胞及纤维间隔梭状细胞;CTGF在对照组基本无阳性表达,模型组CTGF蛋白表达呈黄色或棕黄色,主要分布在汇管区、门静脉及纤维间隔、肝星状细胞等位置。模型组肝组织 TGFβ1、TGFβRII、Smad3 和 CTGF 阳性面密度值明显高于对照组(P<0.01),模型组Smad7阳性面密度值低于对照组(P<0.01)(图1,表2)。
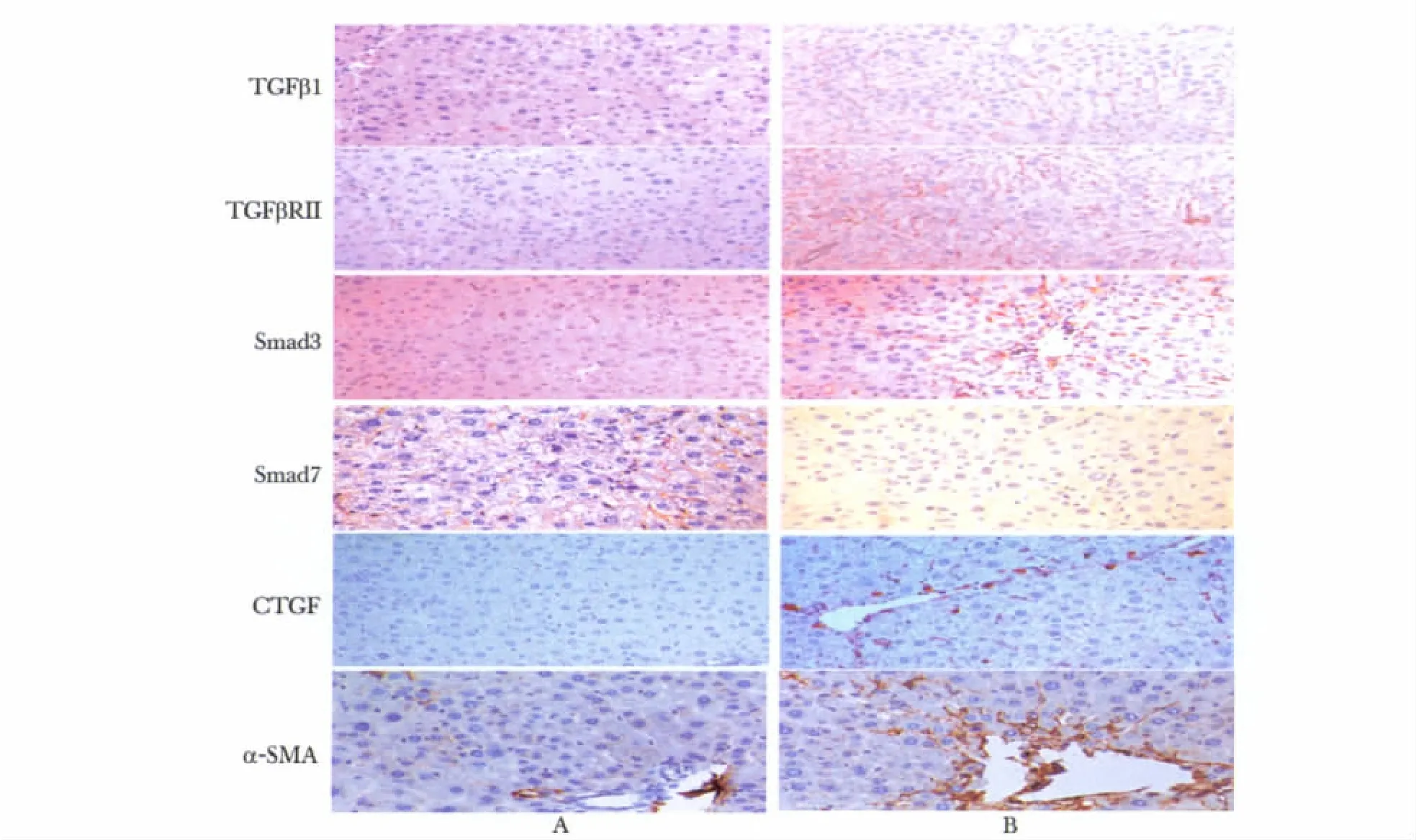
图1 TGFβ1、TGFβRII、Smad3、Smad7、CTGF 和 α-SMA 在小鼠肝组织中的表达Fig 1 The expression of TGFβ1,TGFβRII,Smad3,Smad7,CTGF and α-SMA in Liver tissue of mice(Immunohistochemical staining,×200)
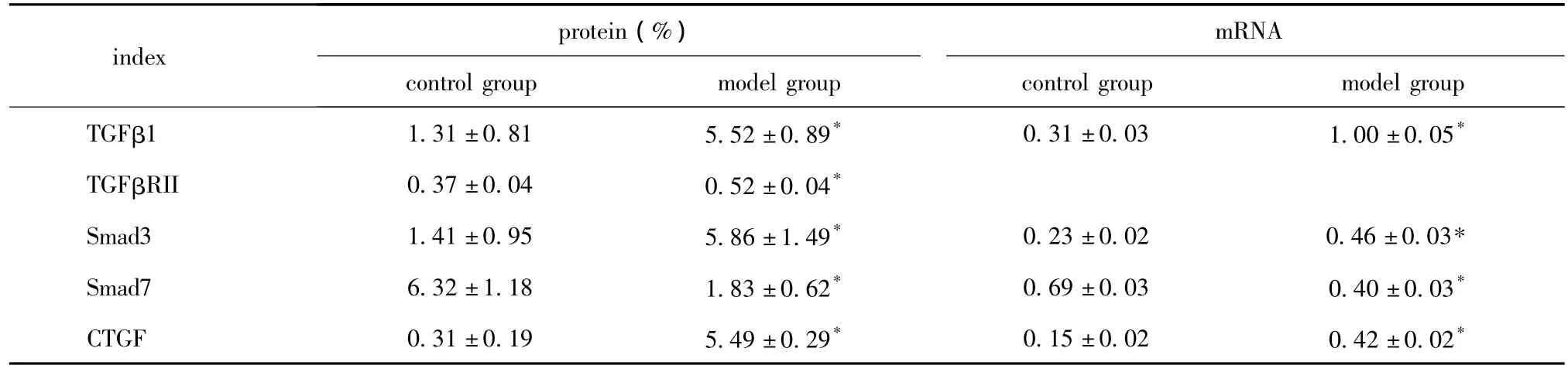
表2 TGFβ1、TGFβRII、Smad3、Smad7、CTGF 蛋白和 mRNA 在肝组织中的表达Table 2 Expression of TGFβ1,TGFβRII,Smad3,Smad7,CTGF protein and mRNA in Liver tissue(n=15)
2.5 小鼠肝组织 TGFβ1、Smad3、Smad7和 CTGF mRNA表达
模型组肝组织TGFβ1、Smad3和CTGFmRNA表达明显高于对照组(P<0.01);而Smad7mRNA表达模型组明显少于对照组(P<0.01)(图2,表2)。
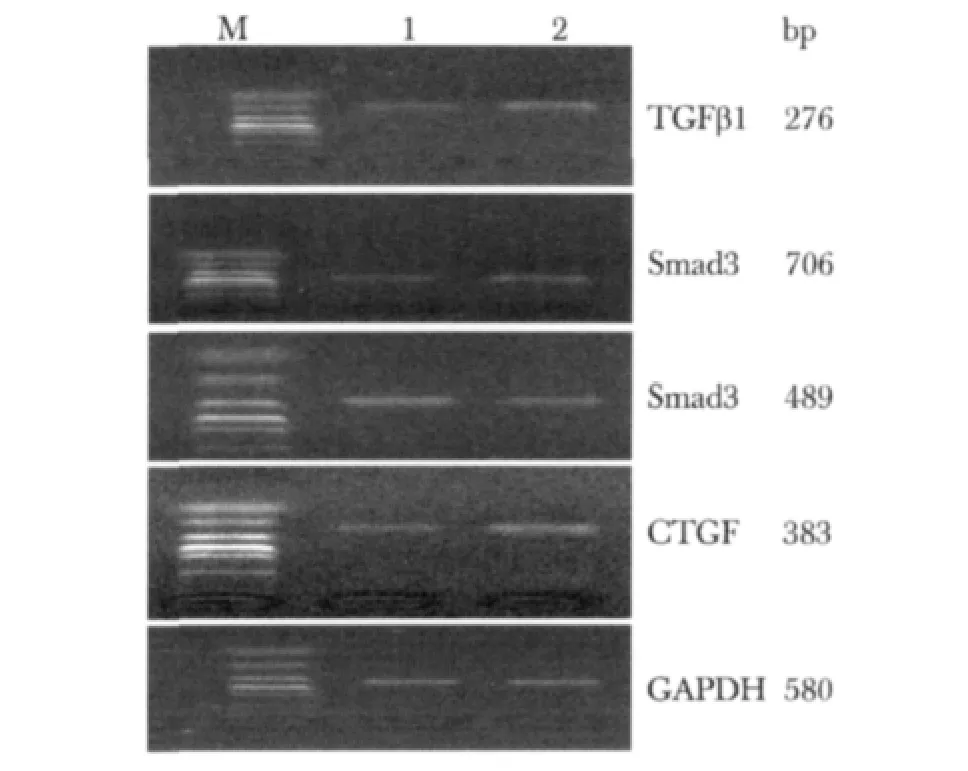
图2 TGFβ1、Smad3、Smad7、CTGF,GAPDH mRNA在小鼠肝组织中的表达Fig 2 The expression of TGFβ1,Smad3,Smad7,CTGF,GAPDH mRNA in liver tissue of mice M.marker;1.control group;2.model group
3 讨论
TGFβ1是激活HSC的主要细胞因子之一,是最强的肝纤维化促进剂[2],本研究显示,正常小鼠肝组织TGFβ1只有少量表达,肝纤维化TGFβ1蛋白和mRNA表达明显增加,提示TGFβ1的高表达促进了肝纤维化的发生和发展。TGFβRII正常分布于肝细胞及HSC的胞膜上,当发生肝纤维化时TGFβRII蛋白表达明显上调,说明肝纤维化时TGFβ1/Smads通路的上游信号分子存在过度活化。
Smad蛋白是TGFβ1跨细胞膜传入HSC细胞核的关键蛋白,TGFβ1与细胞膜上的 TGFβRII结合后,活化 TGFβRI,使 Smad2或 Smad3 C末端磷酸化,并与Smad4形成异聚体转录复合物,移位至细胞核与序列特异的DNA结合,诱导基因转录,介导HSC向MFB转化,使纤维化产生和不断发展[3-4]。Smad7基因是TGFβ1信号传导通路的抑制元件,通过与活化的TGFβI型受体结合,一方面抑制Smad2、Smad3的磷酸化,另方面抑制Smad2、Smad3与受体结合,在TGFβ信号传导中构成负反馈环路,发挥抗纤维化作用[5-6]。本研究显示,Smad7蛋白大量分布于正常小鼠肝细胞胞质及部分核膜,在纤维化小鼠肝组织中Smad7表达减少,仅见于少部分肝细胞及纤维间隔梭状细胞。而Smad3蛋白在正常小鼠肝组织内仅在汇管区基质及间质细胞质,Disse间隙、血管壁有少量表达;在纤维化小鼠肝组织中Smad3蛋白大量表达于汇管区、纤维间隔间质细胞、炎性细胞、成纤维细胞、窦周细胞等胞浆。Smad7和Smad3mRNA表达亦呈相同结果。
CTGF是一种由349个氨基酸组成、相对分子量为34~38 ku的富含半胱氨酸的分泌肽[7],通过激活Ras/Raf/ERK等信号通路促进成纤维细胞增殖、活化,刺激Ⅰ、Ⅲ型胶原合成,参与ECM产生和积聚,促进纤维化疾病的发生和发展[8]。用反义技术抑制CTGF表达能明显降低TGFβ1诱导的ECM合成,提示CTGF在TGFβ1导致的肝纤维化中起关键作用。本研究显示,肝纤维化模型组小鼠肝组织CTGF蛋白和mRNA表达较对照组明显增强,并且与TGFβ1的趋势一致,提示CTGF在肝纤维化发生中起着重要的作用。
本研究显示,肝纤维化时肝组织TGFβ1、CTGF、TGFβRII、Smad3表达明显增强,Smad7表达显著减低,TGFβ1、CTGF信号传导通路功能明显增强,对肝纤维化发生、发展起到了正反馈效果。寻找有效药物抑制TGFβ1、CTGF信号通路的表达,提高Smad7的表达可能成为防治肝纤维化的一个新方向。
[1]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8:324-329.
[2]Gressner AM,Weiskirchen R.Modem pathogenetic concepts of liver fibrosis suggest stellate cells and TGF beta as major players and therapeutic targets[J].Cell Mol Med,2006,101:76-99.
[3]Paradis V,Dargere D,Bonvoust F,et al.Effects and regulation of connective tissue growth factor on hepatic stellate cells[J].Lab Invest,2002,82:767 -774.
[4]Long JY,Wang GN,Matsuura I,et al.Activation of Smad transcriptionalactivity by protein inhibitorofactivated STAT3 PLAS3[J].Proc Natl Acad Sci USA,2004,101:99-104.
[5]Kavsak P,Rasmussen Rk,Causing Cg,et al.Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degradation[J].Mol Cell,2000,6:1365-1375.
[6]Dooley S,Hamzavi J,Breitkopf K,et al.Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats[J].Gastroenterology,2003,125:178-191.
[7]Katsube K,Sakamoto K,Tamaura Y,et al.Role of CCN,a vertebrate specific gene family,in developmen[J]t.Dev Growth Differ,2009,51:55 -67.
[8]Riser BL,Najmabadi F,Perbal B,et al.CCN3(NOV)is a negative regulator of CCN2(CTGF)and a novel disease[J].Am J Pathol,2009,174:1725-1734.
Role of TGFβ1 and CTGF signaling pathway in experimental hepatic fibrosis
HU Yun-long1,KONG li2
(1.Dept.of Teaching Affairs;2.Dept.of Hepatology,the Third Hospital of Hebei Medical University,Shijiazhuang 050051,China)
ObjectiveTo investigate the mechanism of TGFβ1 and CTGF signaling pathway in experimental hepatic fibrosis mice.MethodsThirty C57BL6/J mice were divided into control group and test group(each group,n=15).Mice were injected with CCl4which induced liver fibrosis.Serum ALT and HA were tested by enzymic method and radio-immunity.Liver inflammation was graded by HE staining,and liver fibrosis by Masson staining.The expression of proteins of TGFβ1,CTGF,TGFβRII,Smad3,Smad7 of liver tissue were examined by immunohistochemistry.The expression of TGF-β1,Smad3,Smad7 and CTGF mRNA were analyzed by RT-PCR.ResultsCompared with control group,the expression of TGFβ1,CTGF,TGFβRII,Smad3 proteins and TGFβ1,CTGF,Smad3 mRNA were increased but Smad7 protein and Smad7 mRNA were decreased in test group.The level of ALT and HA was higher in model group than that of the control group.ConclusionsTGFβ1 and CTGF pathway overactivitied may be associated with liver fibrosis.Down-regulating TGFβ,CTGF pathway and up-regulating smad7 expression may be suppressing the hepatic fibrosis.
Hepatic fibrosis;TGFβ1;Smad protein;CTGF;signalling pathway
R 575.2
A
1001-6325(2012)01-0066-05
2010-12-16
2011-06-24*< class="emphasis_bold">通信作者(corresponding author):
(corresponding author):ydsyhyl@163.com
