抗TNF-α抗体治疗大鼠肝肺综合征
2012-06-05冯英梅
冯英梅,刘 丽,刘 楠,赵 芝
(1.河北医科大学第二医院消化内科河北省消化病重点实验室河北省消化病研究所,河北石家庄 050000;2.辛集市第一医院,河北辛集 052360)
抗TNF-α抗体治疗大鼠肝肺综合征
冯英梅1,2,刘 丽1*,刘 楠1,赵 芝1
(1.河北医科大学第二医院消化内科河北省消化病重点实验室河北省消化病研究所,河北石家庄 050000;2.辛集市第一医院,河北辛集 052360)
目的 探讨抗TNF-α单克隆抗体(TNF-αMcAb)对肝肺综合征(HPS)大鼠NF-κB表达的影响及NF-κB在抗TNF-α单克隆抗体治疗大鼠肝肺综合征中的作用。方法 用胆总管结扎术(CBDL)建立大鼠HPS模型,经腹腔注射抗TNF-αMcAb(0.1 mg/kg·2 d)治疗HPS,HE染色观察肺组织病理变化;放射免疫法检测血浆TNF-α的水平;鲎试剂盒检测血浆内毒素水平;进行血气分析,计算肺泡-动脉氧分压梯度差的变化;Western blot方法进行肺组织NF-κB蛋白表达定量分析。结果 抗TNF-αMcAb干预后肺组织的炎性反应和毛细血管扩张明显减轻;肺泡-动脉氧分压梯度差明显减少(P<0.05);血浆内毒素和TNF-α的水平较胆总管结扎组明显减低(P<0.05);肺组织NF-κB蛋白表达水平显著下降(治疗前:0.93±0.23;治疗后:0.75±0.18)(P<0.05)。结论 抗TNF-α单克隆抗体可能通过抑制NF-κB的表达治疗肝肺综合征。
肿瘤坏死因子-α;肿瘤坏死因子-α单克隆抗体;肝肺综合征;核转录因子-κB
*通信作者(corresponding author):loraliu@yeah.net
肝肺综合征(hepatopulmonary syndrome,HPS)是各种慢性肝病的严重并发症之一,是在慢性肝病和(或)门静脉高压基础上出现的肺血管扩张和动脉血氧合功能异常[1]。目前认为HPS的发病机制与细菌异位和肠源性内毒素血症(intestinal endotoxemia,IETM)有关,IETM 时 TNF-α 表达上调,细菌内毒素及TNF-α可激活巨噬细胞核转录因子-κB(nuclear factor-κB,NF-κB),诱导转录并促进多种细胞因子合成,从而导致HPS发生[2]。本研究旨在探讨抗TNF-α单克隆抗体对HPS的治疗作用以及是否通过抑制NF-κB的表达治疗HPS。
1 材料与方法
1.1 材料
抗大鼠TNF-αMcAb(第四军医大学免疫教研室),鲎试剂盒(北京安度斯生物技术公司),检测TNF-α的放免试剂盒(北京普尔伟业生物科技公司),抗NF-κB多克隆抗体(北京中山生物技术公司)。
1.2 方法
1.2.1 大鼠HPS模型的建立及实验分组:采用胆总管结扎术(CBDL)建立大鼠HPS模型[1]。按照中华人民共和国技术监督局GB14922-94《实验动物微生物和寄生虫检测等级》的标准,选用清洁级成年健康雄性SD大鼠60只,体质量(250±25)g,合格证编号:807145,由河北医科大学实验动物中心提供。随机分为假手术组、胆总管结扎组和干预组。胆总管结扎组:于结扎后1、2、3、4及5周麻醉动物(每个时间点6只大鼠);干预组:于结扎后第2周,开始腹腔内注射抗TNF-αMcAb(0.1 mg/kg·2 d),并于干预后1、2、3及4周麻醉动物(每个时间点6只大鼠);假手术组(6只大鼠):仅分离胆总管不结扎,与CBDL 5周的模型组动物同批麻醉,留取各组动物的肺组织及动、静脉血样。
1.2.2 肺组织病理检查:取肺组织块约5×5×5 mm大小,以10%的甲醛固定后,依次进行梯度乙醇脱水、二甲苯透明、常规石蜡切片、苏木素-伊红染色,在光镜下观察肺组织的病理学变化。
1.2.3 动脉血气分析:用抗凝剂处理的无菌注射器抽取腹主动脉血1 mL,以橡胶塞封口后,立即送检进行血气分析,结果以P(A-a)O2(肺泡-动脉氧分压梯度差)表示。
1.2.4 血清TNF-α、内毒素的测定:取血清样本分别进行下列检测:1)TNF-α的测定:按照大鼠放射免疫试剂盒说明书,检测TNF-α的水平。2)内毒素的测定:按照鲎试剂盒说明书操作,实验中用的材料均无热原。
1.2.5 Western blot方法检测肺组织NF-κB蛋白表达:取100 mg肺组织,用冰冷的PBS漂洗2次,置于匀浆器中,然后加入1 mL改良的RIPA(radioimmune precipitation assay,RIPA)裂解缓冲液(50 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,1% NP-40,0.5%脱氧胆酸钠,0.1%SDS,1 mmol/L EDTA,1 mmol/L PMSF,2 mg/L leupeptin),充分研磨以充分裂解组织,冰上静置30 min,低温高速10 000×g离心15 min,收集上清,考马斯亮蓝比色法测定蛋白含量。取150 μg蛋白,进行10%SDS-PAGE分离,转膜,分别用兔抗NF-κB单克隆抗体(1∶200稀释)、兔抗 GAPDH 抗体(1∶250稀释),二抗(1∶2 000稀释)与硝酸纤维素膜杂交。然后将膜置于鲁米那ECL中1 min,曝光,显影,定影。采用 BandScan图像分析软件对Western blot结果进行定量分析,灰度值以积分吸光度值(Integral Absorbance,IA)表示,结果以目的蛋白与GAPDH的IA的比值表示。
1.3 统计学分析
2 结果
2.1 肺组织病理变化
HE染色显示,假手术组:肺泡呈半球形的小囊,壁薄,相邻肺泡之间可见由薄层结缔组织构成的肺泡隔。胆总管结扎组:大鼠肺脏肺泡隔增宽,肺间质内炎性反应明显,可见巨噬细胞,肺间质毛细血管密度有所增加,提示肺间质血管扩张、充血,部分区域的肺泡腔变小。干预组:肺脏毛细血管轻度扩张,肺泡间隔轻度增宽(图1)。
2.2 动脉血气分析检测
CBDL术后 2周,肺泡-动脉氧分压梯度差[P(A-a)O2]即明显升高,高于假手术组(P<0.05),抗 TNF-α单克隆抗体干预治疗后1周与CBDL术后同周组比较,肺泡-动脉氧分压梯度差[P(A-a)O2]有所下降,之后呈下降趋势,至干预治疗后3周与同周CBDL组比较有明显差异(P<0.05)。但仍高于同周sham组(P<0.05)(表1)。
2.3 血浆内毒素检测
CBDL术后1周,血浆内毒素水平明显升高(P<0.05),抗TNF-α单克隆抗体干预治疗后1周,血浆内毒素水平开始明显下降,且与同周CBDL组比较明显降低(P<0.05)。之后逐渐下降,但仍高于同周sham组(P<0.05)(表2)。
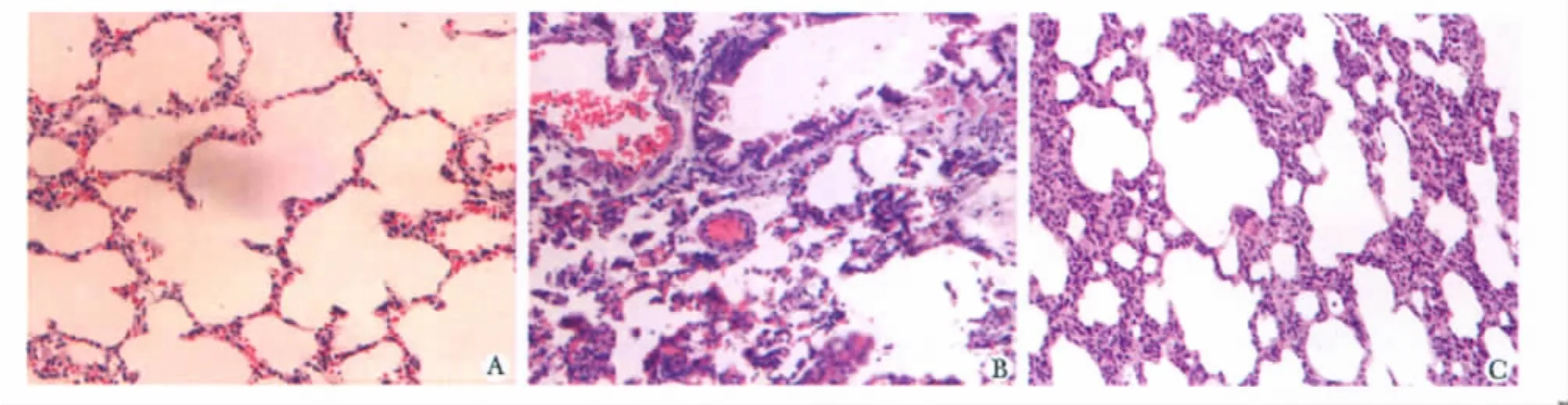
图1 肺组织病理变化Fig 1 Histopathological changes in lung(HE×200)
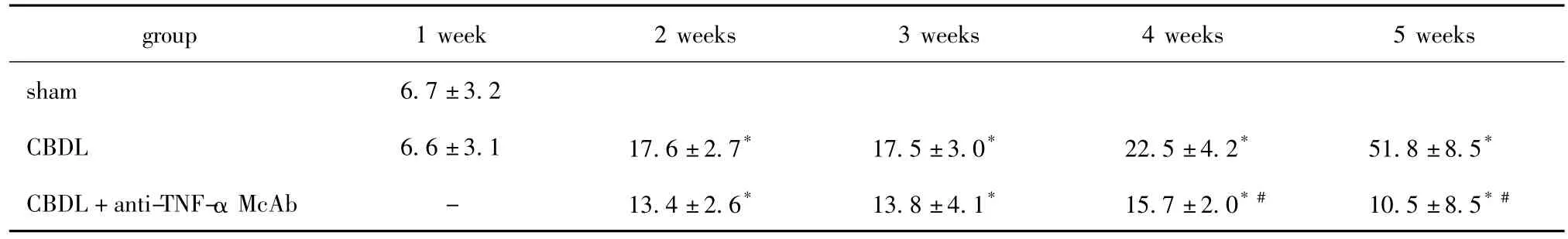
表1 CBDL术后不同时间各组P(A-a)O2水平Table 1 The level of P(A-a)O2at various time points(mmHg,x±s,n=6)

表2 CBDL术后不同时间各组血清内毒素水平Table 2 The level of plasma ETX at various time points(EU/L,x ± s,n=6)

表3 CBDL术后不同时间各组血浆TNF-α水平Table 3 The level of plasma TNF-α at various time points(ng/mL,x ± s,n=6)
2.4 血浆TNF-α检测
CBDL术后1周,血浆 TNF-α水平即升高,至CBDL术后3周时达峰值;抗TNF-α单克隆抗体干预治疗后1周即开始明显降低,且与同周CBDL组比较有明显差异(P<0.05)。之后继续下降,至干预治疗后4周仍高于同周sham组(P<0.05)(表3)。
2.5 肺组织NF-κB蛋白表达检测
CBDL后,随着结扎时间延长肺组织NF-κB蛋白表达逐渐增加,术后2周(0.76±0.24)即显著高于sham组(0.43±0.16),至结扎第3周(0.93±0.23)达高峰,后逐渐下降,但仍比sham组表达水平高(P<0.05)。抗TNF-α单克隆抗体干预治疗后2周(0.67±0.15)开始明显下降,至干预第2周(0.75±0.18)与同周 CBDL组(0.93±0.23)比较(P<0.05)。之后在此水平波动,仍高于sham组(P<0.05)(图2)。
3 讨论
HPS是慢性肝病的严重并发症[3],目前研究认为在 HPS形成过程中,伴随着 IETM 的产生[4],TNF-α是IETM的主要介导因子,内毒素血症通过上调TNF-α从而诱导单核/巨噬细胞及其核转录因子NF-κB激活,肺血管内巨噬细胞的集聚和浸润,导致瀑布样级联反应,大量细胞因子的释放[5],从而导致肺血管的扩张,导致HPS发病率及严重程度增加[6-7]。
NF-κB是细胞中一个重要的转录因子,活化后可特异地结合κB位点,从而激活相关基因的转录表达[8]。离体研究表明,诸多炎性介质编码基因的增强子或启动子上多存在κB位点,并受NF-κB的转录调控。目前比较明确的受NF-κB调控的靶基因包括细胞因子、急性期反应蛋白、黏附分子、巨噬细胞集落刺激因子及单核细胞趋化蛋白MCP1/JE等[9-10]。

图2 肺组织NF-κB蛋白表达Fig 2 The expression of p65 NF-κB(65 ku)protein of lung tissue by Western blot(x ± s,n=6)
本研究结果发现大鼠CBDL术后血浆内毒素水平、TNF-α水平显著升高,大鼠肺组织 NF-κB蛋白表达随着TNF-α的升高而升高,肺泡-动脉氧分压梯度差P(A-a)O2也显著升高,肺病理变化明显,提示TNF-α是HPS形成过程中重要介导因子。
TNF-α的生物学活性是通过与 TNF-α受体(TNF-R)结合而发挥的[11]。抗 TNF-αMcAb 能中和循环中的TNF-α,阻断TNF-α的作用。
本研究成功地建立了HPS模型。在CBDL术后1周,开始用抗TNF-αMcAb干预治疗。结果表明,早期应用抗TNF-αMcAb干预治疗,改善了肺组织的炎性反应,肺泡-动脉氧分压梯度差P(A-a)O2有明显下降,此过程中血浆TNF-α水平及肺组织NF-κB蛋白表达均下降,从而为抗TNF-αMcAb应用于临床治疗HPS提供依据。
[1]Ho V.Current concepts in the management of hepatopulmonary syndrome[J].Vasc Health Risk Manag,2008,4:1035-1041.
[2]Gill SS,Suri SS,Janardhan KS,et al.Role of pulmonary intravascular macrophages in endotoxin-induced lung inflammation and mortality in a rat model[J].Respir Res,2008,9:69-80.
[3]Fallon MB,Krowka MJ,Brown RS,et al.Impact of hepatopulmonary syndrome on quality of life and survival in liver transplant candidates[J].Gastroenterol,2008,135:1168-1175.
[4]Zhang HY,Han DW,Su AR,et al.Intestinal endotoxemia plays a central role in development of hepatopulmonary syndrome in a cirrhotic rat model induced by multiple pathogenic factors[J].World J Gastroenterol,2007,13:6385-6395.
[5]李立萍,张建新,李兰芳.L-精氨酸对脂多糖诱导大鼠肺损伤的保护作用及其机制的研究[J].中国应用生理学杂志,2010,26:91 -93.
[6]Zhang J,Luo B,Tang L,Wang Y,et al.Pulmonary angiogenesis in a rat model of hepatopulmonary syndrome[J].Gastroenterol,2009;136:1070 -1080.
[7]Park HJ,Kim IT,Won JH,et al.Anti-inflammatory activities of ent-16alphaH,17-hydroxy-kauran-19-oicacid isolated from the roots of siegesbeckia pubescens are due to the inhibition of iNOS and COX-2 expression in RAW 264.7 macrophages via NF-kappaB inactivation[J].Eur J Pharmacol,2007,558:185 -193.
[8]李琪,周向东.TNF-α与香烟烟雾在诱导气道上皮细胞系黏蛋白表达的相互作用[J].基础医学与临床,2009,29:1139-1143.
[9]Matthias A,Banbury L,Stevenson LM,et al.Alkylamides from echinacea modulate induced immune responses in macrophages[J].Immunol Invest,2007,36:117 - 130.
[10]Kielland A,Carlsen H.Molecular imaging of transcriptional regulation during inflammation[J].J Inflamm,2010,7:20-31.
[11]张洁;邱劲;娄晋宁,等.TNF-αⅠ型受体对小鼠脑血管内皮细胞iNOS和HO-1基因表达的影响[J]基础医学与临床,2005,25:507-511.
The treatment of hepatopulmonary syndrome using anti-tumor necrosis factor-α monoclonal antibody in rats
FENG Ying-mei1,2,LIU Li1,LIU Nan1,ZHAO Zhi1
(1.Dept.of Gastroenterology,the Second Hospital,Hebei Medical University,Shijiazhuang 050000;2.the First Hospital of Xinji,Xinji 052360,China)
ObjectiveTo study the effects of anti-tumor necrosis factor-α monoclonal antibody on the expression of NF-κB on hepatopulmonary syndrome in rats and the effects of NF-κB in treating hepatopulmonary syndrome in rats with anti-tumor necrosis factor-α monoclonal antibody.MethodsThe experimental models of HPS in rats were developed with commom bile duct ligation,and then were injected with anti-TNF-αMcAb(0.1 mg/kg·2 d)intraperitoneally,Lung histopathological changes were evaluated by hematoxylin and eosin staining;TNF-α concentration in plasma was measured by radioimmunity method;The endotoxin in the plasma was checked by tachypleus amebocyte lysate kit;Hepatopulmonary syndrome was assessed by measurements of alveoloarterial oxygen difference(P(A-a)O2).Western blot was employed to investigate the expression and the changes of NF-κB in hepatopulmonary rat lungs.ResultsCompared with the CBDL group,there was a gentle vasodilatation and widen interalveolar septum in lung in anti-TNF-αMcAb treament group,the level of the P(A-a)O2was significantly lower(P<0.05).The concentration of ETX and TNF-α were significantly lower(P<0.05).The expression of NF-κB in CBDL+anti-TNF-α McAb group(0.75±0.18)decreased obviously than those in CBDL group(0.93±0.23)(P<0.05).ConclusionsAnti-tumor necrosis factor-α antibody can reduce the expression of NF-κB and attenuate the severity of hepatopulmonary syndrome through downregulateing the expressiion of NF-κB.
TNF-α;anti-TNF-αMcAb;hepatopulmonary syndrome;NF-κB
R 575.2
A
1001-6325(2012)01-0061-05
2010-12-27
2011-06-09
河北省医学科学研究重点课题(08080)
