吡咯烷二硫代氨基甲酸酯减轻2型糖尿病大鼠胰岛β细胞氧化损伤
2012-06-05丁海燕赵瑞景尹小妹刘桂红刘建坤朱铁年
丁海燕,赵瑞景,尹小妹,刘桂红,刘建坤,朱铁年*
(1.中国人民解放军白求恩国际和平医院肿瘤科,河北石家庄 050082;2.河北医科大学内科学教研室,河北石家庄 050017;3.河北医科大学免疫学教研室,河北石家庄 050017)
吡咯烷二硫代氨基甲酸酯减轻2型糖尿病大鼠胰岛β细胞氧化损伤
丁海燕1,2,赵瑞景3,尹小妹1,刘桂红1,刘建坤1,朱铁年1*
(1.中国人民解放军白求恩国际和平医院肿瘤科,河北石家庄 050082;2.河北医科大学内科学教研室,河北石家庄 050017;3.河北医科大学免疫学教研室,河北石家庄 050017)
目的 探讨吡咯烷二硫代氨基甲酸酯(PDTC)对2型糖尿病大鼠胰岛β细胞氧化损伤的影响及其机制。方法 用长期高脂饮食加小剂量链脲佐菌素(STZ,27 mg/kg)建立2型糖尿病大鼠模型。PDTC治疗组大鼠每天腹腔注射PDTC(50 mg/kg)1次,1周后取血浆检测血糖。取胰腺组织匀浆测定丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-PX)的含量;应用免疫组化和Western blot等检测胰腺组织中诱生型一氧化氮合酶(iNOS)的表达及硝基化酪氨酸(NT)的水平;流式细胞术检测胰岛β细胞凋亡百分率。结果 糖尿病大鼠血糖、MDA水平均显著高于对照组(P<0.01);SOD和GSH-PX水平明显低于对照组(P<0.01);胰岛组织中iNOS表达水平(0.37±0.06)和NT生成量(0.24±0.01)均较对照组(0.11±0.01)和(0.12±0.01)明显增多(P<0.01)。PDTC治疗后血糖明显降低,MDA明显减少(P<0.01);而SOD、GSH-PX水平明显升高(P<0.05,P<0.01);胰岛组织中iNOS表达及NT生成均明显减少(P<0.01);胰岛β细胞凋亡率明显降低(P<0.05)。结论 PDTC可以减轻大鼠体内氧化应激反应,减少糖尿病大鼠胰岛β细胞的凋亡。
PDTC;糖尿病;氧化损伤;胰岛β细胞;凋亡
*通信作者(corresponding author):zhutienian@medmail.com.cn
2 型糖尿病(type 2 diabetes mellitus,T2DM)是以慢性高血糖为主要特征的代谢性疾病。由于体内氧化和抗氧化作用失衡引起氧化应激导致胰岛β细胞数量减少是糖尿病发生发展的一个重要机制,其中胰岛β细胞凋亡异常增多是导致胰岛β细胞数量减少的重要原因[1-2]。本实验旨在通过高脂饮食加小剂量链脲佐菌素(STZ)建立2型糖尿病模型,观察胰腺组织氧化应激指标的变化,探讨PDTC抑制胰岛β细胞凋亡的可能机制。
1 材料与方法
1.1 材料
1.1.1 动物:清洁级雄性Wistar大鼠37只,体质量180~210 g[河北医科大学动物中心,许可证号(冀)2008-1-003]。
1.1.2 主要试剂:吡咯烷二硫代氨基甲酸酯(PDTC)、链脲佐菌素(STZ)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)和丙烯酰胺(Acrylamide)(Sigma公司);超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒和丙二醛(MDA)测定试剂盒(南京建成生物工程研究所);Rabbit Anti-iNOS IgG多克隆抗体和辣根过氧化物酶(HRP)标记驴抗兔IgG(Santa Cruz公司);PV6001试剂盒、PV6002试剂盒、DAB染色剂(北京中杉金桥生物技术有限公司);Rabbit Anti-β-Tubulin抗体(北京博奥森生物技术有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所)。
1.2 方法
1.2.1 T2DM大鼠模型的建立:参照 Reed等[3]方法建立T2DM大鼠模型。37只雄性Wistar大鼠,适应性喂养1周后随机分为2组:对照组(control)12只,给予普通饮食喂养;高脂饮食组25只,给予高脂饮食喂养,脂肪供能占总热量的42%。每周检测大鼠的体质量及血糖变化。喂养8周后,高脂饮食组通过口服葡萄糖耐量实验(OGTT)和胰岛素敏感性实验证实产生胰岛素抵抗后,过夜禁食12 h,给予STZ(27 mg/kg)一次性腹腔注射,3 d后随机血糖≥16.7 mmol/L者为T2DM模型成功。将成模大鼠随机分为糖尿病组(DM)和PDTC治疗组(PDTC)各12只,PDTC组大鼠每日腹腔注射PDTC 50 mg/kg,对照组和糖尿病组大鼠每日给予同体积的0.9%氯化钠注射液腹腔注射,连续注射1周后,处死各组大鼠,留取血浆及胰腺组织用于后续指标检测。
1.2.2 血糖测定:采用葡萄糖氧化酶法测定血糖。
1.2.3 胰腺组织氧化损伤指标的测定:按照试剂盒说明采用硫代巴比妥酸(TBA)微量法测定MDA含量;黄嘌呤氧化酶法测定 SOD活性;比色法测定GSH-PX活性。
1.2.4 胰岛β细胞凋亡检测:胰腺组织经70%乙醇固定后,搓网法制备单细胞悬液,经Insulin-FITC联合碘化丙啶(PI)染色后,用流式细胞仪检测胰岛β细胞凋亡百分率。实验管加anti-Insulin-FITC和PI,同时设加lgG-FITC和PI的同型对照管。anti-Insulin-FITC阳性者为分泌胰岛素的胰岛细胞,PI阳性者为凋亡的细胞。anti-Insulin-FITC和PI双阳性者为凋亡的胰岛β细胞。
1.2.5 HE染色观察大鼠胰腺组织病理学改变:各组大鼠胰腺组织分别进行石蜡切片,常规HE染色,在光镜下观察胰腺组织形态学变化。
1.2.6 免疫组化观察大鼠胰腺组织内iNOS表达及NT的生成:取各组大鼠胰腺组织进行石蜡包埋、切片,行iNOS和NT免疫组化染色观察iNOS的表达和NT的生成。
1.2.7 Western blot测定各组大鼠胰腺组织中iNOS的表达水平:冰上称取100 mg胰腺组织加入液氮,在预冷的研钵中研碎,加500 μL RIPA裂解液(25 mmol/L Hepes,134 mmol/L NaCl,1%NP-40,0.1%SDS,1 mmol/L钒酸盐,0.5%脱氧胆酸钠,100 mmol/L NaF)提取组织蛋白。蛋白定量后与上样缓冲液混匀,煮沸10 min,每份样品取40 μg蛋白上样,经10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,并将其转移至PVDF膜上。用含5%脱脂奶粉的封闭液室温封闭2 h后,加入兔抗iNOS一抗(1∶500稀释),4℃孵育过夜。经HRP标记的驴抗兔二抗(1∶2 000)室温孵育1.5 h,加入ECL发光底物,压X线胶片,曝光显影,应用Image J图像分析系统对蛋白条带进行分析。
1.3 统计学分析
2 结果
2.1 各组大鼠空腹血糖比较
DM组大鼠空腹血糖为(26.55±2.90)mmol/L,明显高于对照组的(5.58±0.43)mmol/L(P<0.01);PDTC治疗1周后,PDTC治疗组大鼠空腹血糖为(11.55±2.89)mmol/L,明显低于DM组(P<0.01),但仍高于对照组(P<0.05)。
2.2 胰腺组织内氧化应激指标变化
糖尿病组SOD、GSH-PX活力明显低于对照组(P<0.01),PDTC治疗后明显回升(P<0.01或P<0.05)。糖尿病组 MDA含量明显高于对照组(P<0.01),PDTC治疗后明显回降(P<0.01)(表1)。
表1 各组胰腺组织内SOD、GSH-PX、MDA含量比较Table 1 Comparison of SOD,GSH-PX and MDA contents in pancreatic tissue in each group( ± s,n=12)

表1 各组胰腺组织内SOD、GSH-PX、MDA含量比较Table 1 Comparison of SOD,GSH-PX and MDA contents in pancreatic tissue in each group( ± s,n=12)
*P<0.01 compared with control group;#P<0.05,##P<0.0 1 compared with DM group.
group SOD(U/mg·prot)GSH-PX(unit of activity)MDA(nmol/mg·prot)control 71.50±3.20 68.11±5.0 1.08±0.10 DM 50.90±6.84* 48.60±2.0* 3.44±0.33*PDTC 61.40±4.94## 54.10±4.10# 2.14±0.13##
2.3 各组胰岛β细胞凋亡率
糖尿病组胰岛β细胞凋亡率为22.44%±5.15%,明显高于对照组的10.35% ±1.95%(P<0.01);PDTC治疗组β细胞凋亡率为12.14%±4.66%,明显低于DM组(P<0.05)(图1)。
2.4 胰腺组织病理学变化
正常对照组胰岛内细胞数量较多,排列整齐,大小一致,分布均匀。糖尿病组胰岛内细胞数量明显减少,分布稀疏,形状不规则,排列紊乱,可见空泡样变。PDTC治疗后胰岛形态较糖尿病组胰岛内细胞明显增多,细胞结构明显改善(图2)。

图1 流式细胞术检测胰岛β细胞凋亡Fig 1 Pancreatic islet cell apoptosis detected by flow cytometry
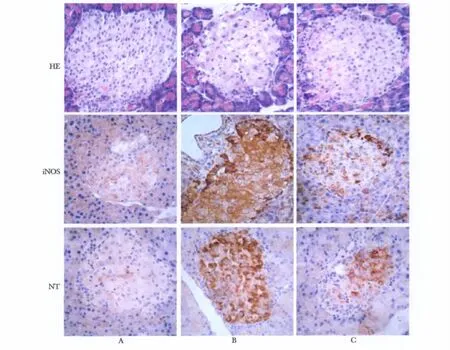
图2 各组大鼠胰腺组织HE染色及免疫组化结果Fig 2 The HE and immunohistochemical staining results in different groups(×400)
2.5 iNOS、NT免疫组化染色结果
糖尿病组大鼠胰岛β细胞胞质中呈强阳性反应,阳性信号呈棕褐色;对照组大鼠胰腺组织中仅见较弱的iNOS、NT阳性反应信号;PDTC组大鼠胰腺组织iNOS、NT阳性反应细胞较糖尿病组明显减少(P<0.01)(图2,3,4)。
2.6 Western blot测定iNOS表达
各组均可见到特异性iNOS蛋白条带。糖尿病组大鼠胰腺组织中iNOS的水平明显高于正常对照组;PDTC治疗后胰腺组织中iNOS表达显著降低(P<0.05)(图5)。
3 讨论

图3 各组大鼠胰腺组织iNOS的表达Fig 3 The expression of iNOS protein in different groups(n=6)

目前糖尿病在各种慢性病病死率中仅位居心脑血管疾病之后,伴随着人口老龄化及肥胖人数的增加,2型糖尿病发病率日益增多。2型糖尿病是在遗传背景基础上,由多种后天因素综合作用而引起,其病理基础为胰岛β细胞功能受损和胰岛素抵抗[4]。2型糖尿病发病过程中,高血糖及高血脂引起的氧化应激是导致胰岛β细胞损伤的重要原因[5],控制血糖,减轻氧化应激可以减缓2型糖尿病的发展,因此,进一步阐明氧化应激引起胰岛β细胞损伤的机制,应用具有抗氧化作用的药物对2型糖尿病的控制具有重要意义。
氧化应激可在各种组织中发生,但由于胰岛β细胞的SOD和GSH-PX等抗氧化酶表达量低,若体内自由基过多可使其耗竭,因此β细胞特别容易受到氧化应激的损害[6]。已有研究证实,在高糖和高脂肪酸的刺激下,线粒体可产生大量活性氧簇(ROS)引起氧化应激,激活转录因子NF-kB,增加iNOS的转录和表达,使NO产生增加,过量的NO与超氧阴离子结合后可生成氧化作用更强的过氧亚硝基阴离子 (Peroxynitrite,ONOO-),引起 DNA氧化断裂,导致细胞凋亡[7]。ONOO-很不稳定,不易检测,但因其可使蛋白质酪氨酸残基或游离酪氨酸发生硝基化反应,形成最终产物硝基酪氨酸(Nitrotyrosine,NT)[8]。因此,可通过检测 NT的生成量间接反映ONOO-的产生水平。
本研究通过检测2型糖尿病大鼠胰岛β细胞的凋亡及胰腺组织中iNOS的表达和NT的生成,初步探讨了氧化应激引起胰岛β细胞凋亡的可能机制以及NF-κB抑制剂PDTC对2型糖尿病胰岛β细胞凋亡的抑制作用。结果发现,糖尿病大鼠胰腺组织中SOD、GSH-PX活性减低,MDA产量升高,表明糖尿病大鼠胰腺组织中氧化、抗氧化平衡严重失调,处于氧化应激状态。PDTC治疗后大鼠胰腺组织内SOD、GSH-PX含量明显回升,MDA含量下降,表明PDTC具有抗氧化,清除自由基和脂质过氧化物作用,进而保护胰岛β细胞。
大量研究已表明,抗氧化剂对胰岛β细胞的功能具有保护作用[9-11]。本实验结果同样证实了PDTC可通过抑制NF-κB的活化,降低iNOS的表达,抑制NO及ONOO-的产生,最终减轻氧化应激诱导的胰岛β细胞凋亡,因此,PDTC有望成为治疗糖尿病的新一代药物。
[1]Kaneto H,Kawamori D,Matsuoka TA,et al.Oxidative stress and pancreatic beta-cell dysfunction[J].Am J Ther,2005,12:529-33.
[2]Chen J,Saxena G,Mungrue IN,et al.Thioredoxin-interacting protein:a critical link between glucose toxicity and beta-cell apoptosis[J].Diabetes,2008,57:938 -944.
[3]Reed MJ,Meszaros K,Entes LJ,et al.A New Rat Model of Type 2 Diabetes:The Fat-Fed,Streptozotocin-Treated Rat[J].Metabolism,2000,49:1390 -1394.
[4] Andrikopoulos S.Obesity and Type 2 diabetes:Slow down!-Can metabolic deceleration protect the islet beta cell from excess nutrient-induced damage?[J].Molecular and Cellular Endocrinology,2010,316:140-146.
[5]Leibowitz G,Bachar E,Shaked E,et al.Glucose regulation of β-cell stress in type 2 diabetes[J].Diabetes,Obesity and Metabolism,2010,12:66-75.
[6]Lenzen S.Oxidative stress:the vulnerable beta-cell[J].Biochem Soc Trans,2008,36:343-347.
[7]Kaneto H,Katakami N,Matsuhisa M,et al.Role of reactive oxygen species in the progression of type 2 diabetes and atherosclerosis[J].Mediators Inflamm,2010:453892.
[8]Drel VR,Pacher P,Stevens MJ,et al.Aldose reductase inhibition counteracts nitrosative stress and poly(ADP-ribose)polymerase activation in diabetic rat kidney and highglucose-exposed human mesangial cells[J].Free Radic Biol Med,2006,40:1454-1465.
[9]Chan JY,Lam FC,Leung PC,et al.Antihyperglycemic and antioxidative effects of a herbal formulation of radix astragali,radix codonopsis and cortex lycii in a mouse model of type 2 diabetes mellitus[J].Phytother Res,2009,23:658-665.
[10]Palsamy P,Subramanian S.Ameliorative potential of resveratrol on proinflammatory cytokines,hyperglycemia mediated oxidative stress,and pancreatic β-cell dysfunction in streptozotocin-nicotinamide-induced diabetic rats[J].J Cell Physiol,2010,224:423 -432.
[11]Robertson RP.Antioxidant drugs for treating beta-cell oxidative stress in type 2 diabetes:glucose-centric versus insulin-centric therapy[J].Discov Med,2010,9:132 -137.
Pyrrolidine dithiocarbamate attenuates pancreatic β-cell oxidative injury in type 2 diabetic rats
DING Hai-yan1,2,ZHAO Riu-jing3,YIN Xiao-mei1,LIU Gui-hong1,LIU Jian-kun1,ZHU Tie-nian1*
(1.Dept.of Medical Oncology,Bethune International Peace Hospital,Shijiazhuang 050082;2.Dept.of Internal Medicine,Hebei Medical University,Shijiazhuang 050017;3.Dept.of Immunology,Hebei Medical University,Shijiazhuang 050017,China)
ObjectiveTo investigate the effect and mechanism of pyrrolidine dithiocarbamate(PDTC)on islet β cell oxidative injury in type 2 diabetic rats.MethodsType 2 diabetic rat model was set up by long-term feeding high-fat foods accompanied with a single intraperitoneal injection of low dose of streptozotocin(STZ,27 mg/kg body weight).The rats in PDTC group were administerd with PDTC(50 mg/kg·d)by intraperitoneal injection.After treatment for 1 week,blood glucose levels were estimated.Malondialdehyde(MDA),Superoxide dismutase(SOD)and glutathione peroxidase(GSH-PX)content in pancreatic tissue was measured.The expression of induc ible nitric oxide synthase(iNOS)and the prouduction of nitrotyrosine(NT)in islet tissue were examined by using immunohistochemistry and Western blot.The rate of pancreatic islet β cell apoptosis was detected by flow cytometry.ResultsThe blood glucose level,MDA content,pancreatic β-cell apoptosis,iNOS expression and NT production were significantly higher,while the SOD and GSH-PX activities were significantly lower in DM group than those in normal control group(P<0.01).After administration of PDTC,The level of blood glucose,MDA content,pancreatic β-cell apoptosis,iNOS expression and NT production were significantly decreased,while the SOD and GSH-PX activities were markedly increased when compared with DM group(P<0.01).ConclusionsPDTC can relieve the oxidative stress reaction of diabetic rats,suppress the expression of iNOS and NT production,and decrease pancreatic islet β cell apoptosis in diabetic rats.
pyrrolidine dithiocarbamate;diabetes;oxidative injury;pancreatic islet β cell;apoptosis
R 587.1
A
1001-6325(2012)01-0036-06
2010-12-27
2011-06-27
河北省自然科学基金(C2009001232);河北省科技支撑计划项目(10276105D-66);河北省卫生厅资助项目(20090168);国家人事部留学人员科技活动项目择优资助项目(2008)
book=41,ebook=94
