小鼠间充质干细胞脂向分化过程中miRNA-143的表达
2012-06-05凌宏艳胡小波奉水东杨丝丝何剑琴张恺芳廖端芳
凌宏艳,胡小波,奉水东,杨丝丝,何剑琴,张恺芳,廖端芳
(南华大学1.生理学教研室;2.生物化学与分子生物学教研室;3.流行病学教研室,湖南衡阳 421001;4.湖南中医药科大学药学院,湖南长沙 410208)
小鼠间充质干细胞脂向分化过程中miRNA-143的表达
凌宏艳1,胡小波2,奉水东3,杨丝丝1,何剑琴1,张恺芳1,廖端芳4*
(南华大学1.生理学教研室;2.生物化学与分子生物学教研室;3.流行病学教研室,湖南衡阳 421001;4.湖南中医药科大学药学院,湖南长沙 410208)
目的 探讨小鼠间充质干细胞(MSCs)脂向分化过程中miRNA-143(miR-143)的表达,为阐明MSCs脂向分化的调控机制提供新线索。方法 采用全骨髓体外分离结合差速贴壁法纯化扩增C57BL/6小鼠MSCs,将第5代MSCs采用脂肪细胞分化诱导剂进行成脂诱导。运用miRNA芯片技术比较MSCs组和脂肪细胞组中miR-143的表达,并通过实时定量PCR技术验证。结果 成功分离、纯化和培养MSCs;MSCs经脂肪诱导剂诱导后,胞内大量脂滴形成,油红O染色阳性。MiRNA芯片及实时定量PCR结果均表明miR-143在MSCs脂向分化过程中显著上调(3.73±0.42 vs 1.00±0.14,P<0.01)。结论 miR-143可能参与调控MSCs的脂向分化。
miRNA-143;间充质干细胞;脂向分化;miRNA芯片;实时定量PCR
*通信作者(corresponding author):dfliao@yahoo.com.cn
脂肪组织工程概念的提出为软组织缺损的修复与重建提供了全新的治疗途径,已成为组织工程研究领域的热点之一[1]。间充质干细胞(mesechymal stem cells,MSCs)是一小群存在于骨髓中的非造血细胞,具有高度的自我更新和多向分化潜能,在适宜的条件下可诱导分化为脂肪细胞、成骨细胞等[2],这些特点使得它成为组织工程理想的种子细胞。微小RNA(miRNA)是新近证明的一类高度保守的、内源性非编码的长度为20~25 nt的RNA,主要在转录后水平调节基因的表达[3]。研究表明miR-143参与人类前脂肪细胞和小鼠3T3-L1细胞分化过程[4-5],但 miR-143 是否参与 MSCs成脂分化过程,目前仍不清楚,为此本研究采用miRNA芯片结合实时定量PCR技术对MSCs脂向分化过程中miR-143的表达变化进行观察。
1 材料与方法
1.1 材料
DMEM培养基、胰蛋白酶和胎牛血清(fetal bovine serum,FBS)(Gibco公司),分化诱导剂1-甲基-3-异丁基黄嘌呤(1-methyl-3-isobuthylxanthine,IBMX)、胰岛素、吲哚美新、地塞米松(dexamethasone,Dex)及油红O(均为Sigma公司)。
1.2 小鼠骨髓MSCs分离和原代培养
取清洁级6~8周龄雄性C57BL/6小鼠10只[体质量18~24 g,由南华大学实验动物中心提供,合格证号SYXK(湘)2004-0011],颈部脱臼处死,用75%乙醇浸泡1min,放置于无菌培养皿内移入超净工作台,在装有PBS液的培养皿内将骨表面附有的肌肉及肌筋膜等清除干净,再用20 mL的PBS清洗1次,移入装有20 mL含 10%胎牛血清、青霉素100 U/mL、链霉素100 mg/L的L-DMEM培养液的培养皿中,将股骨和胫骨用镊子轻轻夹起,将其两端干骺端切除,显露骨髓腔,用一次性10 mL注射器吸取含10%胎牛血清的L-DMEM将骨髓冲出,直至整根骨发白为止。收集细胞混合液于室温下以1 000 r/min,离心5 min;弃上清液及脂肪层,取细胞沉淀。向细胞沉淀中缓慢加入含10%FBS的L-DMEM,吹打成单细胞悬液,计数有核细胞,将细胞以1×106个/mL的浓度接种于 6孔板中,于37℃、5%CO2培养箱中静置培养。24 h后更换新鲜培养液,去除未贴壁细胞,以后每隔2天半量换液1次,用倒置显微镜下观察细胞形态并照相记录。
1.3 小鼠MSCs诱导为脂肪细胞
分别将传至5~7代的小鼠MSCs按2×105/mL浓度接种于6孔板,细胞达到完全汇合后,加入脂肪细胞诱导液(含1 μmol/L地塞米松、0.5 mmol/L IBMX、10 mg/L胰岛素、100 mmol/L吲哚美新、10%FBS的 DMEM 培养液)2 mL,诱导3 d,再用含10 μg/mL胰岛素、10%FBS的 DMEM 培养液处理1 d,如此循环3次后,用含10 mg/L胰岛素、10%FBS的DMEM培养液处理7~9 d,每隔3~4 d换液1次。
1.4 油红O染色
诱导3周后细胞用PBS洗涤3次,每次5 min,60%异丙醇固定15 min,油红O染色10 min,蒸馏水冲洗3次,每次1 min,苏木素浅染核,1%盐酸水稍分色及返蓝后,水性封片剂封片。显微镜下观察,细胞内脂质被特异性的染为红色,细胞核呈蓝色,染色后观察并拍照。
1.5 miRNAs基因芯片实验
miRNA基因芯片表达谱检测采用丹麦Exiqon公司8.0版的小鼠miRNAs芯片。Exiqon公司8.0版的芯片上固定的探针包括与人(328个)、小鼠(274个)、大鼠(238个)miRNAs精确配对的探针、对照探针以及错配探针,可以检测Sanger miRBase数据库8.0版中所有已知的人、小鼠、大鼠和其他物种的miRNAs。本实验中分别用TRIZOL处理MSCs和MSCs来源的脂肪细胞,由上海康成生物公司进行miRNA芯片杂交。基因表达谱芯片的检测步骤包括总RNA的提取与鉴定、miRNA标记及miRNA芯片杂交等步骤,最后芯片扫描获得TIFF图后,使用Genepix Pro 6.0软件分析数据,以芯片中的内对照荧光值为参照,分别计算实验组和对照组的比值。
1.6 实时定量PCR验证miRNA芯片结果
从MSC和脂肪细胞中提取总RNA,并进行反转录合成cDNA。应用LightCycler定量PCR仪(Bio Rad公司)进行定量PCR检测,每个样品设3个复孔,所有反应均重复3次。实时定量PCR引物应用Primer Premier 5.0设计,由上海生工生物工程有限公司合成。miR-143引物序列:上游:5'-TGAGATGA AGCACTGTAGCTC-3',下游:5'-GCGAGCACAGAA TTAATACGAC-3',同时以U6 snRNA作为内参基因,上游为5'-CGCTTCGGCAGCACATATAC-3',下游5'-TTCACGAATTTGCGTGTCAT-3'。反应条件:95℃5 min,40 个 PCR 循环(95℃ 10 s,60℃ 1 min)。按照据公式 2-ΔΔCt计算相对的 miRNA 基因表达[6]。
1.7 统计学分析
2 结果
2.1 小鼠MSCs形态学观察
倒置显微镜下观察,原代培养细胞刚接种时混有较多的单个核细胞,原代培养24 h后细胞贴壁生长,呈圆形,折光性强(图1A)。换液后悬浮细胞减少,细胞零星贴壁,呈梭形,连续换液3~4次后,无悬浮细胞存在,贴壁细胞增多,成旋涡状生长。原代细胞培养8~10 d后,消化传代,传代细胞贴壁较快,刚传代的细胞呈圆形;2 h后细胞开始贴壁,细胞形态由圆形向梭形转化;24 h后开始增殖,细胞集落增多,5 d后可传代,第5代以后,细胞形态趋于一致,基本上未见杂细胞(图1B)。
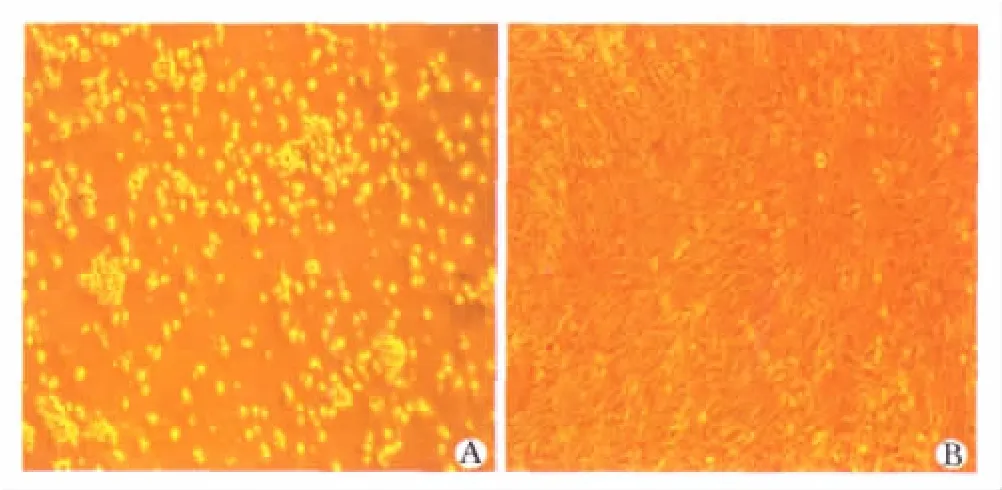
图1 MSCs的形态Fig 1 Morphology of MSCs(×4)
2.2 小鼠MSCs诱导分化为脂肪细胞
MSC诱导后第5天无明显脂滴出现,随着诱导时间的延长,含胞内脂滴逐渐增多,细胞体积逐渐增大,由原来的长梭形变为圆形或多角形,到诱导分化的21 d,大多数MSC均诱导为脂肪细胞。油红O染色可见脂肪细胞中含大小不等的脂肪滴,细胞核被脂滴挤于细胞一侧,脂滴被染成橙红色,胞核为蓝色(图2)。
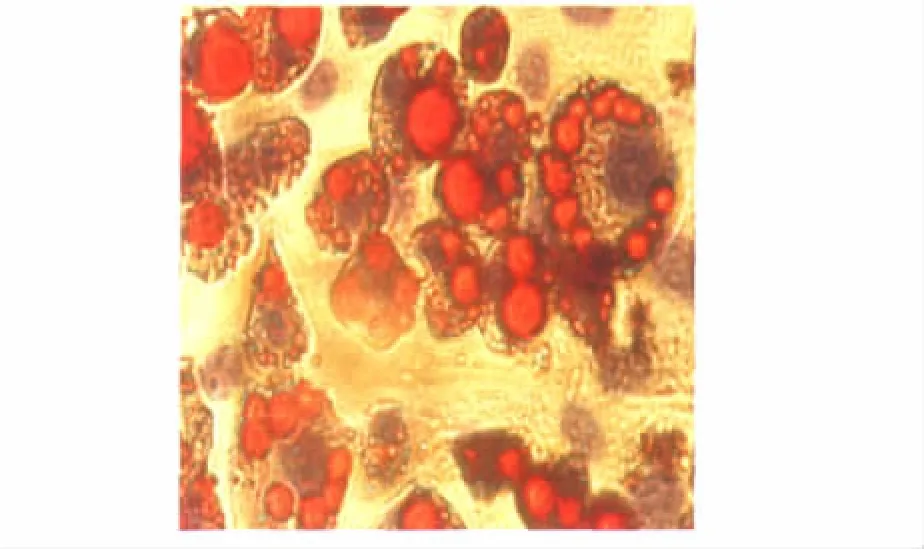
图2 骨髓间充质干细胞分化成脂肪细胞的形态Fig 2 Morphology of adipocytes differentiated from MSCs(×40)
2.3 miRNAs基因芯片杂交结果
miR-143在MSCs来源的脂肪细胞和MSCs中表达水平分别为6.193和0.882(比值为7.02),结果显示miR-143显著上调。
2.4 实时定量PCR结果
脂肪细胞组miR-143的相对表达量为3.73±0.42,与对照MSCs组(1.00±0.14)相比显著上调(P<0.01),与miRNA芯片结果相一致。
3 讨论
MiRNA是一类新近发现的单链小分子RNA,在生物体生长、发育和疾病发生过程中发挥重要作用[3,7-8]。研究发现 miRNA 除参与 3T3-L1 前脂肪细胞分化外[4-5,9-10],还参与胚胎干细胞分化过程[11],提示miRNA也可能参与MSCs成脂分化。由于MSCs具有较强的黏附性,本研究采用贴壁筛选法分离MSCs,通过传代得以扩增和纯化,最终变成形态均一的梭型样细胞。随后将该细胞用IBMX、地塞米松、吲哚美辛和胰岛素处理21 d,通过油红O染色发现绝大多数细胞呈现脂肪细胞表型。由此证实本研究分离出来的细胞是MSCs,且MSCs成功诱导分化成脂肪细胞,为下一步miRNAs芯片实验奠定了基础。
尽管已有研究报道miR-143可促进前脂肪细胞分化[4-5],且 ERK5 可能是 miR-143 的靶基因之一[4]。但由于脂肪细胞来源于MSCs定向分化,且目前暂未见MSCs脂肪分化中miRNA变化的相关文献报道。为了更清楚全面了解miRNA对脂肪细胞分化的调控情况,本研究利用miRNA芯片高通量、高敏感性的特点,采用荧光标记的miRNAs直接与miRNAs检测芯片杂交,观察MSCs脂向分化过程中miR-143表达。结果显示,小鼠MSCs分化成脂肪细胞后miR-143显著上调。随后通过实时定量PCR进行验证,结果与 miRNA芯片一致,提示miR-143可能参与MSCs成脂分化,其具体作用机制尚不清楚,需进一步研究。
总之,本研究运用miRNAs芯片结合实时定量PCR技术,证明了miR-143与MSCs的脂向分化密切相关,为下一步研究miRNA在MSCs脂向分化中的作用及其机制奠定了基础,为阐明MSCs脂向分化的分子调控机制提供了新的线索,为促进脂肪组织工程的发展及软组织损伤修复与重建的临床运用提供依据。
[1]Gomillion CT,Burg KJ.Stem cells and adipose tissue engineering[J].Biomaterials,2006,27:6052 -6063.
[2]Jiang YH,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418:41-49.
[3]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281 -297.
[4]Esau C,Kang X,Peralta E,et al.MicroRNA-143 regulates adipocyte differentiation[J].J Biol Chem,2004,279:52361-52365.
[5]Kajimoto K,Naraba H,Iwai N.MicroRNA and 3T3-L1 pre-adipocyte differentiation[J].RNA,2006,12:1626-1632.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)]method[J].Methods,2001,25:402 -408.
[7] Perera RJ,Ray A.MicroRNAs in the search for understanding human diseases[J].Bio Drugs,2007,21:97 -104.
[8]宋宝,宋现让,刘杰,等.miRNAs及其靶基因的识别[J].基础医学与临床,2007,27:1063-1065.
[9]Wang Q,Li YC,Wang JH,et al.miR-17-92 cluster accelerates adipocyte differentiation by negatively regulating tumor-suppressor Rb2/p130[J].Proc Nati Acad Sci USA,2008,105:2889-2894.
[10]Ling HY,Wen GB,Feng SD,et al.MiRNA-375 promotes 3T3-L1 adipocyte differentiation via modulation of ERK signaling[J].Clin Exp Pharmacol Physiol,2011,38:239-246.
[11]Murchison EP,Partridge JF,Tam OH,et al.Characterization of Dicer-deficient murine embryonic stem cells[J].Proc Nati Acad Sci USA,2005,102:12135-12140.
The expression of miRNA-143 during adipogenic differentiation of mouse MSCs
LING Hong-yan1,HU Xiao-bo2,FENG Shui-dong3,YANG Si-si1,HE Jian-qin1,ZHANG Kai-fang1,LIAO Duan-fang4*
(1.Dept.of Physiology;2.Dept.of Biochemistry and Molecular Biology;3.Dept.of Epidemiology,University of South China,Hengyang 421001;4.School of Pharmacy,Hunan University of Chinese Medicine,Changsha 410208,China)
ObjectiveTo investigate the expression of miR-143 during adipogenic differentiation of mesechymal stem cells(MSCs)in mice,and provide new clues to clarify the regulation mechanisms of MSCs'adipogenic differentiation.MethodsThe MSCs of C57BL/6 mice were isolated,cultured by using the whole bone marrow method,amplified by the differential adherent method,and adipogenic differentiation of the fifth generation of MSCs was induced with the adipogenic medium.We used the microRNA microarray to explore the expression of miR-143 in the MSCs group and adipocytes group,and validated it by real-time quantitative polymerase chain reaction(real-time PCR).ResultsWe got high-purity MSCs and Oil O staining showed that lipid droplets were increased in MSCs treated with adipogenic conditions.The miR-143 was up-regulated during adipogenic differentiation showed by microRNA microarray analysis and confirmed by using real-time PCR(3.73±0.42 vs 1.00±0.14,P <0.01).ConclusionsMiRNA-143 may regulatie the adipogenic differentiation of MSCs.
miR-143;mesenchymal stem cells;adipogenic differentiation;microRNA microarray;real-time PCR
R 329.28;R 318;R 587.1
A
1001-6325(2012)01-0012-04
2011-03-21
2011-07-20
国家自然科学基金(81000328,30971170);南华大学博士科研启动基金(2010XQD39)
