MRI三维动态增强与扩散加权成像在子宫内膜癌分期与分级中的应用
2012-06-05董冰,白人驹
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,占女性生殖系统恶性肿瘤的20%~30%,约占女性癌症的7%[1],高发年龄为50~64岁。近年子宫内膜癌发病率在世界范围内呈上升趋势及年轻化趋势[2],其预后与肿瘤的细胞学类型、病理分级、分期和患者自身因素等相关,其中肿瘤的病理分级和分期,尤其是肌层浸润深度与选择合理的治疗方案密切相关,且其与宫外侵犯和淋巴结转移的发生率关系密切。因此,术前准确判断子宫内膜癌的病理分期和分级对治疗和预后极为重要。MR是子宫内膜癌术前分期的最佳成像方法。本研究回顾性分析73例经手术病理证实的子宫内膜癌的术前MR资料,探讨3D肝脏容积加速采集(liver acquisition with volume acceleration, LAVA)动态增强检查及扩散加权成像(DWI)的定量指标表观扩散系数(ADC)在子宫内膜癌分期和分级中的应用价值。
1 资料与方法
1.1 研究对象 2009-02~2011-03天津医科大学总医院收治73例子宫内膜癌患者,均经全子宫切除术后病理证实,年龄33~85岁,平均(60±12)岁;绝经后57例,未绝经16例;主要症状为绝经后不规则阴道出血,未绝经者表现为经量增多、经期延长或月经间期阴道出血。所有患者均无MR检查禁忌证,且检查前均未行放、化疗。MR检查与手术时间间隔3~7d,平均(4±1)d。
1.2 仪器与方法 采用GE 3.0T HDx超导型MRI系统及Torsopa盆腔相控阵表面线圈。常规MRI序列:①矢状位及轴位T2WI,采用快速自旋回波(FSE)序列,层厚6mm,间隔1mm,矢状位TR/TE 2300~2700ms/116.1~123.7ms,轴位TR/TE 2300~3000ms/85.9~120.6ms;②T1WI动态增强扫描LAVA序列,应用阵列空间敏感编码技术(array spatial sensitivity encoding technique, ASSET),TR/TE 3.3~3.6ms/1.4~1.6ms,层厚2.2mm,间隔1.1mm,采用压力注射器经肘前静脉以2.5~3.0ml/s注入Gd-DTPA,剂量0.2mmol/kg,分别于注药后30s、60s、120s、180s行屏气扫描。DWI采用并行ASSET和单次激发SEEPI序列,行轴位检查,TR/TE 3500/66.0~79.6ms,层 厚6mm, 间 隔1mm,FOV 38~42cm, 矩 阵128×128,激励次数(NEX)4,b值取0、1000s/mm2,在X、Y、Z轴3个方向上施加敏感梯度脉冲。DWI和轴位T2WI各断面的位置保持一致。
1.3 图像分析及后处理
1.3.1 LAVA图像分析 由2位副主任医师行双盲法阅片,以2009年FIGO新分期[3]为标准:Ⅰa期:局限于内膜或侵犯浅肌层;Ⅰb期:侵犯深肌层;Ⅱ期:侵犯宫颈纤维基质但未超出子宫。以肿瘤外缘到子宫浆膜层的最小距离(即未被肿瘤侵犯的肌层最小厚度)与子宫肌层总厚度的比值评价肌层浸润深度,两者之比>1/2为侵犯浅肌层,≤1/2为侵犯深肌层。以手术病理结果为标准,计算LAVA对肿瘤分期(Ⅰa、Ⅰb、Ⅱ期)的敏感性、特异性、准确性、阳性预测值、阴性预测值。鉴于内膜癌与正常肌层的对比噪声比于增强检查延迟期或平衡期最大[4,5],上述判断深度标准主要参考180s时相。
1.3.2 DWI图像后处理 将所得DWI图像传输至AW4.2工作站,采用Function 2.0软件包对DWI图像进行后处理,获得ADC图。由一位副主任医师完成ADC值测量。参考轴位T2WI图像,于病灶最大径线层面,且尽量避开出血、坏死或含气区,选取3个不同的位置划定尽可能大的圆形或椭圆形感兴趣区(ROI),计算子宫内膜癌病灶的平均ADC值。再以相同面积的ROI测量同层面右侧臀小肌的ADC值。
1.4 统计学方法 采用SPSS 17.0软件,计数资料数据以±s 表示,行方差齐性检验后,不同级别间臀小肌平均ADC值及各级别内膜癌ADC值采用方差分析,两两比较采用LSD检验,P<0.05表示差异有统计学意义。
2 结果
2.1 子宫内膜癌的LAVA动态增强表现 在LAVA各时相上,子宫内膜癌病灶均呈轻度渐进性强化,信号强度始终低于明显强化的正常肌层,于180s时与正常子宫肌层对比最为显著。
2.2 LAVA动态增强检查判断子宫内膜癌分期结果LAVA动态增强检查判断Ⅰ期肌层浸润深度的准确率为90.6%(48/53),总的诊断准确率为91.1%(51/56)。LAVA动态增强检查判断子宫内膜癌分期与术后病理结果比较见表1、图1,LAVA动态增强检查对Ⅰa、Ⅰb、Ⅱ期肿瘤的敏感性、特异性、准确性、阳性预测值、阴性预测值见表2。
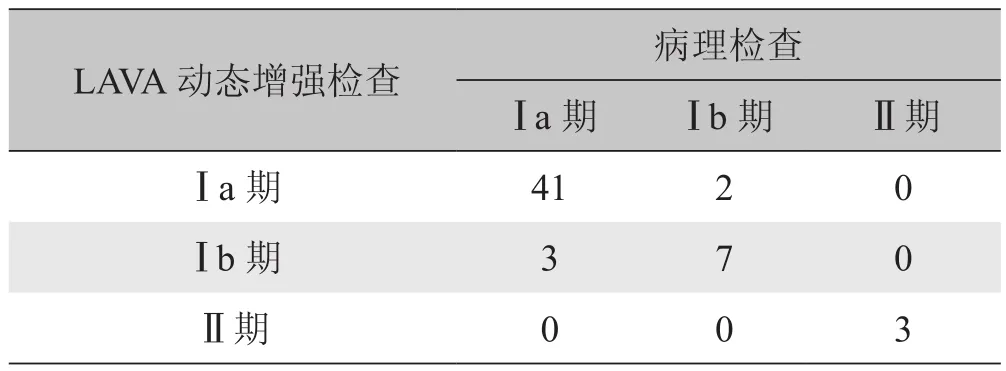
表1 LAVA动态增强检查判断子宫内膜癌分期与术后病理结果比较(例)
2.3 DWI图像结果 所有DWI图像质量均可靠,可用于测量ADC值。病理结果显示,行DWI检查的41例子宫内膜癌均为子宫内膜样腺癌,其中高分化(G1)20例,中分化(G2)14例,低分化(G3)7例。G1、G2、G3患者右侧臀小肌ADC值分别为(0.13±0.01)×10-3mm2/s、(0.14±0.01)×10-3mm2/s、(0.14±0.01)×10-3mm2/s,差异无统计学意义(F=0.786,P>0.05)。各级别内膜癌ADC值差异有统计学意义(F=29.842,P<0.001),各级别两两比较差异均有统计学意义(P<0.01)。各级别内膜癌病灶ADC值见图 2、3。
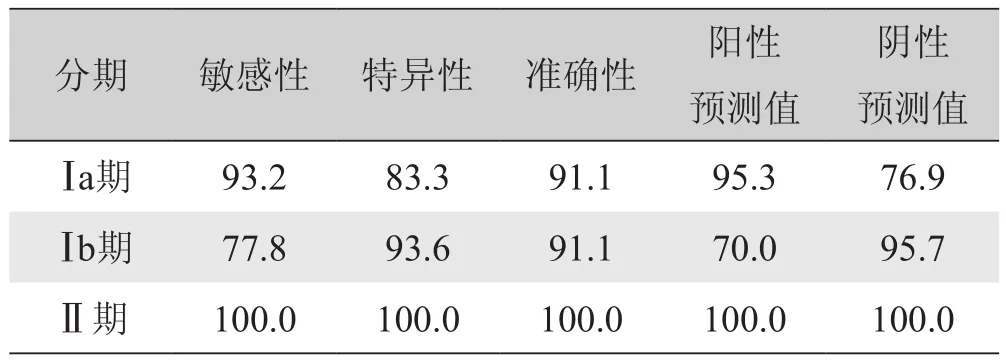
表2 LAVA动态增强检查判断子宫内膜癌不同分期的敏感性、特异性、准确性、阳性预测值、阴性预测值(%)

图1 A.Ⅰa期子宫内膜癌,宫腔内见轻度强化肿块,侵犯深度小于全肌层厚度的1/2(箭);B.Ⅰb期子宫内膜癌,宫腔内轻度强化肿块侵犯后壁肌层,深度大于全肌层厚度的1/2(箭);C.Ⅱ期子宫内膜癌,宫颈上皮未见显示,肿瘤信号延伸入宫颈纤维基质,宫颈管增宽(箭)。图2 A、C、E为DWI图,B、D、F为ADC图;A、B. G1子宫内膜癌,B图病灶呈浅蓝色,ADC值为0.722×10-3mm2/s;C、D. G2子宫内膜癌,D图病灶呈浅蓝色为主,ADC值为0.643×10-3mm2/s;E、F.G3子宫内膜癌,F图病灶深、浅蓝色混杂,ADC值为0.478×10-3mm2/s

图3 不同病理分级子宫内膜癌的ADC值比较
3 讨论
子宫内膜癌肌层浸润与否及浸润深度、病理分级与淋巴结转移关系密切。肿瘤局限于内膜时,其盆腔和腹主动脉旁淋巴结转移率分别为3.6%和1.8%;而浸润深肌层时,转移率分别上升至43%和21%[6];组织学分级越高,肿瘤的恶性程度越高,越容易发生早期转移。
3.1 3D LAVA动态增强检查在判断子宫内膜癌分期中的应用
3.1.1 常规T2WI和DWI判断子宫内膜癌分期的局限性 在常规T2WI上,内膜癌病灶一般呈稍高信号,而正常外肌层呈等信号,两者之间的信号对比不明显,因此,肉眼准确判断肿瘤侵犯肌层深度有时较难,特别是当合并子宫肌瘤或腺肌症等病变造成子宫形态扭曲时,易导致误判。Emlik等[7]认为3D动态对比增强序列优于T2加权序列,且3D动态增强MRI已经成为子宫恶性肿瘤的标准检查方法。有关研究[5,8]也认为在评价内膜癌肌层和宫颈侵犯时T1加权3D动态MR检查比矢状位T2WI能提供更准确的信息。
DWI图像上内膜癌、正常子宫内膜、宫颈黏膜均呈高信号,同时DWI图像分辨率相对较低,致肉眼常无法准确判断病灶的边界,故内膜癌肌层浸润深度易发生误判。
3.1.2 3D LAVA动态增强检查的优势 LAVA动态增强扫描是一种三维扰相梯度回波技术,其优势是时间和空间分辨率可同时提高25%,有利于显示细微结构[9]。LAVA连续快速容积扫描结合压力注射器的应用明显提高了病变组织的增强扫描效果,从而清楚地显示病变的生长特征、侵犯深度及范围。本研究中56例LAVA图像清晰,不同组织结构对比鲜明,在LAVA动态增强图像上,内膜癌呈轻度渐进性强化,其信号始终低于明显强化的正常肌层,呈相对低信号,可能与肿瘤本身乏血供、而正常子宫肌层血供丰富有关。内膜癌病灶于180s时与正常子宫肌层对比最为显著,此时病灶大小、范围及边缘情况显示最佳,因此180s时能更为准确地估计肌层浸润深度,与文献[4]报道结果一致。正常宫颈上皮明显增强,宫颈纤维基质增强较上皮轻,内膜癌与宫颈上皮对比明显,可清晰评价宫颈受累情况。
本研究显示,LAVA动态增强检查判断子宫内膜癌Ⅰa、Ⅰb期的准确性分别为91.1%、91.1%,判断Ⅰ期肌层浸润深度的准确率为90.6%(48/53),总的诊断准确率为91.1%(51/56)。本研究中3例内膜癌侵犯宫颈纤维基质,LAVA检查均判断正确,其敏感性、特异性、准确性均为100.0%,与研究[5]结果一致。Manfredi等[5]应用动态增强检查对37例内膜癌患者进行术前分期,结果表明,动态增强检查判断肿瘤侵犯浅肌层和深肌层的准确率分别为91%和87%,判断宫颈浸润的敏感性、特异性和准确性分别为80%、96%、92%;并且增强检查的平衡期肿瘤和正常肌层的对比噪声比最大。邢庆娜等[10]研究亦显示,增强检查判断子宫内膜癌浅肌层和深肌层侵犯的准确率分别为80.0%和93.9%。
3.2 ADC值在子宫内膜癌分级中的应用 DWI是目前唯一能够观察活体组织内水分子扩散运动的无创性方法[11],它能够检测出先于形态学改变而与组织水分子运动变化有关的病变,并以ADC值来量化水分子运动的改变。
子宫内膜癌和正常子宫内膜在DWI上均呈高信号,肉眼观察DWI信号强度难以区分内膜癌和正常内膜。ADC值很好地解决了这一问题。研究[12,13]显示,子宫内膜癌ADC值明显低于正常子宫内膜(P<0.01),且两者不存在重叠。既往研究[14]结果表明恶性肿瘤ADC值与病理级别相关,级别较高者ADC值较低。本研究中41例子宫内膜癌均为子宫内膜样腺癌,其中G1 20例,G2 14例,G3 7例,各级别ADC值G1>G2>G3,两两比较差异均有统计学意义(P<0.01),与以往研究[14]结果一致。研究[12,15]也发现随子宫内膜癌病理级别由低到高变化,其ADC值大小呈相反趋势变化。虽然本研究结果显示随子宫内膜癌病理级别由低到高变化,其ADC值大小呈相反趋势变化,但是级别间还存在一定的重叠,且本研究样本量相对较小,因此在个案诊断上仅具有参考价值。
ADC值的大小主要受细胞外间隙水分子运动的影响,细胞外间隙越小,ADC值越低;细胞外间隙与细胞密度有关,而细胞密度又是反映肿瘤细胞分化和恶性程度的一个重要指标。因此,肿瘤病理级别越高,细胞分化就越差,其恶性程度越高,增殖能力越强,细胞密度越高,细胞外间隙越小,水分子的扩散运动越受限,ADC值越低。
综上所述,3D LAVA动态增强检查能较准确地判断子宫内膜癌肌层和宫颈侵犯情况,测量ADC值有助于评估内膜癌的病理分级,二者联合应用有利于临床制订适宜的治疗方案并评估患者预后,宜作为内膜癌患者术前MRI检查的常规序列。
[1]Tavassoeli FA, Devilee P. World Health Organization classi fi cation of tumors. Pathology and genetics of tumors of the breast and female genital organs. International Agency for Research on Cancer (IARC), 2003, 107(2): 221-228.
[2]David M. Epidemiology of endometrial cancer. Reviews in Gynaecological Practice, 2003, 3(4): 217-220.
[3]Pecorelli S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet,2009, 105(2): 103-104.
[4]汪俊萍, 白人驹, 孙浩然, 等. 3D LAVA动态增强扫描结合MPR技术判断子宫内膜癌肌层浸润深度的价值.临床放射学杂志, 2011, 30(6): 830-833.
[5]Manfredi R, Mirk P, Maresca G, et al. Local-regional staging of endometrial carcinoma: role of MR imaging in surgical planning. Radiology, 2004, 231(2): 372-378.
[6]王立侠, 欧阳汉. 磁共振成像在子宫内膜癌诊断和分期中的应用. 中国医学影像技术, 2004, 20(6): 967-970.
[7]Emlik D, Kiresi D, Ozdemir S, et al. Preoperative assessment of myometrial and cervical invasion in endometrial carcinoma: comparison of multi-section dynamic MR imaging using a three dimensional FLASH technique and T2-weighted MR imaging. J Med Imaging Radiat Oncol, 2010, 54(3): 202-210.
[8]Nasi F, Fiocchi F, Pecchi A, et al. MRI evaluation of myometrial invasion by endometrial carcinoma:comparison between fast spin-echo T2-weighted and coronal-FMPSPGR gadolinium-dota-enhanced sequences.Radiol Med, 2005, 110(3): 199-210.
[9]吴伟, 赵建农, 郭大静, 等. LAVA结合ASSET技术在肝门静脉成像的应用价值. 临床放射学杂志, 2008,27(4): 533-536.
[10]邢庆娜, 张小安, 赵鑫, 等. 子宫内膜癌MRI征象与血管内皮生长因子、Ki-67表达的相关性研究. 中国医学影像学杂志, 2011, 19(9): 688-692.
[11]Ichikawa T, Erturk SM, Motosugi U, et al. High-B-value diffusion-weighted MRI in colorectal cancer. Am J Roentgenol, 2006, 187(1): 181-184.
[12]Tamai K, Koyama T, Saga T, et al. Diffusion-weighted MR imaging of uterine endometrial cancer. J Magn Reson Imaging, 2007, 26(3): 682-687.
[13]Wang J, Yu T, Bai R, et al. The value of the apparent diffusion coef fi cient in differentiating stage ⅠA endometrial carcinoma from normal endometrium and benign diseases of the endometrium: initial study at 3-T magnetic resonance scanner. J Comput Assist Tomogr, 2010, 34(3): 332-337.
[14]Castillo M, Smith JK, Kwock L, et al. Apparent diffusion coefficients in the evaluation of high-grade cerebral gliomas. Am J Neuroradiol, 2001, 22(1): 60-64.
[15]王琨华, 郭启勇. 子宫内膜癌的DWI成像特征及其与PCNA、Ki-67表达相关性研究. 医学影像学杂志, 2011,21(11): 1718-1723.
