多层螺旋CT评价脊柱融合模型成骨过程的研究
2012-06-05张森,杜湘珂,张健
约10%~15%的患者行腰椎融合术后仍有临床症状[1]。通过影像检查评估腰椎融合情况是判断患者是否需要接受进一步手术治疗的重要手段。目前评估椎体融合情况的“金标准”是手术探查,而临床对于影像检查评估的准确性一直存在争议。约40%的患者腰椎融合的X线检查与手术探查结果不一致[2]。近年来随着多层螺旋CT(MSCT)设备和成像技术的不断进步,因其对骨组织细微解剖结构的良好显示能力,逐渐成为临床诊断骨骼病变的首选方法。国内关于腰椎融合的相关研究多以临床评估作为评价方法[3,4]。本研究建立家兔后外侧脊柱融合模型,通过MSCT动态观察医用硫酸钙作为骨移植替代材料以及自体髂骨作为移植材料的成骨过程,并结合组织病理学结果,探讨影像改变的病理机制。
1 资料与方法
1.1 实验动物 健康家兔20只,雌雄不限,体重约2kg,饲养于北京大学人民医院SPF级动物实验中心,恒温(22~24℃),湿度(30%~50%),自由摄取灭菌食物和自来水。本研究经我院动物伦理委员会批准。
1.2 实验方法 建立家兔L4、5椎体后外侧单节段融合模型,采用3%戊巴比妥钠1.5ml/kg耳缘静脉注射麻醉,横突间植入骨移植材料,左侧植入医用硫酸钙颗粒(美国Wright公司,直径4.8mm×3mm),右侧植入自体髂骨约1ml作为自身对照。植骨完成后,棘突采用钢丝作“8”字固定。术后3、6、12周行腰椎MSCT平扫观察硫酸钙降解情况,同时观察植入物与自体骨质融合状况。术后3、6周各随机处死1只家兔,获得同期病理对照;术后12周处死剩余18只家兔,探查原手术部位,判断腰椎融合情况,在腰椎后外侧区域发现稳固的骨皮质连接形成,则认为腰椎后外侧融合成功,并获得最终时间点病理对照。以手术探查结果作为对照,分别计算MSCT评估腰椎后外侧融合的敏感度、特异度、阳性预测值及阴性预测值,并计算两次植骨区的植骨融合率(植骨融合率=完全骨性融合的横突/受试动物总数)。
1.3 CT影像采集 采用GE Light Speed VCT(GE Healthcare,美国),扫描参数为120kV,450mA,重建层厚2mm,间隔1mm,视野(FOV)15cm×15cm,轴位扫描。
1.4 图像分析 由2名影像医师在不知骨移植材料的情况下协商最终确定。手术部位完全骨性融合的诊断标准为:所有扫描层面上均存在连续性骨小梁。手术部位无完全骨性融合的标准为:①存在不连续性骨小梁;②融合区域存在裂隙;③手术区域骨折不愈合征象,如骨折线长期存在,并出现边缘硬化表现。
1.5 病理检查 标本以福尔马林固定24h,经脱钙、脱水处理后,进行HE染色,显微镜下观察成骨情况。
1.6 统计学方法 采用SPSS 13.0软件,椎体两侧不同方法植骨融合率比较采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 MSCT评估腰椎后外侧融合的敏感度、特异度、阳性预测值及阴性预测值 本实验中家兔术后无伤口感染及死亡发生。18只家兔于术后12周发现,植入医用硫酸钙一侧椎体融合率为88.9%(n=16),植入自体髂骨一侧为94.4%(n=17),差异无统计学意义(P>0.05)。
硫酸钙植骨一侧与自体骨植骨一侧MSCT及手术评估腰椎后外侧融合结果见表1、2。MSCT评估腰椎后外侧融合的敏感度、特异度、阳性预测值及阴性预测值见表3。
2.2 MSCT与同期病理结果对照 术后3周CT扫描可见硫酸钙植骨一侧未降解的硫酸钙基质,局部骨组织密度不均匀增高(图1A),自体骨植骨区局部亦可见骨密度增高,移植骨与周边骨组织界限不清晰;病理检查示双侧植骨区域均可见新生血管组织,并可见大量破骨细胞,硫酸钙植骨一侧仍可见残留的硫酸钙基质,破骨细胞存在于基质表面(图1B)。术后6周:CT扫描硫酸钙植骨一侧未见明确硫酸钙基质显示,两侧植骨区均可见骨密度不均匀增高(图2A);病理结果示硫酸钙植骨一侧未见明确硫酸钙基质残留,双侧植骨区域均可见散在的骨小梁形成及新生透明软骨,两侧植骨区无明显差别(图2B、2C)。术后12周:CT扫描见双侧植骨区域边缘呈线样高密度影,为完整的骨皮质形成(图3A);病理显示双侧植骨区域中心可见骨髓生成,边缘区域均形成完整的骨皮质结构,两侧植骨区无明显差别(图3B)。
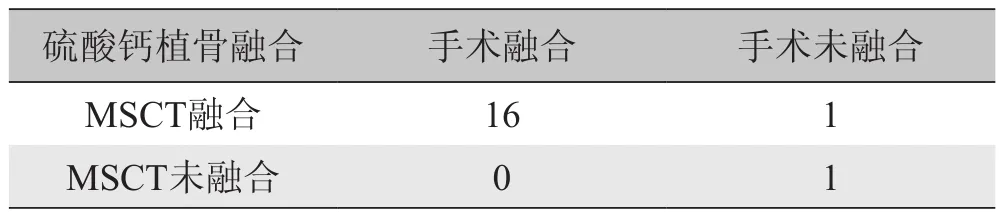
表1 MSCT与手术评估硫酸钙植骨融合情况比较
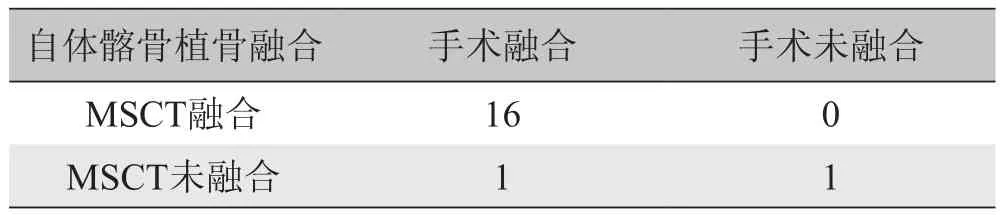
表2 MSCT与手术评估自体髂骨植骨融合情况比较
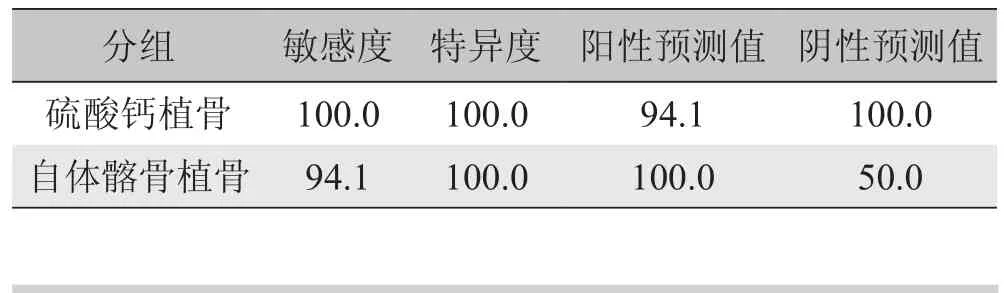
表3 MSCT评估腰椎后外侧融合的敏感度、特异度、阳性预测值及阴性预测值(%)
3 讨论
硫酸钙具有良好的生物相容性,在临床作为骨缺损的修复材料应用多年,既往研究报道效果很好,证实硫酸钙作为良好的骨移植替代材料,可以单独应用,而且可以取得与自体骨同样的融合效果[5-9]。

图1 术后3周CT及病理表现。A.CT平扫可见残留的硫酸钙颗粒(箭),自体骨植骨区模糊,局部骨密度增高;B.硫酸钙颗粒内纤维血管组织长入,残留硫酸钙基质表面出现破骨细胞(HE, ×100)。图2 术后6周CT及病理表现。A.未见硫酸钙残留颗粒,两侧植骨区域均模糊,局部骨密度增高(箭);B、C.硫酸钙颗粒完全降解,硫酸钙植入侧(B)及自体骨植入侧(C)植骨区内均可见大量透明软骨形成(HE, ×100)。图3 术后12周CT及病理表现。A.植骨区域周围有连续的骨皮质形成(箭),其内部为松质骨结构;B.植骨区周边形成连续的皮质骨,皮质骨的内骨为骨髓样组织以及散在的脂肪变性(HE, ×100)
本研究选用与脊柱外科临床手术非常相似的家兔腰椎后外侧融合模型作为研究平台,于术后12周对腰椎融合模型进行手术探查,发现硫酸钙植骨一侧椎体融合率为88.9%(n=16),自体髂骨植骨一侧为94.4%(n=17),差异无统计学意义(P>0.05)。同时以手术探查结果作为对照,发现MSCT评估腰椎后外侧融合情况具有较高的敏感度、特异度、阳性预测值及阴性预测值,并与手术探查结果具有良好的一致性,硫酸钙植骨一侧及自体骨植骨一侧均仅有1例CT检查结果与手术探查结果不一致。
同时,本研究选用CT影像动态观察作为评估方法,进一步观察医用硫酸钙及自体髂骨在腰椎后外侧融合中的成骨过程,并结合同期病理进行影像与病理对照。通过术后3、6、12周CT平扫及同期病理对照观察,发现各时间点CT影像表现与同期病理之间具有良好的对应关系,术后3周CT影像和同期病理均可见残留的硫酸钙颗粒,自体骨完全降解;术后6周CT影像和同期病理可见硫酸钙颗粒基本降解,并可见双侧植骨区透明软骨形成,病理示双侧成骨表现在CT图像上表现为骨密度不均匀增高,在硫酸钙颗粒降解速度及骨形成的判定方面,CT影像与病理之间具有良好的一致性。因此认为CT影像的动态变化表现可以直观地反映出医用硫酸钙及自体骨成骨过程中的组织学变化过程。此外,术后12周CT影像表现与同期病理均显示医用硫酸钙植骨与自体髂骨植骨的成骨无显著差异,对于皮质骨的形成,CT与同期病理表现一致。
通过分析医用硫酸钙成骨与自体骨成骨的CT影像表现,结合同期病理对照,认为CT可以清晰显示腰椎后外侧融合术后的成骨过程,能够有效评价腰椎融合术后骨移植材料的成骨表现,从而为临床判定腰椎融合情况提供重要依据。
[1]Lee JH, Jeon DW, Lee SJ, et al. Fusion rates and subsidence of morselized local bone grafted in titanium cages in posterior lumbar interbody fusion using quantitative threedimensional computed tomography scans. Spine, 2010,35(15): 1460-1465.
[2]Fogel GR, Toohey JS, Neidre A, et al. Fusion assessment of posterior lumbar interbody fusion using radiolucent cages: X-ray fi lms and helical computed tomography scans compared with surgical exploration of fusion. Spine J,2008, 8(4): 570-577.
[3]吕廷灼, 王文志, 冯世庆. 腰椎融合术的治疗进展. 中国矫形外科杂志, 2011, 19(9): 747-749.
[4]刘彦斌, 贺石生, 李明. 微创腰椎融合术的研究进展. 中国脊柱脊髓杂志, 2009, 19(5): 395-398.
[5]马兴, 胡蕴玉, 熊卓, 等. 新型仿生活性人工骨诱导兔腰椎横突间脊柱融合研究. 中华实验外科杂志, 2005,22(11): 1387-1389.
[6]段兴威, 武汉, 谷长跃, 等. rhBMP-2在老年兔后外侧脊柱融合中作用的实验研究. 中国骨伤, 2010, 23(1): 28-31.
[7]Nagata MJ, Furlaneto FA, Moretti AJ, et al. Bone healing in critical-size defects treated with new bioactive glass/calcium sulfate: a histologic and histometric study in rat calvaria. J Biomed Mater Res B Appl Biomater, 2010,95(2): 269-275.
[8]Turner TM, Urban RM, Gitelis S, et al. Radiographic and histologic assessment of calcium sulfate in experimental animal models and clinical use as a resorbable bone-graft substitute, a bone graft expander, and a method for local antibiotic delivery: one institution's experience. Bone Joint Surg Am, 2001, 83(suppl 2): 8-18.
[9]Turner TM, Urban RM, Gitelis S, et al. Resorption evaluation of a large bolus of calcium sulfate in a canine medullary defect. Orthopedics, 2003, 26(5 Suppl): S577-579.
