乳酸脱氢酶A(ldha)基因的克隆与原核表达
2012-06-02许香雅沈榕强
袁 军,许香雅,沈榕强
(福建农林大学 a.生命科学学院;b.生物农药与化学生物学教育部重点实验室,福州 350002)
乳酸脱氢酶(lactate dehydmgenaLse,LDH)是糖代谢中的主要酶类,可催化生物体内丙酮酸转化为乳酸,也是肿瘤发生、发展中Warburg效应的重要效应酶。Warburg效应是指肿瘤在发生、发展过程中,能量获得方式由有氧方式转化为无氧糖酵解方式的现象。在脊椎动物体内,LDH存在3种亚基[1],分别为A(或称M亚基)、B(或称H亚基)、C。研究表明,减少ldha基因的表达能减少细胞的转化和显著地延长肿瘤的形成时间,因此,ldha基因在肿瘤的形成初期和肿瘤的发生过程中扮演着重要角色[2-3]。ldha基因编码的LHD-A蛋白是肿瘤相关的关键调控因子HIF-1α及c-Myc的效应蛋白,它在肿瘤发生、发展中起关键作用,由于基因改变和肿瘤低氧症,许多癌细胞消耗大量的葡萄糖并且通过LDH-A生成乳酸。LDH-A表达水平的变化直接关联着肿瘤的发展程度[4]。此外,在人体内LDH-A同工酶谱的变化也可从一定程度上反映组织器官的病变,对诊断心脑血管疾病、呼吸道疾病、肝脏疾病、肿瘤等均有重要参考价值。为了得到LDH-A的纯蛋白,以便在肿瘤相关通路中进行LDH-A蛋白水平的检测,并进一步阐明ldha基因作用的分子机理,本文对Hela细胞中的LDH-A蛋白编码基因进行了克隆,并在E.coli中进行表达研究。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本实验所涉及的菌株见表1,质粒见表2。

表1 本实验所用到的菌株

表2 本实验所用到的质粒
1.1.2 主要试剂
限制性内切酶EcoR I和 HindⅢ、Taq酶、T4-DNA连接酶、卡那霉素(Kan)均购自Takara公司。质粒提取试剂盒购自北京庄盟国际生物基因科技公司。RNA提取试剂TRIzol Reagent购自lnvitrogen公司。反转录试剂盒、PCR产物纯化试剂盒、胶回收试剂盒均购自Tiangen公司。IPTG(异丙基硫代-β-D半乳糖苷)购自Sigma公司。丙烯酰胺和N,N'-亚甲基双丙烯酰胺为Bio-Rad公司产品。寡核苷酸引物由上海鼎安生物科技有限公司合成。
1.2 表达载体pET28a(+)-ldha的构建
参照TRIzol(Invitrogen)说明书的方法提取Hela细胞中的总RNA。反转录获得cDNA过程按照反转录试剂盒说明书进行。从Genebank获得ldha基因的全核苷酸序列,使用Primer 5.0软件设计扩增ldha基因编码序列所需的引物,F:5’-下划线部分分别为 EcoR I和HindⅢ的酶切位点。PCR反应体系(25 μL)如下:10×EX Taq PCR Buffer 2.5 μL,dNTP(2.5 mmol·L-1)1 μL,引物(20 μmol·L-1)各 0.3 μL,模板 1 μL,EX Taq 酶(2.5 U·μL-1)0.2 μL。PCR 反应条件为:95 ℃预变性5 min;94℃变性45 s,59℃退火45 s,72℃延伸1.5 min,循环32次后72℃延伸5 min。PCR扩增产物及质粒pET28a(+)经纯化后,用EcoR I和HindⅢ进行双酶切,然后用T4-DNA连接酶于16℃进行连接,连接产物转入大肠杆菌BL21(DE3)。涂布于LB+Kan平板上,37℃恒温培养箱培养12 h,挑取单菌落接种于4 mL LB+Kan培养基中,于 37℃ 180 r·min-1摇床培养16h。挑取阳性克隆做PCR及酶切验证。将经验证的阳性克隆子送公司测序后与ldha基因原序列进行同源性比对。序列正确的质粒即为获得的表达质粒pET28a(+)-ldha。实验具体操作方法参考《分子克隆实验指南》[5]。
1.3 重组蛋白的诱导表达
挑取经测序验证的E.coli BL21(DE3)/pET28a(+)-ldha和 E.coli BL21(DE3)/pET28a(+)单菌落,分别接种于4 mL含卡那霉素(10 μg/mL)的LB液体培养基中,37℃恒温摇床振荡培养过夜。按1%接种量分别将菌体转接于含相应抗生素的50 mL LB液体培养基中,37℃恒温振荡培养至OD600为0.6 ~0.8,加 IPTG 至终浓度 1.0 mmol/L,28℃继续诱导培养8 h。然后4℃离心1 min(12 000 r·min-1),弃上清留菌体沉淀,再用 80 μL 5×SDS-PAGE样品缓冲液重悬,放入100℃沸水煮3 ~5 min 后取出,离心5 min(12 000 r·min-1),上清液用于SDS-PAGE分析。
2 结果与分析
2.1 ldha基因的克隆
参照TRIzol说明书的方法获得了Hela细胞的总RNA,提取结果如图1所示。以RNA反转录得到的cDNA作为模板,与合成的引物扩增得到ldha目的基因片段,大小为999 bp(图2),与预期大小相符。
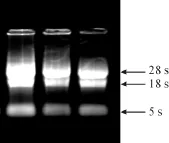
图1 Hela细胞中抽提的总RNA
2.2 表达载体的构建与验证
PCR产物与载体pET28a(+)具有相同酶切位点,通过酶切与连接,将目的基因ldha构建到了载体pET28a(+)上,形成了表达载体 pET28a(+)-ldha(图3)。
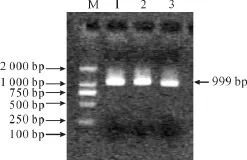
图2 ldha基因PCR扩增结果
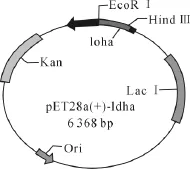
图3 pET28a(+)-ldha原核表达载体的构建
将构建好的载体pET28a(+)-ldha转化为E.coli BL21(DE3),经培养后,提取质粒做PCR和双酶切验证。PCR扩增结果表明,经凝胶电泳检测得到大小为999 bp的核苷酸片段(图4)与理论推测一致。用EcoRⅠ、HindⅢ双酶切后检测得到2条大小分别为5 350 bp和989 bp的核苷酸片段(图5),表明ldha基因片段已连接到质粒pET28a(+)上。将阳性克隆子送至生物公司测序,测序结果与ldha原序列用软件DNAMAN比对两者的同源性,结果显示同源性为100%,说明ldha基因已成功插入pET28a(+)载体中,进一步证明了表达载体pET28a(+)-ldha构建成功,可供后续蛋白表达实验使用。
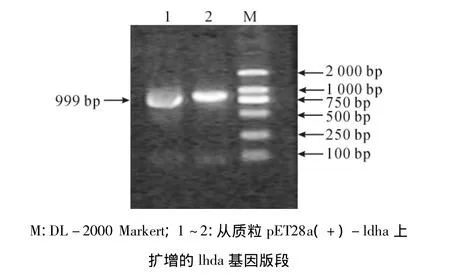
图4 重组质粒pET28a(+)-ldha的PCR验证
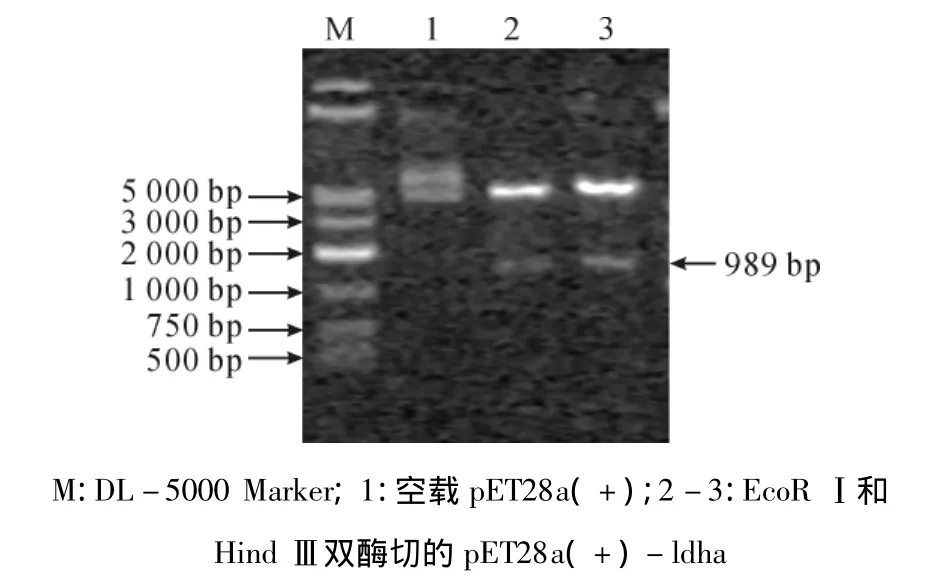
图5 质粒pET28a(+)-ldha酶切验证
2.3 重组蛋白的诱导表达
分别挑取经验证正确的阳性克隆子E.coli BL21(DE3)/pET28a(+)-ldha与空载体对照菌株E.coli BL21(DE3)/pET28a(+)进行诱导表达。培养菌株 OD600达0.6~0.8时将其用1 mmol/L IPTG诱导8 h,离心收集菌体,进行SDS-PAGE蛋白质电泳分析,结果发现,在分子量为36 kDa处有一明显的蛋白质表达条带(图6),蛋白大小与理论推测值一致,而对照空载菌株则几乎没有该蛋白表达条带,说明该蛋白条带为LDH-A蛋白表达条带。
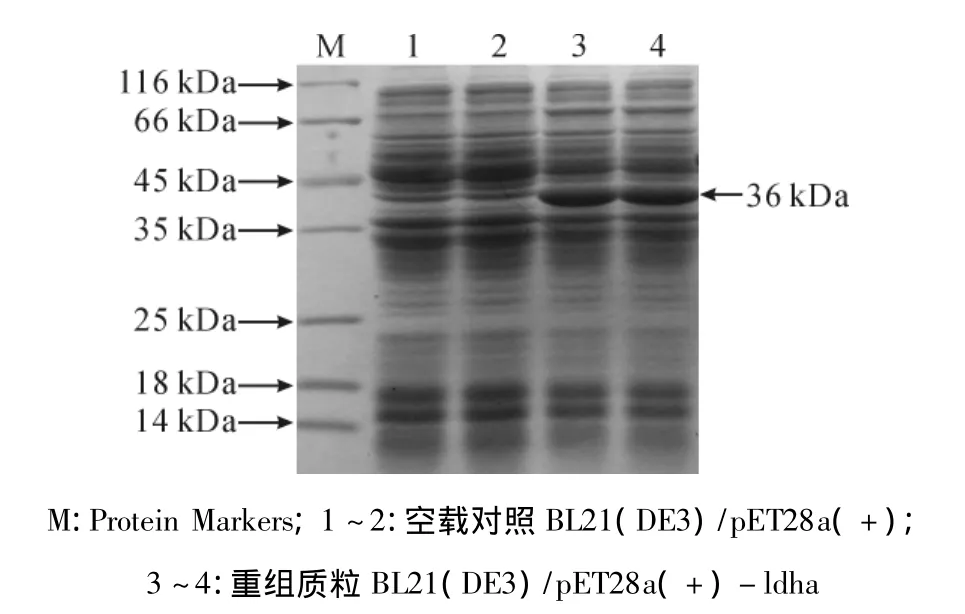
图6 E.coli BL21(DE3)/pET28A(+)-ldha表达产物SDS-PAGE分析
3 讨论
乳酸脱氢酶是以NAD为辅酶,催化生物体内糖代谢过程中乳酸与丙酮酸之间可逆反应的一组同工酶。作为糖酵解途径中一种重要的酶,它广泛存在于生物体内,并具有组织器官特异性。乳酸脱氢酶在人体中主要分布于肾、心肌、肝、脾、红细胞和白细胞等组织或器官中[6]。而肿瘤细胞具有一种独特的代谢途径,它的糖酵解进行的顺序与三羧酸循环缺少联系,导致肿瘤细胞利用葡萄糖的量会比正常组织细胞高5~10倍,其中多数转变成了乳酸盐。许多肿瘤相关研究表明,患者的发作期,无论初发或复发,其血清LDH水平均较正常明显增高,患者癌细胞中的LDH显著高于正常组织[7-8],可作为代表全身肿瘤细胞负荷的一项重要指标。产生这一现象的原因可能与上述肿瘤细胞的代谢特性有关。但是,目前对于癌基因和糖酵解的关联还了解甚少,已证明了ldha是c-Myc致癌转录因子的直接靶基因[9-10]。此外,肿瘤细胞中低氧症可诱导因子(HIF-1)能调控LDH-A[11-12],如敲除或减少 LDH-A 可明显抑制肿瘤细胞对缺氧的耐受力。接种了敲除或降低LDH-A表达的患癌小鼠,生存时间明显延长[13]。减少ldha能抑制肿瘤初期的形成及肿瘤细胞的转移,这是因为在正常组织细胞中既不会含氧低也没有活化的c-Myc,而在肿瘤细胞中含氧量低[10]。ldha基因表达的减少会诱导氧化应激和肿瘤细胞死亡。
在本实验中,将ldha基因构建到表达载体pET28a(+)中,得到重组表达载体pET28a(+)-ldha,转化大肠杆菌 BL21(DE3),获得了重组菌株。在IPTG诱导下,ldha基因在大肠杆菌中得到了成功表达,这为今后LDH-A蛋白的快速检测,阐明ldha基因在肿瘤发生发展及其他重大疾病中的关键作用提供了参考。
[1]袁勤生.现代酶学[M].上海:华东理工大学出版社,2001:23-25.
[2]Fantin V R,St-Pierre J,Leder P.Attenuation of LDH-A expression uncovers a link between glycolysis,mitochondrial physiology,and tumor maintenance[J].Cancer Cell,2006,9:425 -434.
[3]Xie H,Valera V A,Merino M J,et al.LDH - A inhibition,a therapeutic strategy for treatment of hereditary leiomyomatosis and renal cell cancer[J].Mol Cancer Ther 2009,8:626-635.
[4]张碧莲.乳酸脱氢酶对恶性肿瘤的诊断意义[J].国际检验医学杂志,2010,31(10):1172 -1173.
[5]萨姆布鲁克·拉塞尔.分子克隆实验指南(上、下册)[M].3版.黄培堂,译.北京:科学出版社,2002:1228-1232.
[6]周新,徐植光.临床生物化学和生物化学检验[M].3版.北京:人民卫生出版社,2004:169-452.
[7]曹莉萍,吕娇风,牟秀萍,等.血清GGT、ALP和LDH联检测定对癌症患者的诊断及意义[J].实验与检验医学,2008,26(4):437 -438.
[8]施瑞浩,张新,白春学.血清乳酸脱氢酶与原发性肺癌分期的关系[J].中国临床医学,2008,15(2):172-173.
[9]Lewis B C,Shim H,Li Q,et al.Identification of putative c-Myc-responsive genes:Characterization of rcl,a novel growth-related gene[J].Mol Cell Biol,1997,17:4967-4978.
[10]Shim H,Dolde C,Lewis B C,et al.c-Myc transactivation of LDH-A:Implications for tumor metabolism and growth[J].Proc Natl Acad Sci USA,1997,94:6658 -6663.
[11]Semenza G L,Jiang B H,Leung S W,et al.Hypoxia response elements in the aldolase A,enolase 1,and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxiainduciblefactor[J].Biol Chem,1996,271:32529-32537.
[12]Firth J D,Ebert B L,Ratcliffe P J.Hypoxic regulation of lactate dehydrogenase A.Interaction between hypoxia-inducible factor 1 and cAMP response elements[J].Biol Chem,1995,270:21021 -21027.
[13]Fantin V R,St-Pierre J and Leder P.Attenuation of LDHA expression uncovers a link between glycolysis,mitochondrial physiology,and tumor maintenance[J].Cancer Cell,2006,9(6):425 -434.
