不同免疫球蛋白启动子控制的白喉毒素A链基因对淋巴瘤细胞的抑制作用
2012-06-02姚娜芮红兵
姚娜 芮红兵
白喉毒素A链(DT-A)基因在真核细胞中的表达可以产生细胞毒性作用并杀死该细胞[1,2]。白喉毒素对于真核细胞来说,其毒性是极其强烈的,但将DT-A基因与组织细胞特异性顺式调控序列(启动子/增强子)连接,则该基因的表达只限定在该种特定细胞中,在其他细胞中将不表达。已有实验证明,在转基因老鼠中导入由组织细胞特异性启动子控制的DT-A基因只能在特定细胞中表达,而对其他细胞无毒性作用,因此,白喉毒素基因组织特异性表达的特性可以应用于恶性肿瘤的靶向治疗[3,4]。免疫球蛋白启动子/增强子可以有效而特异性地控制其下游基因在产免疫球蛋白的B淋巴细胞或骨髓瘤细胞中表达[5]。如将免疫球蛋白启动子/增强子与某些毒素基因相连,可以使该基因特异性地在产免疫球蛋白的细胞中表达,从而可将此毒素应用于某些B淋巴系恶性肿瘤的治疗。本研究探讨了不同免疫球蛋白启动子控制的白喉毒素A链基因对淋巴瘤细胞的抑制作用。
1 材料与方法
1.1 质粒与试剂 由鼠免疫球蛋白κ轻链启动子/增强子控制的白喉毒素A链真核表达载体pcDNA3IgκDTA、由鼠免疫球蛋白重链启动子/增强子控制的白喉毒素A链真核表达载体pcDNA3IgHDTA由本室构建,同时构建的还有含报告基因β半乳糖苷酶基因的真核表达载体 pcDNA3IgκLacZ、pcDNA3IgHLacZ。巨细胞病毒(CMV)启动子控制的真核表达载体pcDNA3LacZ由苏津自博士(福建省高血压研究所)惠赠。SP2/0-Ag14细胞(SP2)为鼠骨髓瘤细胞株,不产生也不分泌免疫球蛋白;CA46为人Burkitt's淋巴瘤细胞株,产生及分泌IgM免疫球蛋白及表面IgMκ轻链,K562为人白血病细胞株,该三种细胞株均购自中国典型培养物保藏中心(CCTCC)。培养条件:含10%灭活小牛血清的HDMEM培养液,37℃、5%CO2饱和湿度的CO2培养箱中培养。Wizard DNA Clean-up System DNA纯化试剂盒、细胞活力检测试剂盒Cell-Titer 96® AQueousOne Solution Cell Proliferation Assay及脂质体转染试剂盒TransfastTMTransfection Reagent购自Promega公司;培养基HDMEM购自GIBCO公司。
1.2 方法
1.2.1 质粒DNA的转染及β半乳糖苷酶活性测定 质粒DNA的转染由脂质体(TransfastTMtransfection reagents,Promega)介导,同时转染三种细胞。转染方法按说明书进行:在0.5ml无血清的 HDMEM培养液中加入4μg质粒 DNA、12 μl脂质体,立即涡旋混匀以形成脂质体/DNA混合体,再将脂质体/DNA混合体加入培养于6孔培养板的1×106细胞中,置37℃、5%CO2培养箱中转染1 h,再加入含10%小牛血清的完全培养基5ml,置37℃、5%CO2中培养48 h后收集细胞,将细胞反复冻融三次获得细胞提取液,然后按《分子克隆实验指南》中的方法进行β-半乳糖苷酶活性的检测[6]。为了消除脂质体在不同细胞中转染率差异的影响,同时以质粒pcDNA3LacZ转染相同的细胞,以pcDNA3LacZ转染细胞的β半乳糖苷酶活性为标准,目的基因转染细胞的β半乳糖苷酶相对活性为pcDNA3IgκLacZ/pcDNA3LacZ和pcDNA3IgHLacZ/pcDNA3LacZ。
1.2.2 不同免疫球蛋白启动子控制的白喉毒素A链基因对β-半乳糖苷酶活性的抑制 将质粒 pcDNA3IgκDTA或pcDNA3IgHDTA与β-半乳糖苷酶基因进行共转染实验,转染细胞为CA46细胞株,转染方法仍由脂质体(TransfastTMtransfection reagents,Promega)介导,转染方法按说明书进行。质粒DNA包含2μg质粒 pcDNA3LacZ 及 2μg质粒 pcDNA3IgκDTA 或pcDNA3IgHDTA,对照组以质粒pcDNA3代替pcDNA3IgκDTA或pcDNA3IgHDTA。以共转染CA46细胞后48 h瞬时表达的半乳糖苷酶活性的抑制程度来估测质粒pcDNA3IgκDTA或pcDNA3IgHDTA在CA46细胞中DT-A的表达水平。
1.2.3 DT-A基因的表达对肿瘤细胞的抑制作用 按每孔2×105细胞在24孔板中接种CA46细胞,脂质体介导含DT-A基因质粒pcDNA3IgκDTA或pcDNA3IgHDTA转染细胞,同时以质粒 pcDNA3IgκLacZ或 pcDNA3IgHLacZ作为对照,观察DT-A基因的表达对肿瘤细胞的毒性作用。转染后第1、3、5、7天由台盼蓝拒染实验计数活细胞并绘制细胞生长曲线,比较实验组与对照组细胞存活情况。另外,细胞活力也通过试剂盒CellTiter 96®AQueousOne Solution Cell Proliferation Assay(Promega)以MTS法测定,方法按说明书进行,在转染的96孔培养板细胞中按每孔20 μl加入MTS试剂,再继续培养4 h,以酶标仪在490nm波长处测每孔的光密度值(OD490),细胞活力以公式[(转染的CA46细胞的OD490)/(未经处理的CA46细胞的 OD490)×100],以未经处理的 CA46细胞的OD490值为标准。
1.2.4 统计学方法 运用SPSS统计学软件进行统计学分析。
2 结果
2.1 免疫球蛋白启动子/增强子在不同细胞中的活性 转染后48 h,在产生及分泌IgM免疫球蛋白及表面IgMκ轻链的CA46细胞中,可检测出较高水平的β半乳糖苷酶活性,相反,在非产免疫球蛋白的K562及SP2细胞中,难以检测出β半乳糖苷酶活性。而pcDNA3LacZ转染的3种细胞中均检测出较高的β半乳糖苷酶活性(表1)。
2.2 β半乳糖苷酶基因的表达抑制 在CA46细胞中将质粒pcDNA3IgκDTA或pcDNA3IgHDTA与β-半乳糖苷酶基因共转染后进行β半乳糖苷酶活性检测。pcDNA3IgκDTA在CA46细胞中导致约80%的β半乳糖苷酶表达抑制,pcDNA3IgHDTA在CA46细胞中只导致约65%的β半乳糖苷酶表达抑制,表明在CA46细胞中质粒pcDNA3IgκDTA较pcDNA3IgHDTA能表达更高的 DT-A水平(表2),这说明免疫球蛋白κ轻链启动子/增强子较免疫球蛋白重链启动子/增强子有更强的启动转录活性。

表1 pcDNA3IgκLacZ及pcDNA3IgHLacZ在不同真核细胞中的表达(10-8 u/细胞)
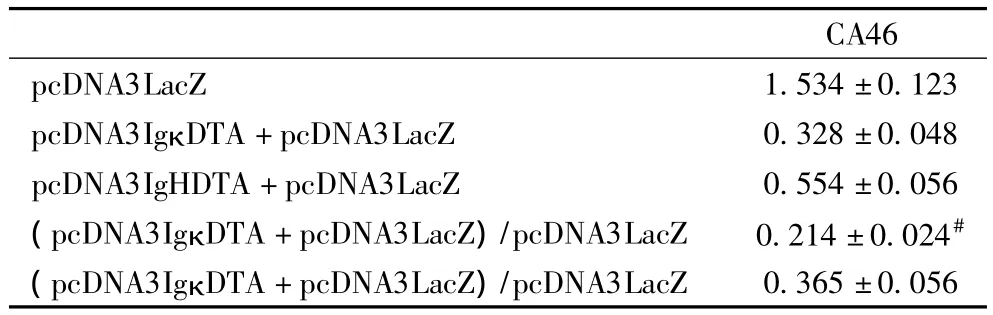
表2 β半乳糖苷酶基因的表达抑制(10-8 u/细胞)
2.3 DT-A对细胞生长的抑制 在转染质粒pcDNA3IgκDTA或pcDNA3IgHDTA第1、3、5、7天进行了细胞计数及细胞活力测定。如图1所示,pcDNA3IgκDTA和pcDNA3IgHDTA的转染导致 CA46细胞明显的生长抑制,与 pcDNA3IgκLacZ和pcDNA3IgHLacZ转染的CA46细胞相比有明显的差异(P<0.05)。细胞抑制在转染后第5天最明显,大约25%的细胞在转染后死亡。同样,MTS法检测细胞活力表明,pcDNA3IgκDTA和pcDNA3IgHDTA转染的CA46细胞活力明显下降,pcDNA3IgκLacZ和 pcDNA3IgHLacZ转染的 CA46细胞活力未见明显变化(图 2)。图 1和图 2均表明,与 pcDNA3IgHDTA相比,pcDNA3IgκDTA能更加明显抑制 CA46细胞的生长。
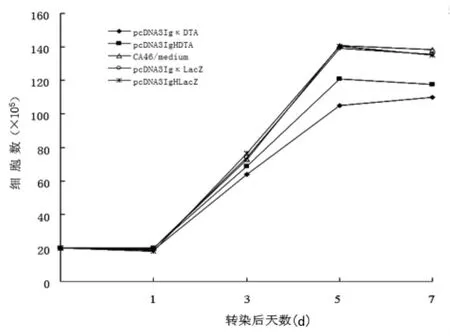
图1 不同启动子控制的DTA基因对CA46细胞的抑制作用

图2 pcDNA3IgκDTA及pcDNA3IgHDTA对CA46细胞活力的影响
3 讨论
基因的组织细胞特异性表达及外源基因进入靶细胞的转运系统的高效性是决定基因治疗疗效的两个重要因素。本研究表明,由免疫球蛋白κ轻链(或重链)启动子/增强子调控的细菌β半乳糖苷酶基因能在产免疫球蛋白的细胞中特异性地表达,而难以在其他非产免疫球蛋白的细胞中检测出其活性。另外,免疫球蛋白κ轻链(或重链)启动子/增强子调控的DT-A基因与β半乳糖苷酶基因共同转染至产免疫球蛋白的CA46细胞中时,DT-A基因的表达能明显抑制β半乳糖苷酶的表达活性。进一步的结果表明,由免疫球蛋白κ轻链(或重链)启动子/增强子调控的DT-A基因能特异性地作用于产免疫球蛋白的恶性淋巴瘤细胞,导致CA46细胞明显的生长抑制;并且发现,免疫球蛋白κ轻链启动子/增强子较免疫球蛋白重链启动子/增强子有更强的启动转录活性,由免疫球蛋白κ轻链启动子/增强子控制的基因能更有效的表达。SP2细胞虽然为骨髓瘤细胞,但因其不生产也不分泌免疫球蛋白,这样免疫球蛋白κ轻链(或重链)启动子/增强子在这种细胞中也无活性。实事上,由组织细胞特异性启动子调控的DT-A基因已经在许多恶性肿瘤细胞的治疗实验中取得了满意的效果[7-10]。
目前,虽然对于用何种基因治疗的方法能最有效地清除肿瘤细胞尚无定论,但有一点很明确,即能直接清除肿瘤细胞的方法是最好的。肿瘤细胞自我更新的特性也说明,对肿瘤的治疗应是尽可能地杀灭肿瘤细胞而不只是生物学上的修饰[11]。因此,在基因治疗中最常用的目的基因是那些能直接杀死细胞的基因如肿瘤自杀基因及细菌毒素基因等。我们的研究表明由免疫球蛋白κ轻链(或重链)启动子/增强子控制的DT-A基因在体外有高度细胞特异性的外源性自杀基因特性。虽然免疫球蛋白κ轻链(或重链)同样在正常B细胞中也有表达,但在肿瘤治疗过程中如能正确区分正常与异常B细胞,那么由免疫球蛋白κ轻链(或重链)启动子/增强子调控的DT-A基因就可能用于B淋巴系恶性肿瘤的靶向治疗。当然,研究由恶性肿瘤细胞特异性顺式调控序列控制的DT-A真核表达载体则可能达到真正意义上的恶性肿瘤靶向基因治疗[7,10,12]。
许多实验表明DT-A基因可能用于恶性肿瘤的治疗,但限制这种应用的主要障碍之一在于当前转运外源基因手段的低效率,这种低效率的转染方法不能在体内将目的基因导入所有的肿瘤细胞。在本实验中,使用了脂质体介导DT-A基因的转染,脂质体虽然具有能携带大片断DNA、无免疫原性、相对病毒载体安全性好、能大批生产等优点[13],但其转染真核细胞的效率较低而不能阻止所有肿瘤细胞生长,因为在本实验中只有约25%的细胞被抑制。所以,在脂质体用于体内治疗之前其转染效率应有较大程度的提高。另外,如将组织细胞特异性顺式调控序列控制的DT-A基因与复制缺陷型腺病毒或逆转录病毒相结合,利用外源基因能在病毒基因组中忠实表达的特点,可能发展出一种高效体内基因转运方法,更有利于DT-A基因的靶向治疗。
[1]Maxwell IH,Maxwell F,Glode LM.Regulated expression of a diphtheria toxin A-chain gene transfected into human cells:possible strategy for inducing cancer cell suicide.Cancer Res,1986,46(9):4660-4664.
[2]Yoshihiko Murayama,Takushi Tadakuma,Michito Kumitomi,et al.Cell-specific expression of the diphtheria toxin A-chain coding sequence under the control of the upstream region of the human alpha-fetoptrotein gene.Journal of Surgical Oncology,1999,70(3):145-149.
[3]Palmiter RD,Behringer RR,Quaife CJ,et al.Cell lineage ablation in transgeinc mice by cell-specific expression of a toxin gene.Cell,1987,50(3):435-443.
[4]Breitmanml,Clapoff S,Rossant J,et al.Genetic ablation:programmed lineage suicide by tissue-specific expression of the diphtheria toxin A gene in transgenic mice.Science,1987,238(4833):1563-1565.
[5]Maxwell IH,Glode M,Maxwell F.Expression of the diphtheria toxin A-chain coding sequence under the control of promoters and enhancers from immunoglobulin genes as a means of directing toxicity to B-lymphoid cells.Cancer Res,1991,51(16):4299-4304.
[6]Sambrook J,Fritsch EF,Maniatis T.Molecular Cloning:A Laboratory Manual. Cold Spring Harbor Laboratory Press,1989:804-809.
[7]Shen Pang.Targeting and eradicating cancer cells by a prostate-specific vector carrying the diphtheria toxin A gene.Cancer Gene Therapy,2000:7(7):991-996.
[8]Mizrahi A,Czerniak A,Levy T,et al.Development of targetedtherapyfor ovarian cancer mediated by a plasmid expressingdiphtheria toxinunder the control of H19 regulatory sequences.J Transl Med,2009,7(6):69.
[9]Smaldone MC,Davies BJ.BC-819,a plasmid comprising the H19 generegulatory sequences anddiphtheria toxinA,for the potential targetedtherapyof cancers.Curr Opin Mol Ther,2010,12(5):607-616.
[10]Amit D,Tamir S,Birman T,et al.Development of targetedtherapyfor bladder cancer mediated by a double promoter plasmid expressingdiphtheria toxinunder the control of IGF2-P3 and IGF2-P4 regulatory sequences.Int J Clin Exp Med,2011,4(2):91-102.
[11]Vile RG,Russell SJ,Lemoine NR.Cancer gene therapy:hard les-sons and new courses.Gene therapy,2000,7(1):2-8.
[12]Massuda ES,Dunphy EJ,Redman RA,et al.Regulated expression of the diphtheria toxin A chain by a tumor-specific chimeric transcription factor results in selective toxicity for alveolar rhabdomyosarcoma cells.Proc Natl Acad Sci USA,1997,94(26):14701-14706.
[13]Kamimura K,Suda T,Zhang G,et al.Advances inGeneDelivery Systems.Pharmaceut Med,2011,25(5):293-306.
