嗜酸乳杆菌NX2-6产细菌素的发酵条件优化
2012-06-01乌云达来陆兆新吕凤霞别小妹卢亚萍孙会刚查干其劳
乌云达来,陆兆新*,吕凤霞,别小妹,卢亚萍,孙会刚,查干其劳
(1.南京农业大学食品科技学院,江苏 南京 210095;2.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
嗜酸乳杆菌NX2-6产细菌素的发酵条件优化
乌云达来1,2,陆兆新1,*,吕凤霞1,别小妹1,卢亚萍1,孙会刚1,查干其劳1
(1.南京农业大学食品科技学院,江苏 南京 210095;2.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
在Plackett-Burman试验结果基础上,采用响应曲面法(Box-Behnken设计)对嗜酸乳杆菌NX2-6发酵产细菌素的关键影响因素,即葡萄糖质量浓度、乙酸钠质量浓度、柠檬酸三钠水合物质量浓度及培养时间的最佳水平范围进行研究和探讨。通过对发酵液抑菌圈直径的二次多项回归方程求解得知,在葡萄糖质量浓度、乙酸钠质量浓度、柠檬酸三钠水合物质量浓度和培养时间分别为60.0、8.0、5.0g/L和36h时,菌株NX2-6的发酵液抑菌圈直径预测值为21.37mm,验证实验抑菌圈直径实测值与预测值的相关系数R2为0.9918。优化后培养基与基础培养基相比,发酵液抗菌活性增加约80.0%,由此可见,利用响应曲面法对嗜酸乳杆菌NX2-6发酵产细菌素条件进行优化是经济有效且科学合理的。
嗜酸乳杆菌;细菌素;发酵条件;优化
细菌素是指由某些细菌在代谢过程中通过核糖体合成机制产生的一类具有生物活性的蛋白质、多肽或前体多肽,这些物质可以杀灭或抑制与之相同或相似生境的其他微生物[1-2]。许多乳酸菌也能产生具有广谱抑菌活性的细菌素,其中一部分乳酸菌细菌素可应用于食品保藏。细菌素在食品工业中的应用有助于减少化学防腐剂的添加量,并且降低灭菌强度,使食品更易于常温保藏,从而保证产品品质和营养[3-5]。许多乳酸菌能产生具有广谱抑菌活性的细菌素,目前已在革兰氏阳性菌中发现了50余种羊毛硫细菌素[6]。
传统的单变量优化试验存在不考虑各因子之间交互作用的不足,虽然全因子试验可以解决这一问题,但费时费力[7]。响应曲面分析法已成功地应用于试验设计、建立模型、影响因素4的评价和最佳条件的确定等[8-9],并已广泛应用于许多研究领域,如培养基和培养条件的优化[10-13]、酶学性质和提取技术的研究[14-16]、异黄酮[17-19]及药物作用的研究[20-21]等方面。采用该法不仅可对影响因子最佳水平范围及其交互作用进行评价,而且所需的试验组数相对较少,结果可靠性强,实验周期短。
笔者从内蒙古锡林郭勒地区牧民家庭中以传统发酵方法制作的酸马奶中分离到一株产广谱抗菌活性物质的嗜酸乳杆菌NX2-6[22]。为了提高该菌株的细菌素产量,本实验对其产细菌素具有显著影响的4个因素[23],即葡萄糖质量浓度、乙酸钠质量浓度、柠檬酸三钠水合物质量浓度以及培养时间进行研究。根据Plackett-Burman试验结果,采用响应曲面法(Box-Behnken设计)研究主要响应因素的最佳水平及其交互作用,确定菌株NX2-6产细菌素的最佳发酵条件,以获得较高产量的细菌素。
1 材料与方法
1.1 菌株与培养基
供试菌株:从内蒙古锡林郭勒地区酸马奶样品中分离的嗜酸乳杆菌NX2-6[22];指示菌株:大肠杆菌AS1.487为南京农业大学食品科技学院酶工程实验室保藏菌种。
脱脂乳培养基、MRS液体培养基及牛肉膏蛋白胨液体或固体培养基根据文献[24-25]方法配制并4℃保藏备用。
1.2 方法
1.2.1 供试菌液的制备
将嗜酸乳杆菌NX2-6接种于5mL脱脂乳培养基中,40℃、培养12~24h。传代培养2次后接种于MRS液体培养基中,40℃培养12h,传代培养2~3次后将末次培养物于4℃、3000r/min离心10min,弃掉上清液,加入与培养液等量的灭菌生理盐水(约5mL),振荡混匀,再次于4℃、3000r/min离心10min,同法洗涤2次。然后,弃掉上清液的菌体中加入4.5mL灭菌生理盐水,振荡混匀,作为供试菌液。
1.2.2 指示菌的培养
将大肠杆菌AS1.487用牛肉膏蛋白胨液体培养基活化,然后于牛肉膏蛋白胨斜面上划线培养后4℃保藏备用,每2周继代1次。使用前接种于营养琼脂液体培养基中,37℃、培养12~24h,使液体培养基中含菌量达到106CFU/mL,备用。
1.2.3 接种量与培养方法
将供试菌液按体积分数2%接种到不同试验设计的组合培养基中,40℃条件下培养36~60h。
1.2.4 抗菌活性的测定
将发酵液经4℃、3000r/min离心10min后用0.45μm过滤器过滤除菌,过滤上清液以大肠杆菌作为指示菌通过管碟法[26-27]测定其抗菌活性。
1.2.5 发酵条件优化试验设计
Plackett-Burman试验结果表明,对菌株NX2-6产细菌素具有显著影响的因素有葡萄糖质量浓度、乙酸钠质量浓度、柠檬酸三钠水合物质量浓度和培养时间[23]。本实验利用响应曲面法(Box-Behnken设计)对菌株NX2-6产细菌素的显著影响因素进一步优化。以发酵液抑菌圈直径为响应值,显著影响因素的水平为自变量,每个自变量试验水平编码分别为ˉ1、0、1(表1)。借助实验设计软件Design Expert,采用Box-Behnken设计方案进行试验设计。

表1 Box-Behnken试验因素水平及编码的设计Table 1 Independen variables and their coded and actual values in Box-Behnken design
设该模型通过最小二乘法拟合的二次多项回归方程为:

1.2.6 模型验证实验
根据试验结果选择最理想的5组发酵条件进行验证实验,并利用SAS(Release 8.01, USA)软件对试验数据进行距离相关分析,验证嗜酸乳杆菌NX2-6产细菌素模型方程的有效性。
2 结果与分析
2.1 响应面法优化嗜酸乳杆菌NX2-6产细菌素发酵条件
根据Plackett-Burman试验结果,对于影响嗜酸乳杆菌NX2-6产生细菌素不显著的其他参数,如蛋白胨、牛肉浸膏、酵母浸出粉等,皆选择Plackett-Burman试验设计中的高水平,培养基初始pH值为6.0、培养温度为40℃和接种量为2%。
Box-Behnken试验设计及结果见表2,利用Design-Expert 6.0.10软件对表2数据进行二次多元回归拟合,获得抑菌圈直径预测值(Y^)对编码自变量的二次多项回归方程见式(2)。
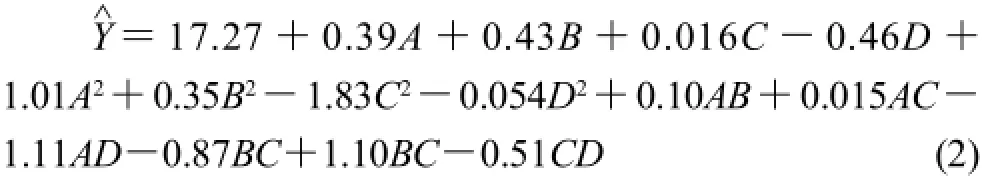
对方程(2)进行方差分析,结果表明所选用的抑菌圈直径二次多项模型具有极显著性(P<0.0001),校正决定系数R2Adj为0.9605,表明抑菌圈直径的实测值与预测值之间具有较好的拟合度。
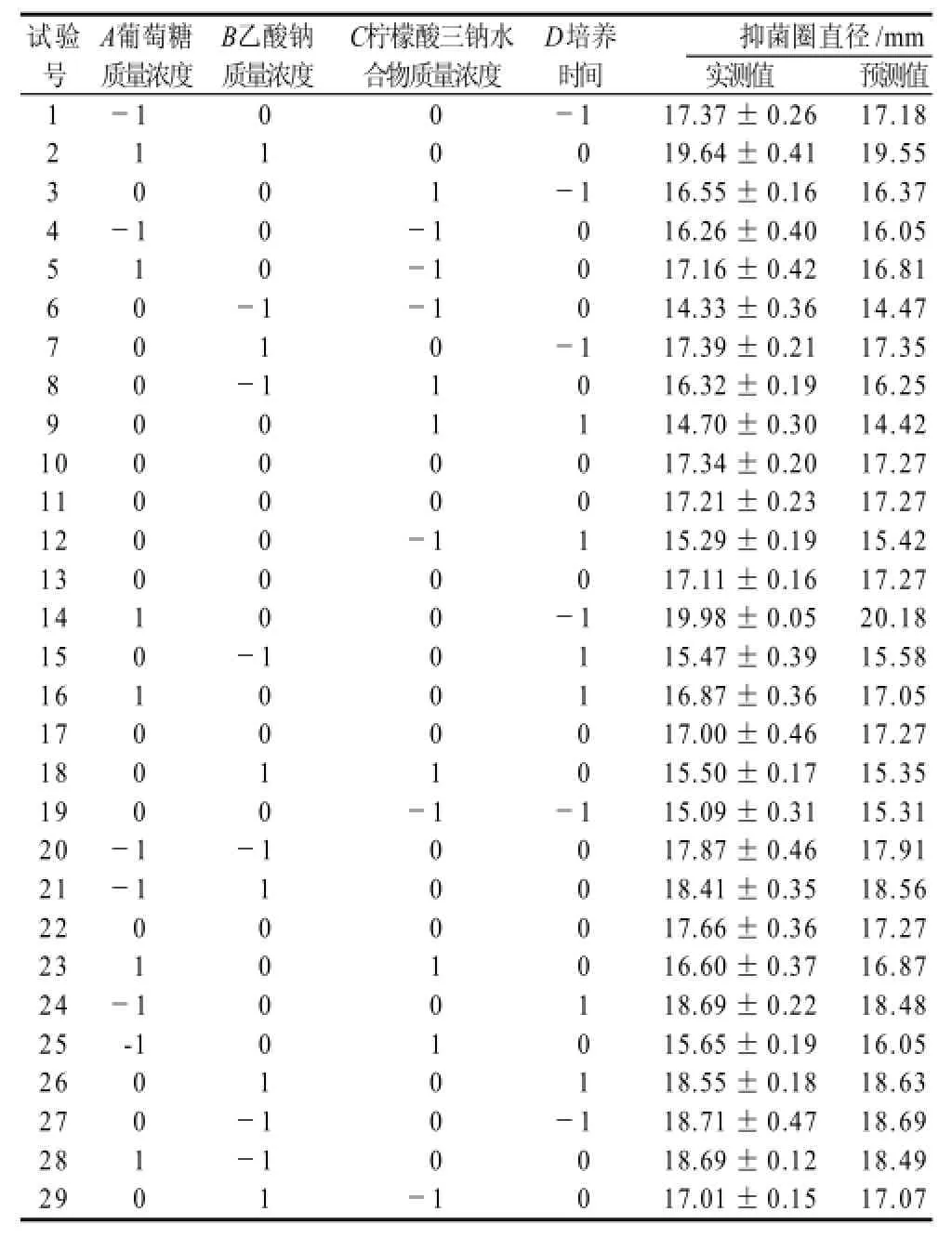
表2 Box-Behnken试验设计优化发酵条件结果Table 2 Box-Behnken design matrix and actual and predicted inhibition zone diameters
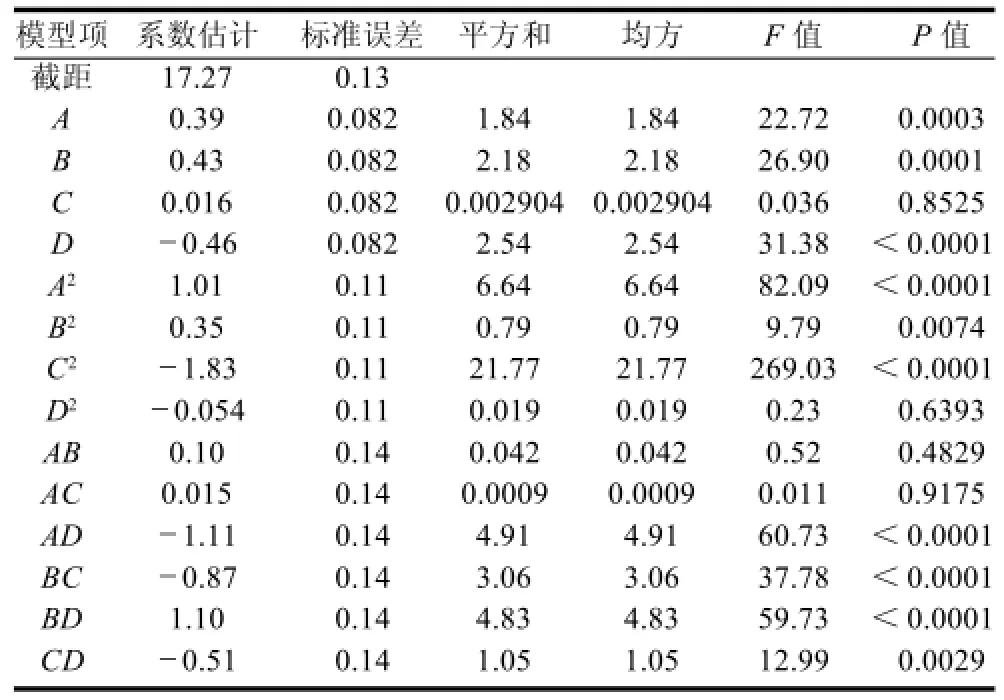
表3 抑菌圈直径二次多项回归方程系数及其显著性检验Table 3 Regression coefficients in the fitted regression model for inhibition zone diameter and their significance
各项回归系数显著性检验(表3)表明,葡萄糖质量浓度、乙酸钠质量浓度和培养时间对抑菌效果影响显著,柠檬酸三钠水合物质量浓度对抑菌效果影响不显著,而葡萄糖质量浓度和培养时间、乙酸钠质量浓度和柠檬酸三钠水合物质量浓度、乙酸钠质量浓度和培养时间及柠檬酸三钠水合物质量浓度和培养时间的交互作用对抑菌效果影响显著,但其他项不显著。
2.2 抑菌圈直径响应面分析与优化

图1 葡萄糖质量浓度和培养时间交互影响抑菌圈直径的响应面及其等高线图Fig.1 Response surface and contour plots for inhibition zone diameter versus glucose concentration and fermentation time
图1 显示了在乙酸钠质量浓度12.0g/L和柠檬酸三钠水合物质量浓度4.0g/L时,葡萄糖质量浓度与培养时间对抑菌圈直径的交互影响效应。在培养基中葡萄糖质量浓度较低(30.0g/L)时,抑菌圈直径随培养时间的延长而增大,而培养时间较短(36h)时,抑菌圈直径随培养基中葡萄糖质量浓度提高而增大,即较低葡萄糖质量浓度和较长培养时间对抑菌圈的效应与较高葡萄糖质量浓度和较短培养时间时的效应是相似的正效应,但后者的效应比前者更强,因此,提高培养基中葡萄糖质量浓度有利于提高细菌素的产量,并且缩短培养时间,从而缩短生产周期。据研究报道,葡萄糖对从酸马奶酒中分离的两株乳酸菌[28]和瑞士乳杆菌HF08[29]产抗菌物质也具有促进作用。
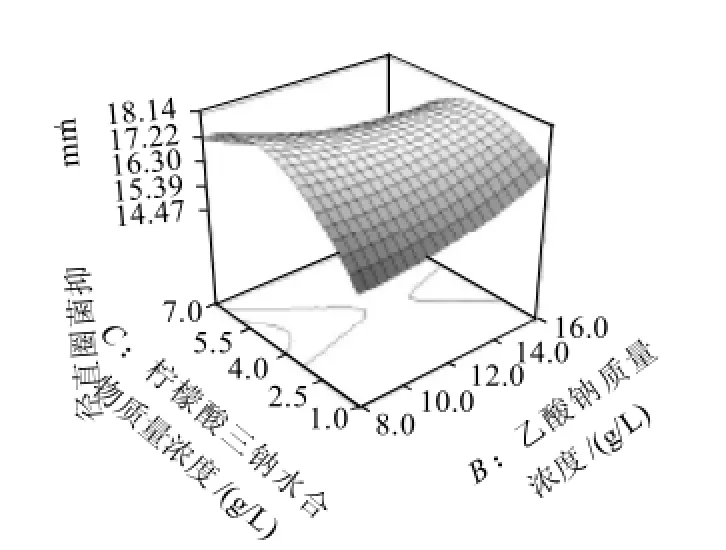
图2 乙酸钠质量浓度和柠檬酸三钠水合物质量浓度交互影响抑菌圈直径的响应面及其等高线图Fig.2 Response surface and contour plots for inhibition zone diameter versus sodium acetate and sodium citrate concentrations
图2显示了在葡萄糖质量浓度45.0g/L和培养时间48h时,乙酸钠质量浓度和柠檬酸三钠水合物质量浓度对抑菌圈直径的交互影响效应。乙酸钠质量浓度较低(8.0g/L)时,柠檬酸三钠水合物质量浓度在1.0~4.8g/L范围内抑菌圈直径随柠檬酸三钠水合物质量浓度提高而增大。乙酸钠质量浓度较高(16.0g/L)时,柠檬酸三钠水合物质量浓度在1.0~3.4g/L范围内抑菌圈直径同样随柠檬酸三钠水合物质量浓度提高而增大。但在培养基中较高乙酸钠质量浓度和较低柠檬酸三钠水合物质量浓度组合对抑菌圈直径的增大有更强的正效应。因此培养基中增加乙酸钠质量浓度,降低柠檬酸三钠水合物质量浓度有利于细菌素产量的提高。
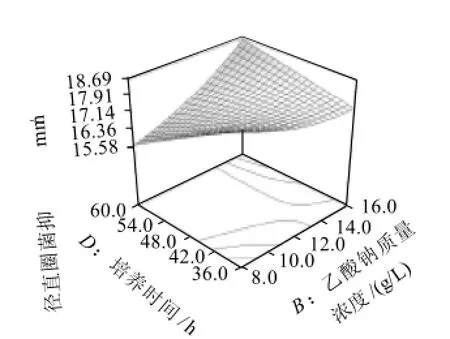
图3 乙酸钠质量浓度和培养时间交互影响抑菌圈直径的响应面及其等高线图Fig.3 Response surface and contour plots for inhibition zone diameter versus sodium acetate concentration and fermentation time
图3 显示了在葡萄糖质量浓度45.0g/L和柠檬酸三钠水合物质量浓度4.0g/L时,乙酸钠质量浓度和培养时间对抑菌圈直径的交互影响效应。在培养基中乙酸钠质量浓度较低(8.0g/L)时,抑菌圈直径随培养时间的延长而缩小。而乙酸钠质量浓度较高(16.0g/L)时,抑菌圈直径随培养时间的延长而增大。即低质量浓度乙酸钠和较短的培养时间及高质量浓度乙酸钠和较长的培养时间是同样的正效应。因此,较低的乙酸钠质量浓度和较短的培养时间内也可得到较高产量的细菌素。
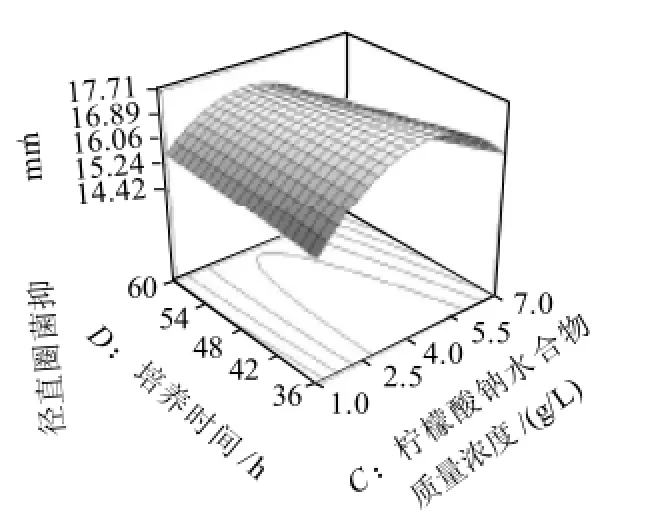
图4 檬酸三钠水合物质量浓度和培养时间交互影响抑菌圈直径的响应面及其等高线图Fig.4 Response surface and contour plots for inhibition zone diameter versus sodium citrate and fermentation time
图4 显示了在葡萄糖质量浓度45.0g/L和乙酸钠质量浓度12.0g/L时,柠檬酸三钠水合物质量浓度和培养时间对抑菌圈直径的交互影响效应。在培养时间较短(36h)时,培养基中柠檬酸三钠水合物质量浓度在1.0~4.5g/L范围内,抑菌圈直径随檬酸三钠水合物质量浓度的提高而增大,随后缩小;在培养时间较长(60h)时,在培养基中柠檬酸三钠水合物质量浓度在1.0~3.5g/L范围内,抑菌圈直径同样随柠檬酸三钠水合物质量浓度的提高而增大,随后缩小。但前者的效应有利于增大抑菌圈直径,并且有利于缩短培养时间。因此,适当提高柠檬酸三钠水合物的质量浓度有利于在较短培养时间内得到较高产量的细菌素。
总之,从提高发酵液细菌素产量和缩短生产周期要求考虑,提高培养基中葡萄糖质量浓度、降低乙酸钠质量浓度和适当提高柠檬酸三钠水合物质量浓度有利于在较短的培养时间内能得到产量较高的细菌素。
2.3 模型验证实验
鉴于嗜酸乳杆菌NX2-6产生细菌素模型的有效性,根据方程(2)预测结果选择最理想的5组发酵条件(取值位于上述各因素试验水平范围内)进行验证实验。对该模型方程求解得出在各因素分别为:葡萄糖质量浓度60.0g/L、乙酸钠质量浓度8.0g/L、柠檬酸三钠水合物质量浓度5.0g/L及培养时间36h时,可获得最大的抑菌圈直径,预测值为21.37mm(表4)。利用SAS软件对表中数据进行相关分析得知,嗜酸乳杆菌NX2-6产生的细菌素抑菌圈直径实测值与预测值的相关系数R2为0.9918,证明此模型是有效的,并且该优化后培养基与基础培养基相比,发酵液抗菌活性增加约80.0%。因此,利用响应曲面法对嗜酸乳杆菌NX2-6发酵产细菌素条件进行优化具有一定的实用价值和指导意义。

表4 模型验证实验结果Table 4 Results of validation experiments under optimal fermentation conditions
3 结 论
通过响应曲面法对嗜酸乳杆菌NX2-6产细菌素具有显著影响的葡萄糖质量浓度、乙酸钠质量浓度、柠檬酸三钠水合物质量浓度以及培养时间的最佳组合水平建立了二次多项数学模型,并利用统计学方法对该模型进行了显著性检验,探讨了各因素间的交互作用,优化了影响因素水平。对该模型方程求解得出在各因素分别为:葡萄糖质量浓度60.0g/L、乙酸钠质量浓度8.0g/L、柠檬酸三钠水合物质量浓度5.0g/L及培养时间36h时,可获得最大的抑菌圈直径,预测值为21.37mm。此预测值被5组验证实验所证实,相关系数R2为0.9918,并且优化条件下发酵液抗菌活性增加约80.0%。由此可见,利用响应曲面法对嗜酸乳杆菌NX2-6产生细菌素起显著影响因素的质量浓度水平及发酵时间进行优化具有显著效果。
[1]DEEGAN L H, COTTER P D, HILL C, et al. Bacteriocins: biological tools for bio-preservation and shelf-life extension[J]. International Dairy Journal, 2006, 16(9): 1058-1071.
[2]SAVADOGO A, OUATTARA C A T, BASSOLE I H N, et al. Bacteriocins and lactic acid bacteria: a minireview[J]. African Journal of Biotechnology, 2006, 5(9): 678-684.
[3]GALVEZ A, HIKMATE A, LOPEZ R L, et al. Bacteriocin-based strategies for food biopreservation[J]. International Journal of Food Microbiology, 2007, 120(1/2): 51-70.
[4]WIRAWAN R E, JACK R W, TAGG J R. A novel combination of bacteriocins produced by Streptococcus uberis strain 42[J]. International Congress Series, 2006, 1289: 355-358.
[5]CLEVELAND J, MONTVILLE T J, NES I F, et al. Bacteriocins: safe, natural antimicrobials for food preservation[J]. International Journal of Food Microbiology, 2001, 71(1): 1-20.
[6]郭兴华, 曹郁生, 东秀珠. 益生乳酸细菌: 分子生物学及生物技术[M].北京: 科学出版社, 2008: 214-271.
[7]DEMEO M, LAGET M, MATHIEU D. Application of experimental designs for optimization of medium and culture conditions in fermentation [J]. Bioscience, 1985, 4: 99-102.
[8]LI Chan, BAI Jinghua, CAI Zhaoling, et al. Optimization of a cultural medium for bacteriocin production by Lactococcus lactis using response surface methodology[J]. Journal of Biotechnology, 2002, 93(1): 27-34.
[9]HWANG S, LEE Y, YANG Keunyoung. Maximization of acetic acid production in partial acidogenesis of swine wastewater[J]. Biotechnology and Bioengineering, 2001, 75(5): 521-529.
[10]ELIBOL M. Optimization of medium composition for actinorhodin production by Streptomyces coelicolor A3(2) with response surface methodology[J]. Process Biochemistry, 2004, 39(9): 1057-1062.
[11]WANG Yunxiang, LU Zhaoxin. Statistical optimization of media for extracellular polysaccharide by Pholiota squarrosa (Pers. ex Fr.) Quel. AS 5.245 under submerged cultivation[J]. Biochemical Engineering Journal, 2004, 20(1): 39-47.
[12]LAI L S T, PAN C C, TZENG B K. The influence of medium design on lovastatin production and pellet formation with a high-producing mutant of Aspergillus terreus in submerged cultures[J]. Process Biochemistry, 2003, 38(9): 1317-1326.
[13]WANG Yunxiang, LU Zhaoxin. Optimization of processing parameters for the mycelial growth and extracellular polysaccharide production by Boletus spp. ACCC 50328[J]. Process Biochemistry, 2005, 40(3/4): 1043-1051.
[14]FRANCIS F, SABU A, NAMPOOTHIRI K M, et al. Use of response surface methodology for optimizing process parameters for the production of [alpha]-amylase by Aspergillus oryzae[J]. Biochemical Engineering Journal, 2003, 15(2): 107-115.
[15]ELIBOL M, OZER D. Response surface analysis of lipase production by freely suspended Rhizopus arrhizus[J]. Process Biochemistry, 2002, 38 (3): 367-372.
[16]VASCONCELOS A F D, BARBOSA A M, DEKKER R F H, et al. Optimization of laccase production by Botryosphaeria sp. in the presence of veratryl alcohol by the response-surface method[J]. Process Biochemistry, 2000, 35(10): 1131-1138.
[17]WEI Q K, CHEN T R, CHEN J T. Using of Lactobacillus and Bifidobacterium to product the isoflavone aglycones in fermented soymilk [J]. International Journal of Food Microbiology, 2007, 117(1): 120-124.
[18]OTIENO D O, ASHTON J F, SHAH N P. Isoflavone phytoestrogen degradation in fermented soymilk with selected [beta]-glucosidase producing L. acidophilus strains during storage at different temperatures[J]. International Journal of Food Microbiology, 2007, 115(1): 79-88.
[19]OTIENO D O, ASHTON J F, SHAH N P. Evaluation of enzymic potential for biotransformation of isoflavone phytoestrogen in soymilk by Bifidobacterium animalis, Lactobacillus acidophilus and Lactobacillus casei[J]. Food Research International, 2006, 39(4): 394-407.
[20]PRICHARD M, SHIPMAN J C. A three-dimensional model to analyze drug-drug interactions[J]. Antiviral Research, 1990, 14: 181-206.
[21]管峥, 毕姗姗, 杨璐, 等. 响应曲面模型在麻醉药合用中药物-药物相互作用研究的进展[J]. 药学学报, 2008, 43(12): 1171-1178.
[22]WUYUNDALAI, L Fengxia, SUN Huigang, et al. The antibacterial properties and strain identification of Lactobacillus acidophilus NX2-6 screened from Chigee[J]. Milchwissenschaft, 2010, 65(2): 144-148.
[23]乌云达来, 陆兆新, 吕凤霞, 等. 嗜酸乳杆菌NX2-6液体发酵产细菌素培养基及其主要影响因子筛选[J]. 食品科学, 2009, 30(13): 187-191.
[24]内村泰. 乳酸菌的分离鉴定(日文版)[M]. 东京: 朝仓书店, 1992: 29-72.
[25]凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 84-108.
[26]HOLO H, NILSSEN O, NES I. Lactococcin A, a new bacteriocin from Lactococcus lactis subsp. cremoris: isolation and characterization of the protein and its gene[J]. Journal of Bacteriology, 1991, 173(12): 3879-3887.
[27]DERAZ S F, KARLSSON E N, HEDSTROM M, et al. Purification and characterisation of acidocin D20079, a bacteriocin produced by Lactobacillus acidophilus DSM 20079[J]. Journal of Biotechnology, 2005, 117(4): 343-354.
[28]翟光超, 贺银凤. 酸马奶酒中两株产抑菌物质乳酸菌培养基的优化[J]. 食品工业科技, 2005, 26(9): 96-98.
[29]田宇, 洪芳, 胡承, 等. 类细菌素产生菌HF08的选育及其发酵条件的研究[J]. 食品与发酵工业, 2004(3): 56-60.
Optimization of Fermentation Conditions for Bacteriocin Production by Lactobacillus acidophilus NX2-6
WUYUNDALAI1,2,LU Zhao-xin1,*,Feng-xia1,BIE Xiao-mei1,LU Ya-ping1,SUN Hui-gang1,CHAGANQILAO1
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China)
Three culture medium components including glucose, sodium acetate and sodium citrate and fermentation time were identified as key factors that affect bacteriocin production by Lactobacillus acidophilus NX2-6 using a Plackett-Burman design and their optimal levels were investigated using response surface methodology based on a Box-Behnken experimental desiign. The optimal levels of glucose, sodium acetate and sodium citrate concentrations and fermentation time were determined to be 60.0 g/L, 8.0 g/L, 5.0 g/L and 36 h, respectively based on the established quadratic polynormial regression equation for inhibition zone diameter of fermentaton broth. Under these conditions, the predicted inhibition zone diameter of fermentaton broth was 0.9918. The optimized culture medium resulted in an increase of approximately 80.0% in the antibacterial activity of fermentation broth compared to the basic culture medium. Therefore, response surface methodology can provide an economic, effective and reasonal strategy for the optimization of fermentation conditions for bacteriocin production by Lactobacillus acidophilus NX2-6.
L.acidophilus;bacteriocins;fermentation conditions;optimization
Q939.117
A
1002-6630(2012)03-0179-05
2011-03-04
国家“863”计划项目(2007AA10Z357)
乌云达来(1975—),男,副教授,博士,研究方向为食品微生物。E-mail:wydl@imau.edu.cn
*通信作者:陆兆新(1957—),男,教授,博士,研究方向为食品微生物与生物技术。E-mail:fmb@njau.edu.cn
