HSP70-HBsAg基因修饰DC瘤苗抗肝癌作用的实验研究
2012-06-01幸思忠薛冀苏李鹤平赖伏虎黄呈辉曾志荣杨建勇龙健婷
幸思忠 薛冀苏 李鹤平 赖伏虎 黄呈辉 曾志荣 杨建勇 龙健婷
肝癌为我国常见恶性肿瘤之一,我国每年约有11万人死于肝癌,且发病率有上升趋势。肝癌的免疫治疗是医学领域研究的热门课题。在我国,肝癌的发生与HBV感染密切相关,相关研究已经发现肝癌患者血清乙肝表面抗原(HBsAg)检出率高达90%以上,提示HBsAg是肝癌的重要相关抗原之一。我们以往研究发现,HBsAg修饰的树突状细胞(DC)瘤苗对肝癌荷瘤小鼠产生有较明显的免疫治疗作用,同时能够诱导机体产生一定的抗肝癌免疫保护作用。但这种特异性的CTL效应还不够理想,如何提高DC提呈抗原能力,成为进一步诱导的特异性CTL的关键。已有研究发现热休克蛋白-70(HSP70)参与抗原提呈加工、协同免疫及自身免疫,可能是一种理想的疫苗增效剂[1]。本研究以HepG222.1.5肝癌细胞负荷小鼠模型,通过HSP70-HBsAg嵌合基因的重组腺病毒载体(Ad-HSP70-HBsAg)的介导,探讨HSP70-HBsAg嵌合基因修饰DC瘤苗对肝癌动物模型的免疫治疗效果,以期为HSP70-HBsAg嵌合基因修饰DC瘤苗治疗肝癌提供实验依据。
1 材料与方法
1.1 动物和细胞株
C57BL/6J小鼠,雌性,6~8周龄,购自中山大学实验动物中心。HepG222.1.5细胞系为整合HBV基因的肝癌细胞系,能够稳定表达HBsAg和分泌HBV DNA,由南方医科大学附属南方医院感染科惠赠。
1.2 主要试剂
重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)、重组小鼠白介素-4(rmIL-4)、重组小鼠白介素-2(rmIL-2)和重组小鼠肿瘤坏死因子(rmTNF-α)购自深圳晶美公司。 RPMI 1640培养液、胎牛血清(FBS)、0.25%胰酶消化液和青霉素/链霉素购自Life Technologies公司。丝裂霉素C(Mitomycin C)、G418、四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、刀豆蛋白A(concanavalin, ConA)购自Sigma公司。腺病毒载体Ad-HSP70-HBsAg由本室自行构建[2]。
1.3 小鼠骨髓树突状细胞的体外培养
参考Inaba[3]等方法并稍作改进,拉颈处死C57BL/6J小鼠,无菌取小鼠的股骨、胫骨,用PBS液清洗股骨、胫骨3次。剪开股骨、胫骨的两端,用PBS液冲出骨髓细胞,收集骨髓细胞悬液,用红细胞裂解液(Tris NH4Cl)处理后,于300g(离心力),离心10min。以含10%FBS RPMI-1640培养液调整细胞的密度为2×106/ml,加入到6孔培养板中,每孔2ml,于37℃、5%CO2孵箱孵育2h,轻轻吸弃未粘附的悬浮细胞,用RPMI-1640液冲洗3次去掉未粘附细胞,再加入2ml含细胞因子rmGM-CSF(100ng/ml)和rmIL-4(50 ng/ml)的完全RPMI 1640液,于37℃、5%CO2孵箱中进行培养。隔天半量换液1次,补加细胞因子。于第7天,添加5ng/ml rmTNF-α,继续培养至第12d,收集悬浮细胞为成熟的DC细胞。
1.4 HBsAg--HSP70-DC瘤苗的制备[4]
按上述方法分离小鼠骨髓细胞,进行DC诱导培养,于培养的第5天时加入200μl腺病毒Ad-HSP70-HBsAg(1×107病毒/m1),于37℃、5%CO2孵箱中进行培养,病毒感染后第一天,将培养液体上清去除,加入含细胞因子新鲜培养液继续培养,以后隔天半量换液1次,继续培养至第10天,收获细胞。
1.5 荷瘤小鼠模型的建立
正常C57BL/6J小鼠随机分成3组(每组10只),将对数生长期的HepG222.1.5肝癌细胞接种于小鼠右后腿根部外侧腿(5×105细胞/只,0.2mL/只),建立荷瘤小鼠模型,每2~3天观察一次肿瘤生长情况。
1.6 HSP70-HBsAg-DC瘤苗对实验性肝癌的治疗
1.6.1 HSP70-HBsAg-DC瘤苗回输途径比较及对荷瘤小鼠的治疗效果
按1.5方法建立的荷瘤小鼠模型,7d后分别通过瘤体内(intra-tumor)注射,皮下(hypo-derma1)注射或尾静脉(intravein)注射HSP70-HBsAg-DC瘤苗(1×106细胞/只,0.2mL/只),7d后再加强免疫治疗1次,每2d~3d观察一次肿瘤生长情况,测量相互垂直的最大径,以面积表示肿瘤大小,记录肿瘤生长曲线。
1.6.2 HSP70-HBsAg-DC瘤苗免疫治疗效果
将对数生长期的HepG222.1.5肝癌细胞接种于小鼠腿部皮下(5×105细胞/只),随机分3组,每组10只,7 d后采用最佳免疫治疗途径,分别注射HSP70-HBsAg-DC瘤苗(1×106细胞/只,0.2mL/只)、HBsAg-DC瘤苗(1×106细胞/只,0.2mL/只)、未转染DC瘤苗(1×106细胞/只,0.2mL/只),7d后再加强免疫治疗1次,每2~3d观察一次肿瘤生长情况,测量相互垂直的最大径,以面积表示肿瘤大小,记录肿瘤生长曲线,共观察36d。
1.7 HSP70-HBsAg-DC瘤苗对实验性肝癌的免疫保护性作用
正常C57BL/6J小鼠随机分成3组(每组10只),经HSP70-HBsAg-DC瘤苗(1×106细胞/只,0.2mL/只)、HBsAg-DC瘤苗(1×106细胞/只,0.2mL/只)、未转染DC瘤苗(1×106细胞/只,0.2mL/只)分别皮下注射免疫2次,间隔7d,于第2次免疫后7d,分别从皮下接种对数生长期的HepG222.1.5肝癌细胞,观察瘤体生长情况,共观察36d。
1.8 统计学处理
使用SPSS12.0统计软件进行统计学分析。计量资料以均值±标准差(±s)表示,资料采用方差统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同途径注射HSP70-HBsAg-DC瘤苗对荷瘤小鼠模型治疗效果比较
我们首先比较了HSP70-HBsAg-DC瘤苗不同途径回输后的抗肿瘤效应。分别通过皮下、尾静脉、瘤体内注射HSP70-HBsAg-DC瘤苗对荷瘤小鼠模型治疗,36天内肿瘤大小变化见表1。可以看出,皮下注射HSP70-HBsAg-DC瘤苗组肿瘤的生长明显缓慢,经方差统计分析,皮下、尾静脉、瘤体内注射三组之间比较有明显差异(F=18.2253,P<0.01),两两之间比较:瘤苗皮下注射组与瘤体内注射组比较,q=8.5382,P<0.01,有明显统计学差异;皮下注射组与尾静脉注射组比较,q=4.2827,P<0.01,有明显统计学差异;瘤体内注射组与尾静脉注射组比较,q=4.2555,P<0.01,有明显统计学差异。根据统计学结果,皮下注射HSP70-HBsAg-DC瘤苗组明显优于瘤体内注射组、尾静脉注射,提示最佳免疫治疗途径为皮下注射途径。因此,我们采用皮下注射途径进行下列各项实验研究。

表1 HSP70-HBsAg-DC瘤苗不同途径回输后肿瘤在体内的生长大小比较(mm2)
2.2 HSP70-HBsAg-DC瘤苗皮下免疫治疗效果分析
从表2可见,采用皮下免疫治疗,HSP70-HBsAg-DC瘤苗组肿瘤的生长明显缓慢,HBsAg-DC瘤苗组次之,未转染DC组肿瘤的生长速度最快,提示采用皮下注射HSP70-HBsAg-DC瘤苗对实验性肝癌有一定的免疫治疗作用。经方差分析,HSP70-HBsAg-DC组、HBsAg-DC组、未转染DC组三组之间比较有明显差异(F=25.8472,P<0.01),两两之间比较:HSP70-HBsAg-DC组与HBsAg-DC组,q=3.4595,P<0.05,有明显统计学差异;HSP70-HBsAg-DC组与未转染DC组比较比较,q=10.0102,P<0.01,有明显统计学差异;HBsAg-DC组与未转染DC组比较,q=6.5506,P<0.01,有明显统计学差异。因此,采用皮下免疫治疗,HSP70-HBsAg-DC组优于HBsAg-DC瘤苗组、未转染DC组(P<0.05)。
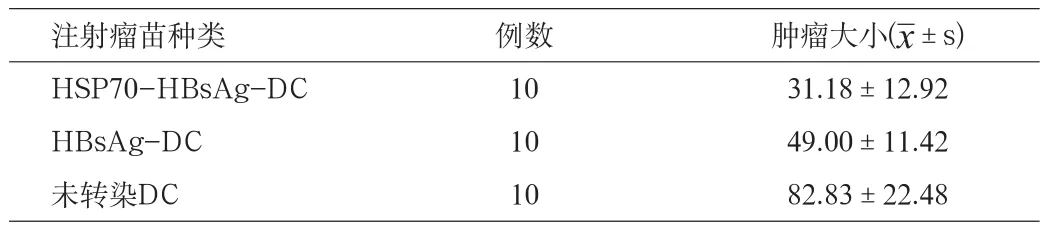
表2 HSP70-HBsAg-DC、HBsAg-DC、未转染DC回输后肿瘤在体内的生长大小比较(mm2)
2.3 HSP70-HBsAg-DC瘤苗免疫接种后对HepG222.1.5细胞攻击的免疫保护作用
免疫小鼠对HepG222.1.5肝癌细胞再次攻击的抵抗作用如表3所示,HSP70-HBsAg-DC瘤苗免疫小鼠能有效抵抗HepG222.1.5肿瘤细胞的再次攻击,HSP70-HBsAg-DC瘤苗免疫接种后,肿瘤的生长受到明显抑制,瘤体出现延迟,同时生长减慢,HSP70-HBsAg-DC组、HBsAg-DC组、未转染DC组三组间36天内肿瘤大小变化分别为:(11.08±5.61)mm2、(33.12±11.67)mm2、(63.31±28.92)mm2,未转染DC对HepG222.1.5细胞攻击的保护作用明显减弱,而未转染DC组对HepG222.1.5细胞的攻击保护作用很弱,所有小鼠均长出肿瘤。经方差分析,HSP70-HBsAg-DC组、HBsAg-DC组、未转染DC组三组之间比较有明显差异(F=20.5431,P<0.01)。提示HBsAg-DC瘤苗免疫接种对肝癌细胞有一定的免疫保护作用。

表3 HSP70-HBsAg-DC、HBsAg-DC、未转染DC对HepG222.1.5细胞攻击的免疫保护后肿瘤在体内的生长情况比较(mm2)
3 讨论
近来研究发现,DC瘤苗注射途径对诱导全身性免疫应答意义重大[5-6]。DC瘤苗的输入途径可能决定了细胞免疫能否发生及发生的强弱。有文献报道用111In标记的DC分别经静脉、皮下和皮内途径 注入患者体内,发现静脉注入的DC主要分布于肝脏、脾和骨髓,而皮内注入的DC快速移至局部淋巴结[7]。Fong等[8]将体外致敏的DC分别采用皮内、淋巴管及静脉三种不同的途径输入前列腺癌患者体内,发现三种途径虽然均能诱导抗原特异性T细胞免疫应答,但反应程度各不相同。经皮内和淋巴管途径能产生高水平的TNF-γ,更易诱导Th1 应答,动物实验表明,皮内和皮下注射DC比静脉注射更易诱导CTL反应。皮下免疫DC瘤苗倾向于产生Th1型免疫应答,而静脉注射DC瘤苗倾向于Th2型免疫应答[9]。由于皮下注射使用方便,无输液反应且易诱导Th1应答,是使用DC瘤苗的较好途径。
宋文刚等[10]采用皮下注射、静脉注射和瘤体注射三种途径回输AFP-DC瘤苗,比较观察AFP-DC瘤苗对荷瘤小鼠免疫治疗作用,发现皮下注射AFP-DC瘤苗治疗效果在抑制肿瘤生长、延长小鼠存活期方面都明显优于瘤体内注射或尾静脉注射。我们以往研究发现,采用皮下注射途径注射HBsAg修饰的树突状细胞(DC)瘤苗,对肝癌荷瘤小鼠能够产生特异性的CTL效应,延缓肿瘤的生长,但这种免疫治疗还不够理想,如何进一步这种提高特异性CTL的效应?研究发现DC、巨噬细胞等抗原提呈细胞表面存在热休克蛋白(HSP)受体,热休克蛋白70(HSP70)融合蛋白能够刺激DC上MHCI、MHCII及B7分子水平,还可激活NK细胞,从而进一步达到增强免疫效果的作用。目前,HSP70被认为可能是一种理想的疫苗增效剂。为此,我们前期构建了携带HSP70-HBsAg嵌合基因的重组腺病毒载体,建立了携带HSP70-HBsAg嵌合基因的DC瘤苗,初步实验发现,皮下注射HSP70-HBsAg-DC瘤苗组肿瘤的生长较静脉注射组、瘤体内注射组明显减慢。造成以上结果的可能原因:实验动物皮下免疫DC瘤苗,能够按照预期的目的进人引流淋巴结;实验动物静脉注射DC瘤苗后,DC首先聚集在肺脏、然后是肝脏、脾脏,它们不能有效的进入淋巴结,导致相应T细胞克隆的失能;瘤体注射DC瘤苗后,因肿瘤微环境产生免疫抑制因子影响DC发挥作用。
本实验还发现,HSP70-HBsAg-DC瘤苗皮下免疫的体内抗肿瘤效应明显优于单纯HBsAg瘤苗组和空白对照组,这可能与HSP70作为免疫优势抗原诱导细胞和体液免疫,具有明显的免疫佐剂效应相关[11]。本研究结果显示,HSP70能够增强免疫反应的作用,通过转基因手段诱导抗肝癌肿瘤免疫,可能是一种具有潜在应用前景的生物治疗方法。
[1]Hsu KF, Hung CF,Cheng WF, et al. Enhancement of suicidal DNA vaccine potency by linking Mycobacterium tuberculosis heat shock protein 70 to an antigen[J]. Gene Ther, 2001,8(5):376-383.
[2]雷春亮,黄呈辉,杨湛,等.携带HSP70-HBsAg嵌合基因复制缺陷型重组腺病毒的制备[J].中华实验和临床病毒学杂志,2008,22(1):136-138.
[3]Inaba K,Inaba M,Romani N,et al.Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with grannulocyte/macrophage colony stimulating factor[J].J Exp Med,1992,176:1693-1702.
[4]雷春亮,欧阳玲,杨湛,等.腺病毒介导HSP70-HBsAg嵌合基因转染树突状细胞及生物学特性分析[J].中华实验和临床病毒学杂志,2009,23(1):29-31.
[5]Lambert LA,Gibson GR,Maloney M,et al.Intranodal immunization with tumor lysate-pulsed dendritic cells enhances protective antitumor immunity[J].Cancer Res,2001,61(2):641-646.
[6]王宝中,王丽萍,王彦文,等.单用A23187诱导外周血单个核细胞成树突状细胞及其介导耐药肿瘤细胞杀伤的实验研究[J].当代医学,2010,16(10):12-13.
[7]Morse MA,Coleman RE,Akabani G,et al.Migration of human dendritic cells after injection in patients with metastatic malignancies[J].Cancer Res,1999,59:56-58.
[8]Fong L,Broch stedt D,Benike C,et al.Dendritic cells injected viadifferent routes induce immunity in cancer patients[J].J Immunol,2001,166:4254-4259.
[9]Timmerman JM,Levy R.Linkage of foreign carrier protein to a self-tumor antigen enhances the immunogenicity of a pulsed dendritic cell vaccine[J].J lmmunol,2000,164:4797-4803.
[10]宋文刚,曲迅,李雅林,等.不同途径免疫的AFP基因修饰DC瘤苗体内抗肿瘤效应的研究[J].中国肿瘤生物治疗杂志,2004,11(1):22-26.
[11]Broquet AH,Thomas G,Masliah J,et al.Expression of the molecular chaperone Hsp70 in detergent-resistant microdomains correlates with its membrane delivery and release[J].J Bio Chem,2003,278(24):21601-21606.