新型基质固相萃取重金属离子分析及残留关联性
2012-05-30武晓鹏孙东海周建钟
郭 明,武晓鹏,孙东海,周建钟,张 华
(浙江农林大学 理学院,浙江 临安 311300)
重金属污染具有多源性、隐蔽性、污染后果严重等特点,重金属残留对人类健康造成危害而不易被人们察觉[1-3],因而成为环境污染研究的热点和难点问题。目前,重金属污染呈上升趋势[4],林果产品等涉林食品中的重金属残留问题也逐渐显现,重金属残留分析检测受到充分重视,投入大量资金和人力来开发和应用重金属残留含量分析新技术,其中,样品前处理是关键点。当前常用的样品前处理技术如萃取、层析、蒸馏等[5]方法较为成熟,但存在操作繁琐、处理周期长、重复性差、使用大量有机溶剂造成环境二次污染等缺点。因此,研究成本低、操作简便、高效率、高选择性的样品分离/分析技术,已成为当今重金属残留含量分析检测的前沿课题[6]。基质固相萃取(matrix solid-phase dispersion,MSPD)技术是近年迅速发展起来的一种固液分离萃取样品新技术,其将吸附材料直接与待测样品混合研磨后作为吸附基质装柱,再通过溶剂洗脱、浓缩等完成样品预处理[7-8]。该方法处理样品具有灵活、经济和环境友好等特点,在环境、食品、医药卫生等领域得到了快速发展[10-14]。MSPD技术中,填料基质是关键,目前常用的有反相十八烷基键合硅胶、活性炭、树脂等,发展新型功能基质是MSPD技术热点研究领域[15],同时,不同柱管型式影响分离效能是另一个考虑的重点[16]。山核桃Carya cathayensis为中国特产树种[17-18],也是浙江杭州地区特色食用品(主要分布在天目山区)。山核桃具有解毒、消肿之功效,临床多用于脚痔、皮肤癣症等[19];山核桃叶中含有大量生物活性物质[20],如酚类、植物甾醇、萜类、多糖、有机酸、蒽醌类、强心苷、三萜类化合物等,极具药用价值。山核桃的食用、药用价值与其品质密切相关,当前,人们密切关注山核桃中的污染物,尤其是重金属离子含量对其品质的影响。由于山核桃具有硬实坚果的特点,其内含污染物通过经典分析较为繁琐,尤其是样品的前处理过程。人们试图建立山核桃中污染物的快捷分析方法,其中样品预处理技术及前期预示山核桃污染物方法是重要研究方向。目前,利用MSPD分离并检测山核桃重金属离子的研究尚未见文献报道。
1 材料与方法
1.1 实验仪器、试剂与材料
原子吸收分光光度计(AA6800G,日本岛津);固相萃取小柱(中国上海月旭材料科技)。
石英砂、壳聚糖、草酸、氢氧化钠、硝酸均为分析纯(中国华东医药股份有限公司);钠基膨润土(过0.076mm筛,购于中国浙江省临安城北膨润土有限公司)。山核桃叶及果实于8月初采集于临安天目山。选取海拔50 m,同一水平上长势、健康程度、所处环境等条件基本一致的优质果树作为样本点,采用S形方式采样,采集健康无病虫害的树叶及果实样品。采集的山核桃叶及果实经蒸馏水、去离子水洗净、干燥后,混匀放入研钵中并加入石英砂进行鲜样研磨,过60目网筛后置于样品瓶中备用。
1.2 实验方法
1.2.1 膨润土改性 称取1.0 g壳聚糖,搅拌条件下缓慢加入20.0 mL体积分数为10%草酸溶液,加热至50℃,充分混匀,得到淡黄色黏滞性溶胶。加入30.0 mL去离子水稀释,50℃搅拌30 min,缓慢加入8.0 g钠基膨润土,继续搅拌2 h。加入适量1.0 mol·L-1氢氧化钠(NaOH),搅拌1 h后用去离子水洗至中性,得到蓬松的絮状颗粒膨润土,抽滤微干后保存备用。
1.2.2 接续式基质固相萃取柱管设计与制作 接续式基质固相萃取柱为本实验室专利产品(专利授权号:ZL 201020243703.4)。该设计萃取柱管可根据实际需要进行接续以增加柱效,也可通过调节柱径及填料高度以增加柱效,既考虑了降低萃取剂消耗成本,又增加了装柱填实的便捷性,提高了通用性。
1.2.3 标准溶液吸附、洗脱效果测试 40.0 mL 0.3 mol·L-1的标准镍离子(Ni2+)和铜离子(Cu2+)组混合溶液,缓慢通过装有新型吸附基质材料的吸附柱管,去离子水淋柱,收集流出液,定容至100.0 mL,测定金属离子浓度(原子吸收分光光度法,AAS),计算吸附百分率。然后用40.0 mL 0.2 mol·L-1的硝酸(HNO3)溶液充分淋洗解吸,再用去离子水淋洗,收集全部流出液,定容至100.0 mL,测定金属离子浓度(AAS),计算洗脱百分率。
1.2.4 山核桃叶中镍离子(Ni2+)和铜离子(Cu2+)组的分离、富集 准确称取1.0 g山核桃叶片放入研钵中,加入一定配比的新型吸附基质功能材料进行研磨,控制研磨时间为10 min,待混合基质研磨至细小颗粒状时,进行干法装柱,再以硝酸溶液进行洗脱提取,并对提取结果进行分析、检测。本研究采用正交试验确定新型MSPD提取重金属离子组的最佳反应(单因素实验结果此处不详细列出)条件,影响因素考虑原料配比、洗脱剂浓度与洗脱剂用量,选定3因素3水平均匀设计进行实验,L9(34)因素水平表见表1。
1.2.5 线性关系分析及镍离子(Ni2+)和铜离子(Cu2+)组含量测定 准确称取0.0393 g硫酸铜(CuSO4·5H2O),0.0495 g 硝酸镍(NiNO3·6H2O)于 100.0 mL 容量瓶, 配置 100.0 mg·L-1的标准镍离子(Ni2+)和铜离子(Cu2+)溶液,稀释10倍配置成10.0 mg·L-1的标准重金属离子溶液,分别量取0.0,1.0,2.0,3.0,4.0,5.0mL标准液于100.0 mL容量瓶中,定容,采用原子吸收分光光度计测定吸光度,绘制重金属离子浓度—吸光度标准曲线。将1.2.4中新型基质固相萃取柱分离的洗脱液转入100.0 mL容量瓶中,定容,按上述方法测定吸光度,并对含量进行计算分析,获得新型基质固相萃取柱最佳工艺条件。

表1 正交因子水平表[L9(34)]Table1 Factors and levels of orthogonal experiment
1.2.6 山核桃果实重金属离子组残留含量关联分析 用1.2.5中得出的新型基质固相萃取柱最佳工艺条件按1.2.4节方法同样处理山核桃果实,所得流出液定容后采用原子吸收分光光度计测定吸光度,计算镍离子(Ni2+)和铜离子(Cu2+)组残留含量,并进行山核桃叶与果实中重金属离子的残留关联性分析。
1.2.7 新型基质固相萃取柱的实用可信度验证 分别采用新型基质固相萃取柱和经典消解方法对镍离子(Ni2+)和铜离子(Cu2+)重金属离子组含量进行AAS吸光度测定,所得结果取平均值,以平均值简洁比较方法进行统计对比,从而验证新型基质固相萃取柱的实用性及可信度。
2 结果与讨论
2.1 重金属离子标准曲线制作及线性关系分析
配制成不同质量浓度的标准镍离子(Ni2+)和铜离子(Cu2+)组溶液,测定吸光度,以质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线如图1所示,所得线性回归方程列于表2。
由图1及表2可见:各标准曲线方程线性良好,可依据标准曲线方程线性计算镍离子(Ni2+)和铜离子(Cu2+)组的质量浓度。
2.2 新型基质固相萃取柱吸附效率及洗脱效果测试
镍离子(Ni2+)和铜离子(Cu2+)组标准混合溶液以定速过柱,硝酸溶液洗脱后收集流出液,采用AAS方法测定吸光度,换算得出重金属离子的量,进而分别求出吸附效率及洗脱率,结果见表3。
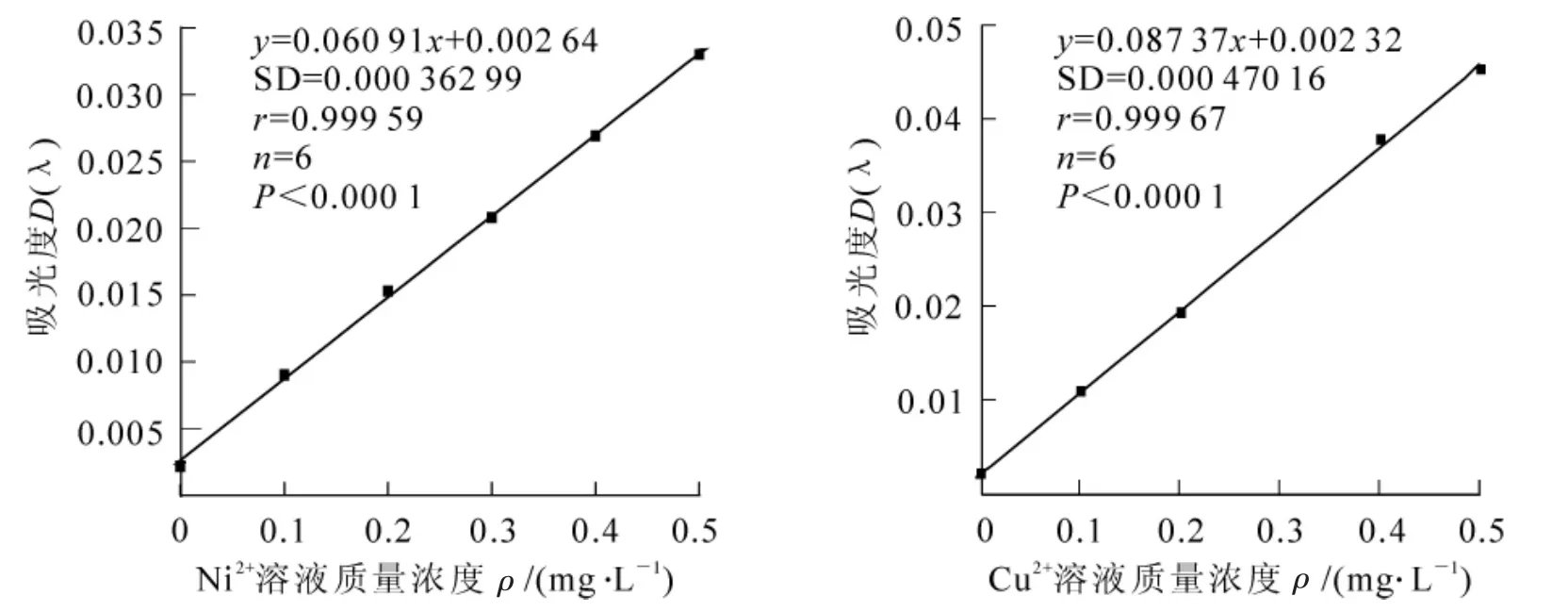
图1 镍离子(Ni2+)和铜离子(Cu2+)溶液标准曲线Figure1 Standard curve of Ni2+and Cu2+heavy metal ions solution
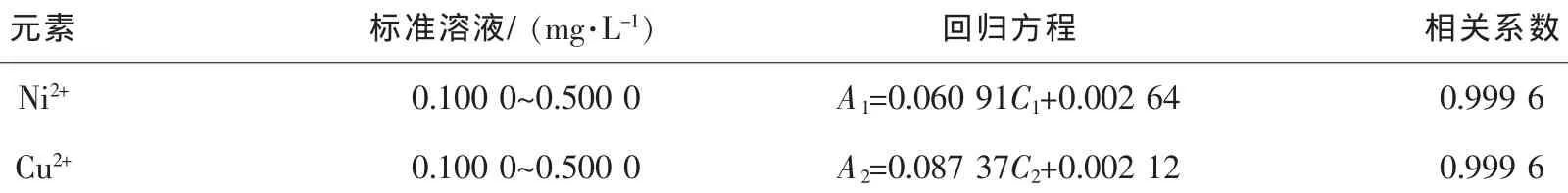
表2 镍离子(Ni2+)和铜离子(Cu2+)标准溶液线性回归方程Table2 Linear regression equation of Ni2+and Cu2+standard solution

表3 新型基质固相萃取柱处理镍离子(Ni2+)和铜离子(Cu2+)标准溶液吸附与洗脱率结果Table3 Absorption and elution rate of the new matrix solid-phase extraction column for Ni2+and Cu2+solution
由表3可见镍离子(Ni2+)和铜离子(Cu2+)溶液经新型基质固相萃取柱提取、富集后吸附率均大于90%,经硝酸溶液洗脱,2种重金属离子洗脱率也达到70%以上,由此可得新型吸附基质功能材料对于镍离子(Ni2+),铜离子(Cu2+)等具有良好的吸附效果,洗脱也很方便,分离重金属离子的可行性良好。
2.3 新型基质固相萃取柱提取重金属离子的正交实验结果
考虑原料配比、洗脱剂浓度与洗脱剂用量影响因素,将AAS测定新型基质固相萃取柱提取山核桃叶中重金属离子的实际量作为指标,按1.2.4节进行3因素3水平正交试验,结果如表4~5。

表4 镍离子(Ni2+)实验的 L9(34)正交表和分析结果Table4 L9(34) orthogonal table of Ni ion experiment and analysis results
从表4中可以看出:①k3>k2>k1;②k3>k2>k1;③k1>k2>k3。因此,山核桃叶片中重金属镍离子(Ni2+)提取、富集最佳工艺条件为A3B3C1,即原料配比=1∶5;洗脱剂浓度=0.4 mol·L-1;洗脱剂用量=30.0 mL。极差分析结果表明,3因素中影响顺序为原料配比>洗脱剂浓度>洗脱剂用量。
从表5中可以看出:①k3>k2>k1;②k3>k2>k1;③k1>k3>k2。因此,山核桃叶中重金属铜离子(Cu2+)提取、富集最佳工艺条件为A3B3C1,即原料配比=1∶5;洗脱剂浓度=0.4 mol·L-1;洗脱剂用量=30.0 mL。极差分析结果表明,3因素中影响顺序为原料配比>洗脱剂浓度>洗脱剂用量。
2.4 山核桃果实重金属离子组残留含量关联分析
采用新型基质固相萃取柱并选用最佳工艺条件处理山核桃果实,原子吸收分光光度计测定吸光度,计算镍离子(Ni2+),铜离子(Cu2+)组残留量。同时,进行山核桃叶片及果实中重金属离子残留关联性分析,结果见表6及图2。
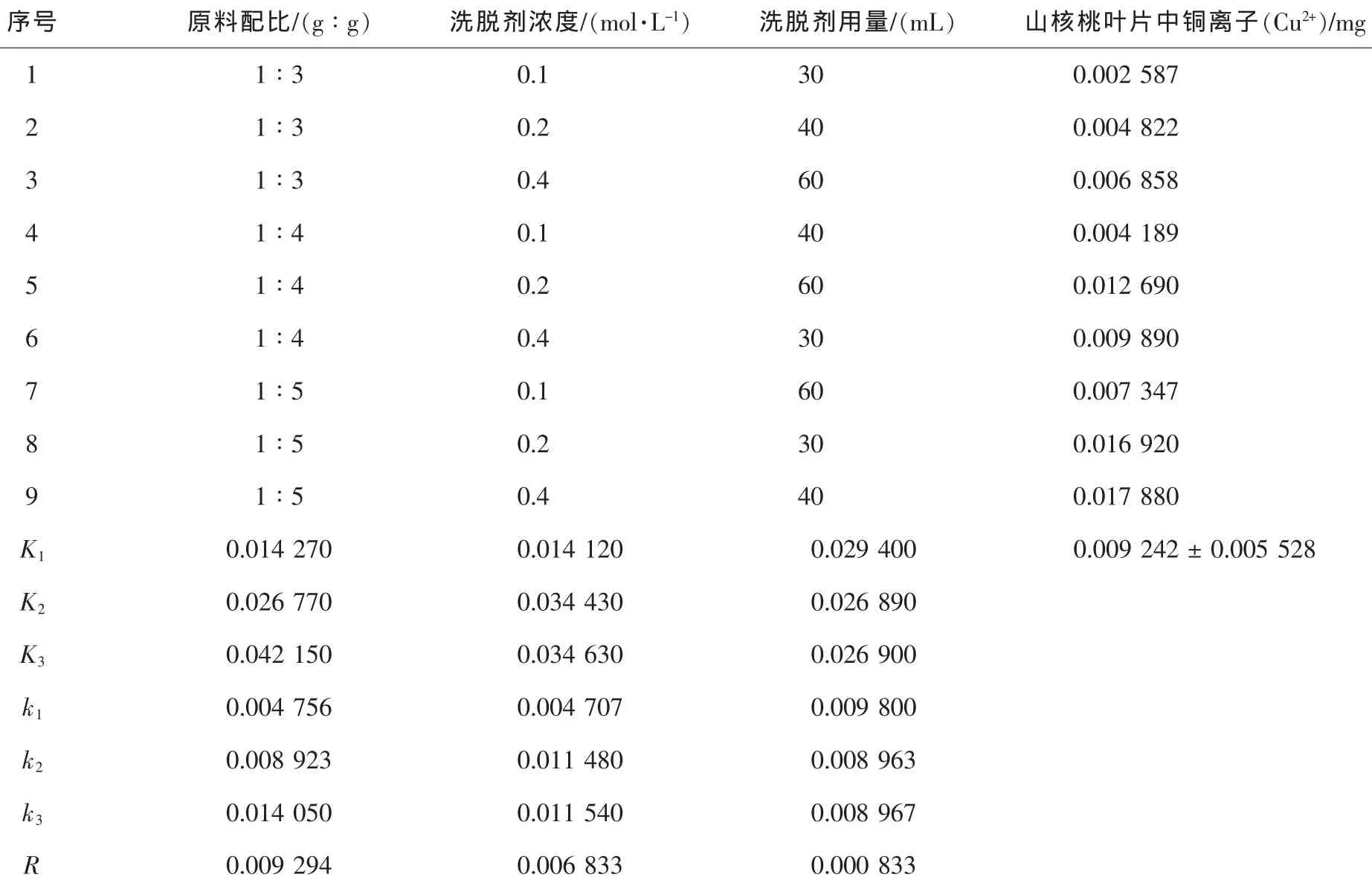
表5 铜离子(Cu2+)实验的L9(34)正交表和分析结果Table5 The L9(34) orthogonal table of Cu2+ion experiment and analysis results

表6 山核桃果实中重金属镍离子(Ni2+)和铜离子(Cu2+)的残留含量及关联性分析Table6 Residual content of Ni2+,Cu2+ions in the pecan fruit and the analysis of correlation
由图2可知:山核桃果实中镍离子(Ni2+)量占山核桃叶片中镍离子(Ni2+)量的2.9%;山核桃果实中铜离子(Cu2+)的量占核桃叶片中铜离子(Cu2+)的量的3.7%;同时,分别将取自不同样点山核桃叶片与果实的镍离子(Ni2+),铜离子(Cu2+)残留量做组相关分析,由表6方程可见:山核桃果实中镍离子(Ni2+),铜离子(Cu2+)量与叶中镍离子(Ni2+), 铜离子(Cu2+)量的相关系数 r分别为 0.8856和0.8453。由此可知:镍离子(Ni2+),铜离子(Cu2+)可能随着茎叶的传导作用进入果实,在果实中逐渐积累,存在一定的残留关联性。
2.5 新型基质固相萃取柱实用、可信度验证
采用经典方法对镍离子(Ni2+)和铜离子(Cu2+)组进行吸光度测定,分别称取0.3003,0.3006,0.3008 g叶子及0.3001,0.3004,0.3006 g果实进行平行实验,样本为小样本,取平均值计算。同时,结合2.3节采用新型基质固相萃取柱最佳工艺条件测镍离子(Ni2+)和铜离子(Cu2+)实验结果,对比并验证新型基质固相萃取柱分析重金属离子的可信度,具体结果见表7。

图2 山核桃叶及果实中重金属离子组残留量关联分析Figure2 Relation analysis of residual content of heavy metal ion group in Carya cathayensis leaves and fruits

表7 经典方法和新型基质固相萃取柱分析方法所测重金属离子对比Table7 Comparision with content of heavy metal ion between the classic method and MSPD method
由表7中数据比较分析可知:新型基质固相萃取柱所测得的叶片组和果实组中镍离子(Ni2+)分别为经典方法所得的91.1%和77.8%;新型基质固相萃取柱所测得的叶片组和果实组中铜离子(Cu2+)分别为经典方法所得的89.1%和76.9%。与文献报道固相萃取方法用于药物分析、环境农药残留检测等结果比较,效率较高[21-22],说明新型基质固相萃取柱分析重金属离子的可信度较好,可作为快速有效的测定模式。本工作制备的新型MSPD处理重金属离子的机制可能是综合作用机制(正相吸附、反相吸附、离子交换等),也可能包含新的作用机制,这是一个复杂且需要大量实验验证的工作,有待于后续开展深入的研究工作。
3 结论
本研究通过改性吸附基质功能材料碳18(C18)和活性炭等常规吸附基质,设计高效分离柱管,进而制备新型基质固相萃取柱。根据植物叶子成分与果实成分存在一定的量效关系原理,选取山核桃叶为前期指示物,通过新型基质固相萃取柱预处理制样,考察新型基质固相萃取柱提取重金属离子组的功效性能,进而开展对山核桃果实重金属离子残留关联性研究,同时利用经典方法对新型基质固相萃取柱制样及分析结果进行验证,建立起区域特色产品-山核桃重金属的新颖分析技术体系。从所得结果来看,本研究提出的前期指示物预测、监控重金属为一种有效方法,相关研究目前尚无报道。本研究所得结果在基质固相萃取技术与其他方法应用于林果等产品中重金属离子残留研究的分析比较前提下,可为基质固相萃取技术分析其他林果等食用产品中的重金属离子残留研究提供有益参考,对于更好地利用山核桃资源,也具有一定的现实意义。
[1]章海风,陆红梅,路新国.食品中重金属污染现状及防治对策[J].中国食物与营养,2010(8):17-18.ZHANG Haifeng, LU Hongmei, LU Xinguo.Heavy metal pollution situation of food and its prevention countermeasures [J].Food Nutrit China, 2010 (8): 17-18.
[2]EIDE D J.Functional genomics and metal metabolism [J].Genome Biol, 2001, 2 (10): 1-3.
[3]张玉芳,王允成,王洪涛,等.无公害农产品产业化发展建议[J].农业环境与发展,2003,20(2):1-2.ZHANG Yufang, WANG Yuncheng, WANG Hongtao, et al.Suggestions on development of environment-friendly agricultural products industrialization [J].Agro-Environ Dev, 2003, 20 (2): 1-2.
[4]JUNG M C.Heavy metal contamination of soils and waters in and around the imcheon Au-Ag mine, Korea [J].App Geochem, 2001, 16 (11/12): 1369-1375.
[5]PAWLISZYN J.New directions in sample preparation for analysis of organic compounds [J].Trends Anal Chem, 1995, 14(3): 113-122.
[6]熊宏春.固相萃取-等离子体原子光谱联用及其应用研究[D].武汉:武汉大学,2000.XIONG Hongchun.Study on Solid Phase Extraction Combined with Inductively Coupled Plasma Spectrometry and Its Applications [D].Wuhan: Wuhan University, 2000.
[7]BARKER S A.Matrix solid-phase dispersion [J].J Chromatogr A, 2000, 885 (1/2): 115-127.
[8]乌日娜,李建科.基质固相分散在食品安全分析中的应用[J].食品科学,2005,26(6):266-267.Wurina, LI Jianke.Review on applications of matrix solid-phase dispersion in food safety analysis [J].Food Sci, 2005,26 (6): 266-267.
[9]吴春红,聂继云,李静,等.基质分散固相萃取-高效液相色谱法测定水果中的异菌脲残留量[J].食品科学,2009,30 (14): 188-190.WU Chunhong, NIE Jiyun, LI Jing, et al.Combination of matrix solid phase dispersion extraction with high performance liquid chromatography for the determination of iprodione residue in fruits [J].Food Sci, 2009, 30 (14): 188-190.
[10]张海霞, 朱彭龄.固相萃取[J].分析化学, 2000, 28 (9): 1172-1180.ZHANG Haixia, ZHU Pengling.Solid phase extraction [J].Chin J Anal Chem, 2000, 28 (9): 1172-1180.
[11]台希,李海涛,李德良,等.固相萃取富集高效液相色谱法测定环境水样中的重金属元素[J].干旱环境监测,2004, 18 (2): 67-70.TAI Xi, LI Haitao, LI Deliang, et al.Determination of heavy metal element in water samples by solid phase extraction concentration high efficiency liquid phase chromatography [J].Arid Environ Monitor, 2004, 18 (2): 67-70.
[12]黄海涛,李忠,陈章玉,等.固相萃取富集-高效液相色谱法测定烟草和烟草添加剂中的重金属元素[J].理化检验:化学分册,2004,40(5):251-253.HUANG Haitao, LI Zhong, CHEN Zhangyu, et al.HPLC determination of some heavy metal elements in tobacco and tobacco additives after preconcentration by solid phase extraction [J].Phys Test Chem Anal Part B Chem Anal,2004, 40 (5): 251-253.
[13]TUZEN M, SAYGI K O, SOYLAK M.Solid phase extraction of heavy metal ions in environmental samples on multiwalled carbon nanotubes [J].J Hazard Mater, 2008, 152 (2): 632-639.
[14]杨亚玲,杨国荣,胡秋芬,等.固相萃取富集-高效液相色谱法测定4种中草药中的重金属元素[J].药物分析杂志, 2004, 24 (4): 441-443.YANG Yaling, YANG Guorong, HU Qiufen, et al.Determination some heavy metal elements in 4 species of Chinese traditonaldrugsbysolidphaseextraction-highperformanceliquidchromatography [J].ChinJPharmAnal, 2004, 24 (4):441-443.
[15]GUPTA S S, BHATTACHARYYA K G.Adsorption of Ni(Ⅱ) on clays [J].J Colloid Interface Sci, 2006, 295 (1):21-32.
[16]ERNST E.Toxic heavy metals and undeclared drugs in Asian herbal medicines[J].Trends Pharmac Sci, 2002, 23 (3):136-138.
[17]浙江药用植物志编写组.浙江药用植物志:上册[M].杭州:浙江科学技术出版社,1980:159-161.
[18]翟梅枝,张凤云,高绍棠,等.核桃叶总黄酮提取方法研究[J].陕西林业科技,2000(1):5-8.ZHA Meizhi, ZHANG Fengyun, GAO Shaotang, et al.On extracting methods of flavone in walnut leaves [J].J Shaanxi For Sci Technol, 2000 (1): 5-8.
[19]姚振生,叶荷平,陈杰,等.野核桃叶提取物的体外抗菌作用 [J].江西中医学院学报,2001,13 (3):122-123.YAO Zhensheng, YE Heping, CHEN Jie, et al.In vitro bacteriostasis of extracts from wild walnut leaves [J].J Jiangxi Coll Trad Chin Med, 2001, 13 (3): 122-123.
[20]尉芹,马希汉,韩学文,等.核桃叶抗氧化作用的研究[J].食品科学,2001,22(7):81-83.WEI Qin, MA Xihan, HAN Xuewen, et al.Studies on antioxidation effects of walnut leaves [J].Food Sci, 2001, 22(7): 81-83.
[21]RAGGI M A, BUGAMELLI F, MANDRIOLI R, et al.Development and validation of an HPLC method for the simultaneous determination of clozapine and desmethylclozapine in plasma of schizophrenic patients [J].Chromatographia,1999, 49 (1/2): 75-80.
[22]李妍.新型聚合物基质固相萃取材料的制备及其应用[D],天津:天津大学,2010.LI Yan.Preparation and Applications of Nnovel Polymer-based SPE Materials[D].Tianjing: Tianjing University, 2010.
