毛果杨全基因组磷酸根转运蛋白家族成员序列分析
2012-05-30秦静静甘红豪罗志斌
王 策,秦静静,甘红豪,李 红,罗志斌,3
(1.西北农林科技大学 生命科学学院,陕西 杨凌 712100;2.西北农林科技大学 植物保护学院,陕西 杨凌 712100;3.西北农林科技大学 林学院,陕西 杨凌 712100)
磷酸根转运蛋白是一类广泛存在于微生物、植物及动物膜系统中主动转运磷酸根的载体蛋白。磷酸根转运蛋白分为PHT和PHO等2类,其中PHO是PHT在进化过程中形成的突变体[1]。在不同植物中,PHT的亚家族数不尽相同,如水稻Oryza sativa具有PHT1,PHT2和PHT3[2],而拟南芥Arabidopsis thaliana具有6个PHT亚家族[1]。PHO在序列和功能上与PHT有较大差别,PHO具有PHO1和PHO2亚家族。PHT1亚家族为高亲和力的磷酸根转运蛋白,位于细胞膜上,负责根系对土壤磷的吸收,是研究得最为深入的植物磷酸根转运蛋白。其他PHT亚家族蛋白在不同物种中则具有不同的亚细胞定位,并执行不同的功能。以低亲和力的磷酸根转运蛋白PHT2为例,拟南芥的PHT2-1位于细胞膜上负责根细胞的磷酸根跨膜转运[3],而马铃薯Solanum tuberosum的PHT2-1位于质体膜上,负责质体与细胞质基质之间的磷酸根转运[4]。PHO中的PHO1主要负责将磷由根系薄壁细胞载入木质部运向地上部,PHO2主要负责磷进入韧皮部向根系运输[5]。毛果杨Populus trichocarpa的全基因组测序已经完成,数据库Populus trichocarpa v1.1(http://genome.jgi-psf.org/Poptr1_1/Poptr1_1.home.html)公布了全部序列。此后,在第1次测序基础上,进行了第2次补充测序。毛果杨全基因组最新数据已包含在数据库Phytozome v7.0(http://www.phytozome.net/poplar)中[6]。目前,有关磷酸根转运蛋白的研究多集中在酵母Saccharomyces cerevisiae以及拟南芥、水稻和番茄Solanum lycopersicum等1年生草本植物中,木本植物中磷酸根转运蛋白的报道比较少见,而有关木本植物磷酸根转运蛋白三维拓扑结构研究的报道尚未见到。Martin[7]曾对毛果杨磷酸根转运蛋白家族特征及其表达模式进行过初步研究,通过试验对其中的13个基因模型进行了鉴定与命名,包括11个PHT1亚家族成员和2个PHT2亚家族成员。然而,这只是毛果杨磷酸根转运蛋白家族的部分成员,并且Martin的研究未涉及其生物信息学特征。因此,有必要对毛果杨磷酸根转运蛋白进行系统的生物信息学分析,为后续的试验分析与鉴定提供理论基础。本研究以毛果杨基因组数据库中检索到的磷酸根转运蛋白序列为切入点,获得毛果杨全基因组中磷酸根转运蛋白家族的成员信息,利用数据库及生物信息学软件CLUSTALX,GeneDOC等对这些序列进行剔除和多重序列比对,并利用MEGA5构建系统树的方法,建立了毛果杨全基因组中磷酸根转运蛋白的系统发育树。此外,还对部分磷酸根转运蛋白进行了理化性质及亚细胞定位的计算机分析,最后还通过软件分析预测了部分磷酸根转运蛋白的跨膜结构域以及三维拓扑结构等。本研究可丰富毛果杨磷酸根转运蛋白家族信息,为毛果杨的磷素吸收转运机理研究提供科学依据。
1 材料与方法
1.1 毛果杨磷酸根转运蛋白家族序列的获取
在JGI的毛果杨全基因组数据库Populus trichocarpa v1.1中,以“Phosphate Transporter”为关键词进行搜索,可以获得Phosphate Transporter基因模型。根据其他生物中磷酸根转运蛋白序列的长度,剔除长度不在400~700个氨基酸之间的序列,同时,对比它们的基因座位,只保留基因座位不同的模型。之后,将这些序列在美国国家生物技术信息中心(NCBI)数据库(http://www.ncbi.nlm.nih.gov)中进行BLAST,查看相似序列蛋白质在其他植物中的功能,将与磷酸根转运功能不相关的基因模型剔除。最后,将保留下来的序列导入最新的毛果杨全基因组数据库Phytozome v7.0中进行BLAST,寻找其他可能的蛋白序列。
1.2 毛果杨磷酸根转运蛋白的系统发育与保守序列分析
在获取的毛果杨磷酸根转运蛋白序列的基础上,以“Phosphate Transporter”为关键词,在美国国家生物技术信息中心(NCBI)数据库中搜索拟南芥、水稻和酵母等模式生物的磷酸根转运蛋白序列。将获取的序列导入CLUSTAL X2.0软件中进行多重序列比对,并将结果导入到序列分析软件MEGA5中查看序列相似度。同时利用MEGA5中的CLUSTALW程序进行比对并构建系统发育树,并对生成的发育树进行1000 次抽样的Bootstrap 校正[8]。 利用 MEME 在线服务器(http://meme.nbcr.net/meme4_6_0/cgi-bin/meme.cgi),分析毛果杨磷酸根转运蛋白的保守基序,基序长度设为介于6~200个氨基酸之间,基序最大数目设为15[9]。
1.3 毛果杨磷酸根转运蛋白一级结构分析及跨膜区预测
以毛果杨全基因组数据库中已命名的PtrPHT1-1,PtrPHT1-9和PtrPHT2-1以及通过NCBI数据库初步确认的PHO1亚家族成员PtrPHO1-N1为研究对象,利用瑞士生物信息学研究所提供的ProtParam(http://expasy.org/tools/protparam.html)程序,分别对上述4种蛋白质的氨基酸残基数目、组成、相对分子质量、理论等电点及稳定性等理化性质进行了在线分析[10]。利用瑞士生物信息学研究所提供的ProtScale(http://expasy.org/tools/protscale.html)程序和斯德哥尔摩大学理论化学蛋白质预测服务器Topred 2(http://www.sbc.su.se/~erikw/toppred2),在线预测这4种蛋白质的亲/疏水性,并通过后者同时预测跨膜蛋白跨膜区的拓扑结构[10-11]。
1.4 毛果杨磷酸根转运蛋白的二级结构与三级结构预测
利用英国伦敦大学帝国理工学院生物信息学小组创建的PHYRE2(http://www.sbg.bio.ic.ac.uk/~phyre)服务器,通过折叠识别法预测PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1蛋白的三级结构[12],服务器自动在PDB蛋白晶体库中搜索匹配度最高的折叠子结构,在此基础上预测出蛋白质的三维结构,并同时给出蛋白质的二级结构预测结果。最后,利用Raswin软件查看其三维结构。
1.5 毛果杨磷酸根转运蛋白的亚细胞定位分析
WoLF PSORT是一种常用的蛋白质亚细胞定位预测工具,它根据氨基酸组成和iPSORT等特征来分析生物体中蛋白序列的亚细胞定位。将PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1蛋白序列导入在线分析程序(http://wolfpsort.seq.cbrc.jp),按照Horton等[13]的分析方法,对毛果杨磷酸根转运蛋白的亚细胞定位进行预测分析。
2 结果与分析
2.1 毛果杨磷酸根转运蛋白家族序列
通过毛果杨全基因组数据库中的详细注释对检索结果进行筛选,并利用美国国家生物技术信息中心(NCBI)数据库进行BLAST,最后从检索到的9763个磷酸根转运蛋白基因模型中筛选出31个基因模型(表1)。其中13个基因模型已被Martin[7]注明家族归属并命名。另有5个基因模型通过在NCBI数据库中进行BLAST,初步确定为PHO1亚家族蛋白序列,分别命名为PtrPHO1-N1~PtrPHO1-N5,还有2个基因模型虽然在NCBI数据库的PHO1亚家族中没有明确的对应物,但其序列与PtrPHO1亚家族的5个基因高度相似,因此,将其命名为PtrPHO1-N6和PtrPHO1-N7。对于另外11个数据库中未注明家族归属的蛋白模型,也跟据系统发育树的亚家族划分,分别命名为PtrPHT1-N1,PtrPHT1-N2及PtrPHO2-N1~PtrPHO2-N9。由表 1中所列基因座位可知,毛果杨磷酸根转运蛋白基因零散分布于整个基因组,其中也有不少多种蛋白连锁在同一染色体上的情况。如PtrPHT1-1,PtrPHT2-1,PtrPHO1-N2,PtrPHO1-N3和PtrPHO1-N4连锁在LG_X上;在LG_I,LG_II,LG_V,LG_VIII,LG_IX和scaffold_273染色体上也有磷酸根转运蛋白基因连锁的情况。
2.2 毛果杨磷酸根转运蛋白的系统发育与保守序列
由构建的系统发育树(图1)可见:毛果杨磷酸根转运蛋白家族可分为PHT和PHO等2个亚家族,而PHT和PHO又可进一步分为PHT1和PHT2以及PHO1和PHO2亚家族。PHT1亚家族中包含了11条数据库中已命名的序列和2条未命名序列PtrPHT1-N1和PtrPHT1-N2;而PHT2亚家族中只有2条已命名序列。PHO1亚家族包含7个成员;PHO2亚家族共有9个成员。
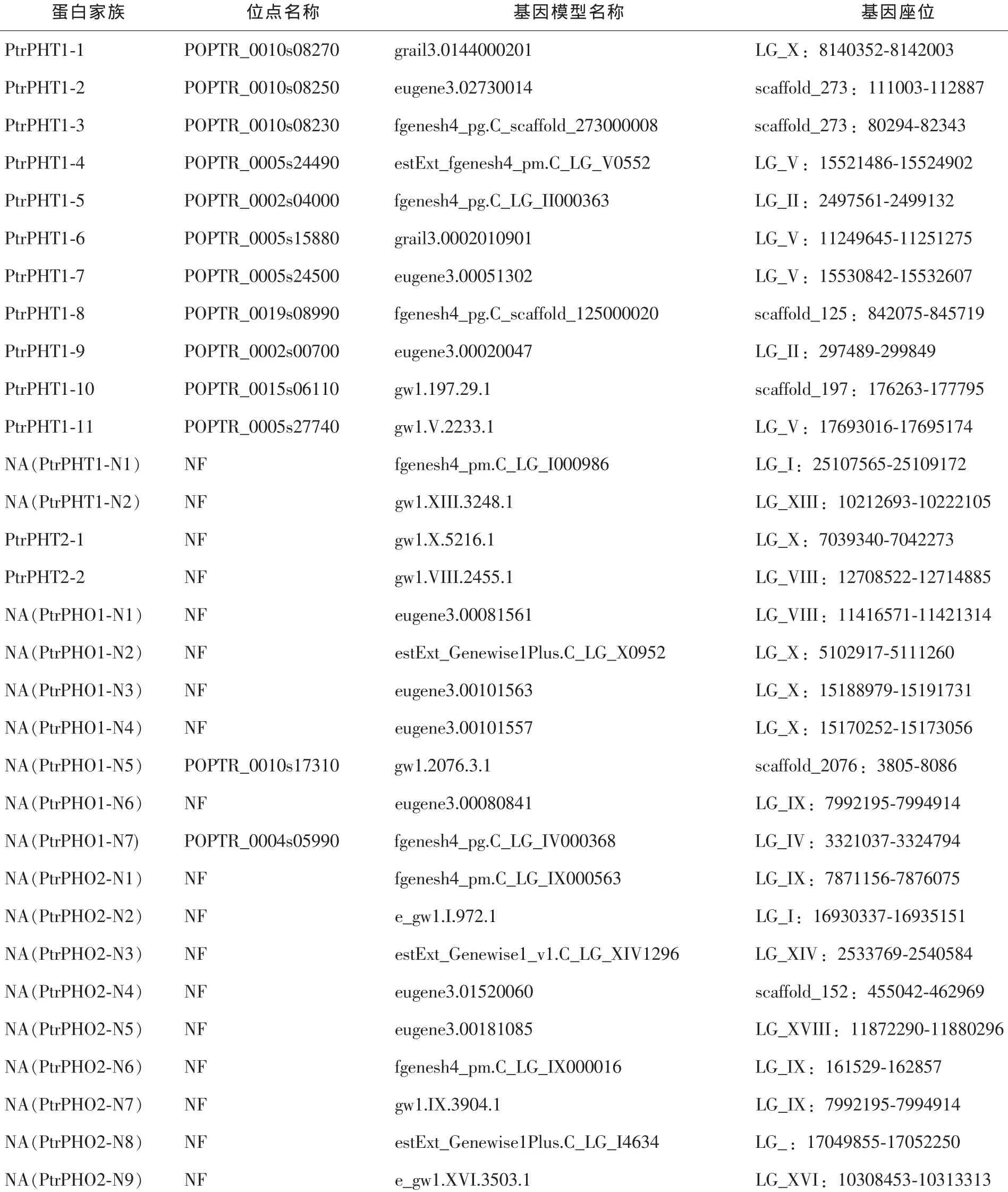
表1 毛果杨中磷酸根转运蛋白家族成员及其基因组位置Table1 Family members of phosphate transporters and their genome locations in Populus trichocarpa
同源性比较发现:毛果杨磷酸根转运蛋白各亚家族之间同源性较低,均为10%左右;而同一亚家族内各成员同源性相对较高,以成员数量较多的PHT1亚家族为例,该亚家族成员可按序列相似性划分为两部分。这两部分成员间的相似性为40%~60%,而各部分内成员的相似性很高,为90%左右。这说明毛果杨中不同亚家族磷酸根转运蛋白可能在很早以前就由于各种原因而彼此分开,并向着各自的方向进化,而后续进化过程中,各亚家族内的分化不显著。
从毛果杨磷酸根转运蛋白基因的外显子/内含子结构可知,PHT1亚家族成员内含子数量较少,除PtrPHT1-N1外,最多只有一个内含子;PHT2亚家族的2个成员各有2个内含子;而2个PHO亚家族成员内含子数量均较多,且其数目有一定的差异。由此可见:PHT的基因结构较PHO保守。

图1 毛果杨磷酸根转运蛋白家族的NJ系统进化树及其基因外显子∕内含子结构图Figure1 Phylogenetic tree and the exon/intron structures of phosphate transporters in Populus trichocarpa
毛果杨磷酸根转运蛋白保守基序的预测结果如图2所示。发现PHT1亚家族的保守性较高,具有保守基序1~4和保守基序6,而蛋白PtrPHT1-1~PtrPHT1-7以及PtrPHT1-N1和PtrPHT1-N2还同时具有保守基序5。这也进一步验证了之前通过MEGA5的比对,按序列相似性将PHT1亚家族分为两部分这一结论。然而,PtrPHT1-N2不含家族内其他成员中分别位于序列首尾的基序1和基序6,是PHT1亚家族中的一个例外。PHT2亚家族共用基序2,4和7,并且基序2在序列末尾各有一段重复,因此PHT2亚家族的保守性也较高。PHO1亚家族主要包含基序8~13等,其中基序8,9和基序11~13为该亚家族所特有。PHO2亚家族主要包含基序6,7,10,14和15等,其中基序7,14和15为该亚家族所特有。PHO的保守性较PHT小,但PHO1和PHO2亚家族中均有部分成员的序列也具有很高的相似性。
在毛果杨与其他模式生物的磷酸根转运蛋白的系统进化树(图3)中发现,毛果杨PHT1亚家族与拟南芥、水稻同亚家族的同源性均高于60%,且部分成员同源性可达80%以上,而与各物种PHT2亚家族的同源性低于20%,与各物种PHO亚家族的同源性低于10%。毛果杨PHT2亚家族也只与拟南芥、水稻的PHT2亚家族同源性较高,为70%~80%,与其他序列同源性均低。毛果杨PHO1亚家族与拟南芥、水稻PHO1亚家族同源性为50%~60%,而毛果杨PHO1和PHO2亚家族与酵母磷酸根转运蛋白同源性均低于10%。由此可见,磷酸根转运蛋白同亚家族成员在物种内及物种间的同源性都较高,而不同亚家族成员无论在物种内还是物种间同源性均较低。
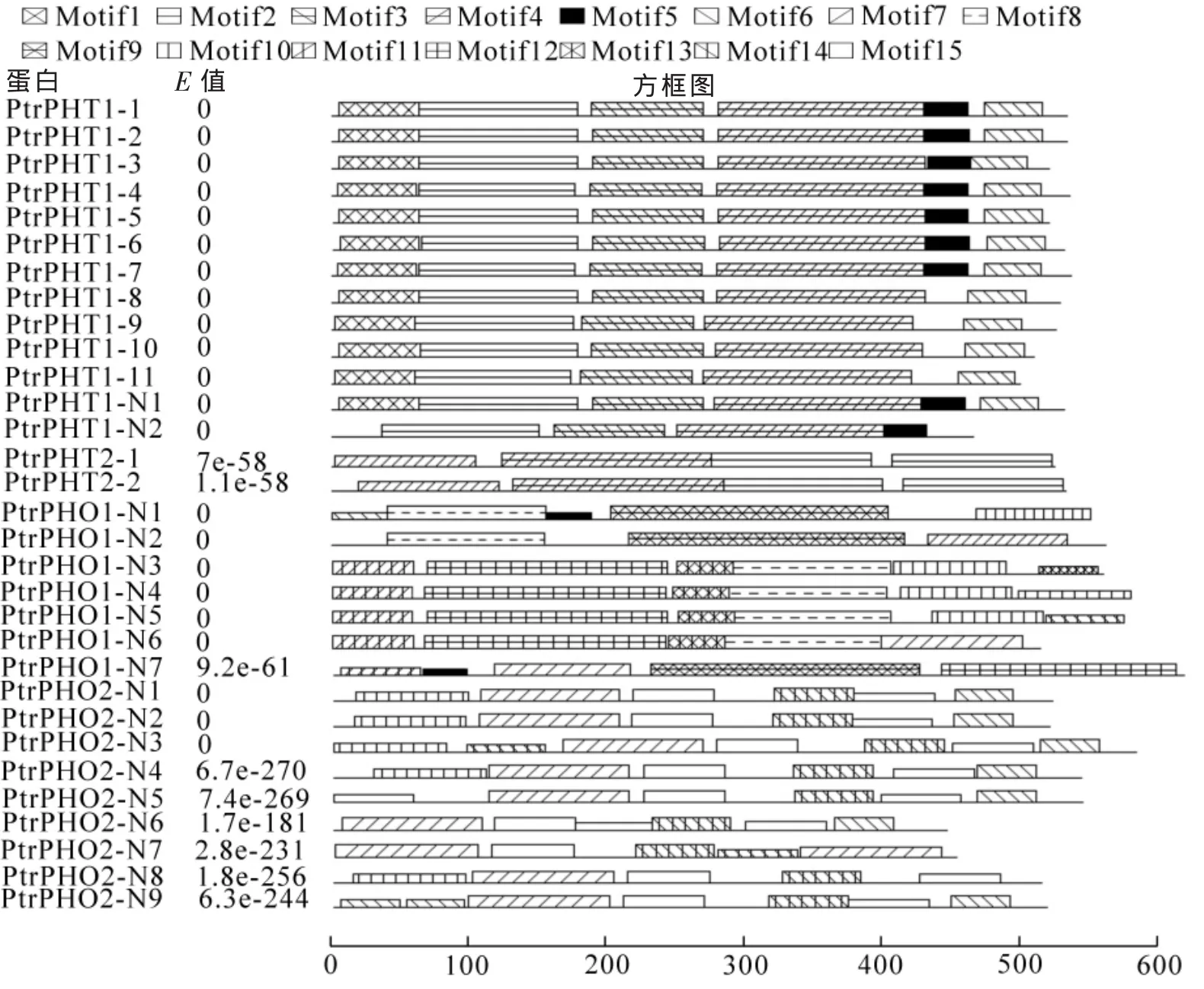
图2 毛果杨磷酸根转运蛋白保守基序示意图Figure2 Conserved motifs of phosphate transporters in Populus trichocarpa
2.3 毛果杨磷酸根转运蛋白一级结构及跨膜区
PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的基本理化参数预测结果(表2)表明,4种蛋白的理论等电点均偏碱性,说明其氨基酸序列中带正电的氨基酸残基数多于带负电的氨基酸残基数,这可能与膜转运蛋白的功能相关。4种蛋白的总平均疏水性均为正值,表明它们均为疏水性蛋白质。其中,PtrPHT2-1疏水性最强,PtrPHO1-N1疏水性最弱,PtrPHT1-1和PtrPHT1-9疏水性近似。此外,4种蛋白的稳定系数差别不大,并且都相对稳定,这表明该类蛋白可能较适于进行体外试验。
PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的亲/疏水性分析结果如图4所示。图中正值越大表示疏水性越强,负值越大表示亲水性越强,因此,PtrPHT1-1,PtrPHT1-9和PtrPHT2-1均有12个疏水性区域,而PtrPHO1-N1的疏水区明显偏少,只有6处。这表明与3种PHT蛋白相比,在进化上Ptr-PHO1-N1可能发生了较大程度的变异,导致蛋白质整体疏水性降低,疏水性区域减少,这一结论与蛋白质理化参数分析结果一致。此外,还利用ProtScale软件的Kyte&Doolittle算法(K-D法)对4种蛋白进行了亲/疏水性分析[10],结果与此一致。对PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1进行的跨膜区拓扑结构预测结果(图5)与图4相对应,疏水性大于1.0的片段可确定为跨膜区,介于0.6~1.0的片段为疑似跨膜区。由图5可知:PtrPHT1-1和PtrPHT2-1具有12个跨膜域,而PtrPHT1-9和PtrPHO1-N1中各有1个疑似跨膜域,PtrPHT1-9具11个跨膜域,PtrPHO1-N1具有5个跨膜域。预测结果同时显示,4种跨膜蛋白的C端以及PtrPHT1-1和PtrPHT2-1的N端 都位于细胞膜的胞质一侧,而PtrPHT1-9和PtrPHO1-N1的N端可能也位于细胞膜的胞质一侧。其中PtrPHT1-1和PtrPHT1-9的预测结果与Karandashov[14]报道的植物PHT1亚家族的跨膜区结构特点一致;对PtrPHT2-1的预测结果也符合Raghothama[15]对AtPHT2-1跨膜域结构的阐述。而有关植物PHO的跨膜区结构未见文献报道。
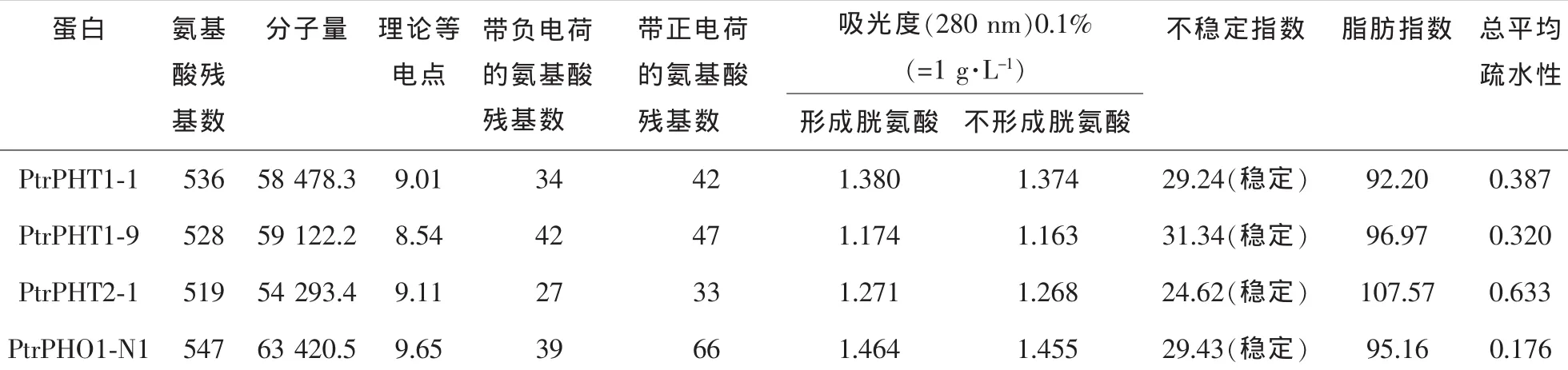
表2 毛果杨磷酸根转运蛋白PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的理化参数Table2 Physical and chemical characteristics of PtrPHT1-1, PtrPHT1-9, PtrPHT2-1 and PtrPHO1-N1 in Populus trichocarpa
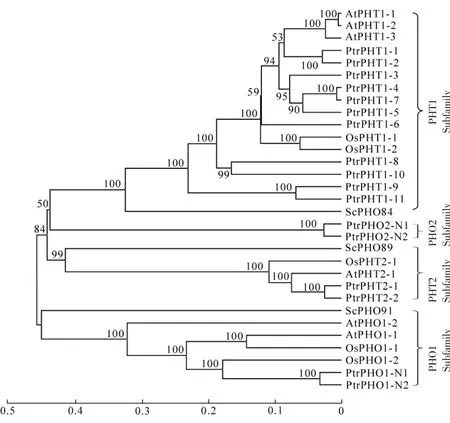
图3 磷酸根转运蛋白家族在几种模式生物中的系统进化树Figure3 Phylogenetic tree of phosphate transporters in several model plants
2.4 毛果杨磷酸根转运蛋白的二级结构与三级结构
PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的二级结构预测结果如表 3。4种蛋白的二级结构组分中,α-螺旋所占比例最高,均超过70%;无规卷曲和β-折叠所占比例较小。因此,4种蛋白质均属于全α型蛋白质(α-螺旋所占比例大于45%)[16],是跨膜蛋白的主要类型。
PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1三级结构的预测结果如图6所示。PtrPHT1-1和PtrPHT1-9的折叠子模型为d1pw4a,是大肠埃希菌Escherichia coli中的甘油-3-磷酸转运蛋白(glycerol-3-phosphate transporter)家族成员。该折叠子与PtrPHT1-1和PtrPHT1-9的匹配性较好,E值分别为1.2e-26和2e-26,预测准确度均为100%;PtrPHT2-1和PtrPHO1-N1的折叠子模型为d2cfqa1,是大肠埃希菌乳糖透性酶(lactose permease)家族成员。该折叠子与PtrPHT2-1和PtrPHO1-N1的匹配性也较好,E值分别为7.8e-06和0.036,预测准确度均为95%。因此,对4种蛋白的三级结构预测结果较准确。

图4 毛果杨磷酸根转运蛋白 PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的亲/疏水性分析结果图Figure4 Analysis of hydrophilicity/hydrophobicity of PtrPHT1-1, PtrPHT1-9, PtrPHT2-1 and PtrPHO1-N1 in Populus trichocarpa
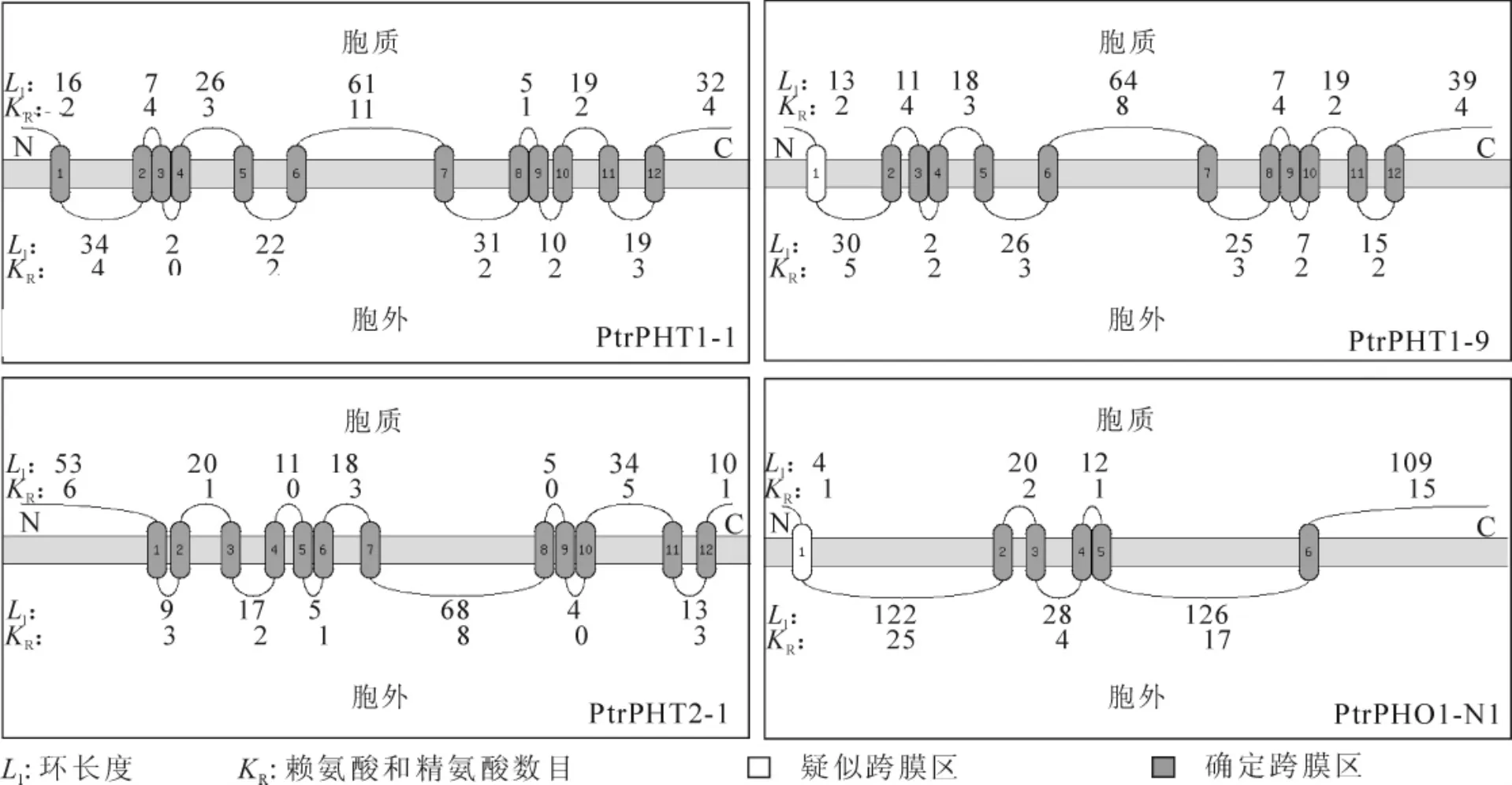
图5 毛果杨磷酸根运蛋白PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的跨膜拓扑结构预测结果图Figure5 Transmembrane topology of PtrPHT1-1, PtrPHT1-9, PtrPHT2-1 and PtrPHO1-N1 in P.trichocarpa
图6表明:它们均为主要由α-螺旋构成的全α型蛋白质。此类型的跨膜蛋白中,α-螺旋一般也就是其跨膜区[16]。PtrPHT1-1,PtrPHT1-9和PtrPHT2-1的α-螺旋均为12个,这也与图5中的结果相一致。而PtrPHO1-N1的α-螺旋数略少于3种PHT蛋白,为10个。同时发现,PtrPHO1-N1中的α-螺旋长度较3种PHT蛋白短,根据之前预测的PtrPHO1-N1含有5~6个跨膜域可推测,PtrPHO1-N1中的部分α-螺旋可能由于长度过短、疏水性不足而无法形成跨膜区。根据前面对4种蛋白质各种特性的预测结果进行比较,可以认定本试验对4种毛果杨磷酸根转运蛋白三级结构的预测结果准确性较高。

表3 毛果杨磷酸根转运蛋白PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的二级结构预测Table3 Secondary structures of PtrPHT1-1, PtrPHT1-9, PtrPHT2-1 and PtrPHO1-N1 in Populus trichocarpa
2.5 毛果杨磷酸根转运蛋白的亚细胞定位
PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的亚细胞定位分析结果(表4)表明:PtrPHT1-1,PtrPHT1-9和PtrPHO1-N1位于质膜上,参与细胞对磷酸根的吸收转运。PtrPHT2-1可能定位于质膜、液泡膜或高尔基体膜,若定位于液泡膜,可能说明植物体利用某些磷酸根转运蛋白,将吸收的磷酸根转运至液泡中,暂时储存磷素营养,同时调控细胞内磷浓度的稳态;若定位于高尔基体膜,其功能可能是将胞质中的磷酸根转运至高尔基体,用于各类蛋白质合成后的磷酸化修饰。
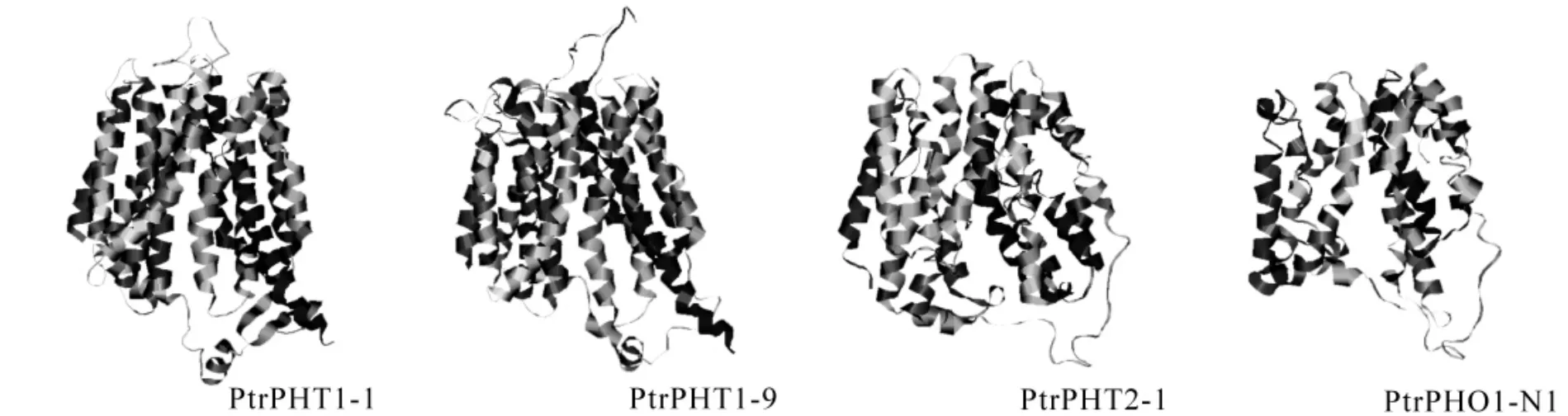
图6 毛果杨磷酸根转运蛋白PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1三维结构预测示意图Figure6 Three-dimensional structures of PtrPHT1-1, PtrPHT1-9, PtrPHT2-1 and PtrPHO1-N1 in P.trichocarpa
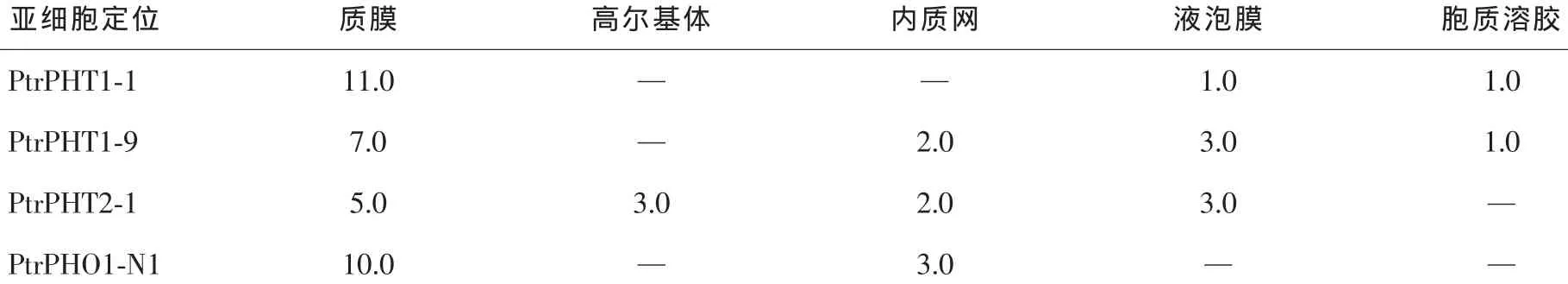
表4 毛果杨磷酸根转运蛋白PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1的亚细胞定位结果Table4 Subcellular localizations of PtrPHT1-1, PtrPHT1-9, PtrPHT2-1 and PtrPHO1-N1 in P.trichocarpa
3 讨论
本试验的研究对象来自于毛果杨全基因组数据库中的磷酸根转运蛋白序列,获得的31条序列中,除了13条磷酸根转运蛋白序列已公布外[7],还另外发现了18个该家族成员。经软件比对得知,新发现的18个蛋白成员中除PtrPHT1-N1和PtrPHT1-N2外,均属于PHO1和PHO2亚家族。同源性比较发现,毛果杨磷酸根转运蛋白亚家族序列之间相似性较低,均为10%左右,而与其他模式生物同一亚家族间相似性较高,可达70%~80%。磷酸根转运蛋白在各物种内的PHT与PHO亚家族之间的相似性都比较低,而各PHT亚家族之间相似性稍高,说明PHT与PHO亚家族可能最早分开,独立进化。
磷酸根转运蛋白PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHT1-N1均为疏水性蛋白,这也属于跨膜蛋白的基本性质。3种PHT蛋白均含有12个跨膜域,PtrPHO1-N1的跨膜域数为5~6个,这也印证了其疏水性低于3种PHT蛋白的预测。4种蛋白都属于全α型蛋白质,并且各种构件所占比例相似。
三级结构的预测是蛋白质结构预测的重点和难点,同时也是解释蛋白质结构与功能之间关系的关键步骤。目前,通过计算机预测蛋白质三级结构的方法主要有3种:同源建模、折叠识别和从头预测法[12]。试验中对PtrPHT1-1,PtrPHT1-9,PtrPHT2-1和PtrPHO1-N1三级结构的预测首先使用的是同源建模法。然而,服务器自动在PDB蛋白晶体库中搜索到的模型匹配度均未达到30%的要求[17],预测结果准确性较低,故进而采用折叠识别法对其进行三级结构的预测。结合预测结果可分析出,PtrPHO1-N1中的α-螺旋比例并不少于PHT亚家族的3个成员,而只是其多数α-螺旋较短,从而使其具有更多数量的α-螺旋片段。这也导致PtrPHO1-N1中的部分α-螺旋没有足够强的疏水性,因而无法跨膜,便印证了它只有5~6个跨膜域的分析结果。本研究的亚细胞定位结果表明,PtrPHT1-1,PtrPHT1-9和PtrPHO1-N1位于质膜上,参与磷酸根的吸收转运。而PtrPHT2-1可能定位于质膜、液泡膜或者高尔基体膜。根据文献报道及本研究中对其他磷酸根转运蛋白亚家族的定位与功能分析,PtrPHT2-1定位于液泡膜的可能性最大。若定位于液泡膜,可能说明植物通过磷素跨液泡膜的双向运输实现细胞质中磷浓度的稳态[15]。
4 结论
在毛果杨全基因组数据库中发现的31个毛果杨磷酸根转运蛋白可分为4个亚家族,即PHT1,PHT2,PHO1和PHO2。磷酸根转运蛋白定位于生物膜上起转运磷酸根的作用。保守基序预测得知,毛果杨PHT亚家族内的保守性高,而亚家族之间的差异较大;PHO的保守性较PHT小。系统发育分析得知,毛果杨磷酸根转运蛋白各亚家族可能分开较早,尤其是PHT1,PHT2亚家族与PHO1,PHO2亚家族两者之间差异显著,共同基序更少。毛果杨磷酸根转运蛋白均为疏水性的全α型蛋白质,家族内三维结构相似,其中PHT一般具有12个跨膜域,多于PHO。亚细胞定位预测得知,毛果杨不同亚家族成员的亚细胞定位不尽相同,这说明磷酸根转运蛋白家族各成员在杨树磷素代谢中起着不同的作用,共同维持并调控杨树体内的磷素平衡。
[1]OKUMURA S, MITSUKAWA N, SHIRANO Y, et al.Phosphate transporter gene family of Arabidopsis thaliana[J].DNA Res, 1998, 5: 261-269.
[2]高佳,刘雄伦,刘玲,等.水稻磷酸盐转运蛋白Pht1家族研究进展[J].中国农学通报,2009,25(15):31-34.GAO Jia, LIU Xionglun, LIU Ling, et al.Advance of rice phosphate transporter Pht1 [J].Chin Agric Sci Bull, 2009, 25(15): 31-34.
[3]DARAM P, BRUNNER S, RAUSCH C, et al.Pht2;1 encodes a low-affinity phosphate transporter from Arabidopsis[J].Plant Cell, 1999, 11: 2153-2166.
[4]VERSAW W K, HARRISON M J.A chloroplast phosphate transporter PHT2 (1)influences allocation of phosphate within the plant and phosphate-starvation responses [J].Plant Cell, 2002, 14: 1751-1766.
[5]TICCONI C A, ABEL S.Short on phosphate: plant surveillance and countermeasures [J].Trends Plant Sci, 2004, 9(11): 548-555.
[6]TUSKAN G A, DIFAZIO S, JANSSON S, et al.The genome of black cottonwood, Populus trichocarpa (Torr.and Gray)[J].Science, 2006, 313: 1596-1604.
[7]MARTIN F.The Poplar Phosphate Transporter Multigene Family: Characterization and Gene Expression [R].Southampton: The Third Popyomics Meeting, 2004.
[8]TAMURA K, DUDLEY J, NEI M, et al.MEGA4: Molecular evolutionary genetics analysis(MEGA) software version 4.0 [J].Mol Biol Evol, 2007, 24: 1596-1599.
[9]BAILEY T L, BODEN M, BUSKE F A, et al.MEME SUITE: Tools for motif discovery and searching [J].Nucleic Acids Res, 2009, 37: 202-208.
[10]GASTEIGER E, HOOGLAND C, GATTIKER A, et al.Protein Identification and Analysis Tools on the ExPASy Server[M].Springer: The Proteomics Protocols Handbook, 2005: 571-607.
[11]CLAROS M G, von HEIJNE G.TOPPRED II: An improved software for membrane protein structure predictions [J].Comput Appl Biosci, 1994, 10: 685-686.
[12]吴祖建,高芳銮,沈建国.生物信息学分析实践[M].北京:科学出版社,2010:134-137.
[13]HORTON P, PARK K J, OBAYASHI T, et al.WoLF PSORT: protein localization predictor[J].Nucleic Acids Res,2007, 35: 585-587.
[14]KARANDASHOV V, BUCHER M.Symbiotic phosphate transport in arbuscular mycorrhizas [J].Trends Plant Sci,2005, 10 (1): 22-29.
[15]RAGHOTHAMA K G.Phosphate transport and signaling [J].Curr Opin Plant Biol, 2000, 3 (3): 182-187.
[16]王镜岩,朱圣庚,徐长法.生物化学:下[M].3版.北京:高等教育出版社,2002:229-231.
[17]BORDOLI L, KIEFER F, ARNOLD K, et al.Protein structure homology modeling using SWISS-MODEL workspace[J].Nat Protoc, 2009, 4: 1-13.
