BCSC-1基因异位表达对人小细胞肺癌细胞增殖的抑制效应
2012-05-28袁芳鞠吉雨唐媛媛邸大琳王丽娜孙萍
袁芳 鞠吉雨 唐媛媛 邸大琳 王丽娜 孙萍
1. 潍坊医学院免疫学教研室,山东 潍坊 261053;2. 青州市疾病预防控制中心,山东 青州 262500
BCSC-1基因异位表达对人小细胞肺癌细胞增殖的抑制效应
袁芳1,2鞠吉雨1唐媛媛1邸大琳1王丽娜1孙萍1
1. 潍坊医学院免疫学教研室,山东 潍坊 261053;2. 青州市疾病预防控制中心,山东 青州 262500
背景与目的:人乳腺癌候选抑制蛋白1(breast cancer suppressor candidate 1,BCSC-1)基因已被证实是一种新型抑癌基因,在多种肿瘤细胞均存在表达缺失的现象。该研究通过将BCSC-1基因转染至人小细胞肺癌细胞株NCI-H446,探讨BCSC-1基因异位表达对NCI-H446细胞增殖的抑制效应。方法:用PCR扩增BCSC-1 cDNA,构建真核重组表达载体pcDNA3.1/v5-HisB-BCSC-1。通过脂质体把pcDNA3.1/v5-HisB-BCSC-1和空质粒pcDNA3.1/v5-HisB转染入野生型NCI-H446细胞。以转染空质粒pcDNA3.1/v5-HisB的NCI-H446细胞为对照组,野生型NCI-H446细胞为空白对照组。采用流式细胞仪检测细胞周期;MTT法检测细胞增殖;免疫组化确认BCSC-1基因和CD44分子在NCI-H446细胞中的表达。结果:成功构建了真核重组表达载体pcDNA3.1/v5-HisB-BCSC-1,制备了BCSC-1基因异位高表达的NCI-H446稳定细胞株。细胞周期分析显示,异位表达BCSC-1的NCI-H446细胞大部分阻滞在G0/G1期,明显高于对照组和空白组(P<0.01)。MTT法检测显示,异位表达BCSC-1的NCI-H446细胞与对照组、空白组相比,生长速度明显减慢(P<0.05)。免疫组化显示异位表达BCSC-1的NCI-H446细胞CD44表达增高。结论:BCSC-1基因的异位表达对NCI-H446细胞的恶性增殖行为有明显的抑制作用,这种抑制作用可能与细胞周期阻滞和黏附分子CD44表达增高有关。
BCSC-1基因;NCI-H446细胞;生长曲线;细胞周期;CD44
肿瘤的恶性生物学行为受众多基因调控[1-2]。现已证实,很多肿瘤的发生与抑癌基因的表达缺失有关。给瘤细胞转入抑癌基因可以达到治疗肿瘤的目的。人乳腺癌候选抑制蛋白1(breast cancer suppressor candidate 1,BCSC-1)基因位于人类染色体11q23-q24,现已证实在多种实体瘤细胞中,如乳腺癌、肺癌、卵巢癌等染色体的该区域常缺失[3]。把正常人染色体11q导入乳腺癌、肺癌、宫颈癌或卵巢癌细胞,一定程度上可以抑制细胞生长和裸鼠体内的成瘤性生长[4-5]。Martin等[3]在41株肿瘤细胞中发现33株(80%)BCSC-1 mRNA表达明显缺失,他们将克隆的BCSC-1 cDNA转染入人非小细胞肺癌细胞株H460后,H460细胞在接种裸鼠体内的成瘤性生长减弱。因此,Martin等[3]提出BCSC-1基因是候选抑癌基因。本研究克隆了BCSC-1 cDNA,将其转入NCI-H446细胞,探讨BCSC-1基因异位表达对人小细胞肺癌NCI-H446细胞恶性生物学行为的影响。
1 材料和方法
1.1 细胞株、质粒与主要试剂
原核表达载体pDC316-BCSC-1和真核表达载体pcDNA3.1/v5-HisB、大肠杆菌DH5α、NCI-H446细胞均由本室保存;BCSC-1单克隆抗体为本实验室制备[6]。CD44抗体和SP组化试剂盒购自北京博奥森公司;T4DNA连接酶、限制性核酸内切酶EcoRⅠ/XbaⅠ购自TaKaRa公司;Taq DNA聚合酶、质粒提取试剂盒、DNA凝胶回收试剂盒购自上海生工公司;DNA Marker和蛋白Marker均购自北京Tiangen公司;Lipotap脂质体转染试剂购自碧云天生物技术研究所。
1.2 PCR扩增目的片段BCSC-1 cDNA
根据BCSC-1基因序列(GenBank Accession Number:NM_014622 ),利用引物设计软件Primer Premier 5.0设计一对引物扩增人BCSC-1基因编码序列全长:上游引物P1为5’-GTGGAATTCTATGGTGCACTTCTGTGGCCT A C-3’,引入E c oRⅠ酶切位点,下游引物P2为5’-ATTCTCGAGCGAAAGGCAAAGATAGCATCC-3’,引入XbaⅠ酶切位点,引物由上海生工生物公司合成。以pDC316-BCSC-1为模板进行PCR扩增。PCR反应条件为:94 ℃预变性3 min。94 ℃45 s,55℃ 30 s,72 ℃ 3 min,共25个循环,72 ℃延伸10 min。反应结束后,用1.0%琼脂糖电泳分析PCR结果,用凝胶回收试剂盒回收,并用乙醇沉淀法纯化目的片段。
1.3 真核重组载体pcDNA3.1/v5-HisB-BCSC-1的构建
将PCR扩增产物、质粒pcDNA3.1/v5-HisB用EcoRⅠ/XbaⅠ双酶切。将PCR扩增产物与pcDNA3.1/v5-HisB在T4连接酶作用下连接。连接产物转化大肠杆菌DH5α,将菌液涂布于含50 mg/L氨苄青霉素的LB平板,筛选阳性克隆,抽提质粒,并进一步用PCR和酶切初步鉴定后送上海生工测序鉴定。测序正确的命名为pcDNA3.1/v5- HisB-BCSC-1。
1.4 NCI-H446细胞的稳定转染
转染前一天将野生型NCI-H446(W细胞)转至6孔培养板(Corning-Costar)中,使细胞第2天能长到70%~80%,此时按Lipotap脂质体转染试剂说明书将质粒pcDNA3.1/v5-HisB-BCSC-1和对照空质粒pcDNA3.1/v5-HisB分别转染入NCI-H446细胞。以转染空质粒pcDNA3.1/v5-HisB的NCI-H446细胞为对照组,野生型NCI-H446细胞为空白组。在CO2体积分数为5%、37 ℃温箱温育48 h后,在培养基中加入终浓度为400 μg/mL的G418进行筛选,待到第7天野生型细胞全部死亡,将转染入空质粒和带有BCSC-1基因的细胞调整G418浓度为200 μg/mL,维持培养2周,得到G418抗性克隆,免疫组化法测定BCSC-1的表达。
1.5 四甲基偶氮唑蓝(MTT)法检测细胞增殖能力
用胰酶消化对数生长期细胞,以 5×103/mL的细胞密度接种于96孔板中,每孔200 μL,连续培养7 d,每隔24 h行MTT检测。每孔加入MTT 20 μL(5 mg/mL),37 ℃温育4 h后,加入150 μL DMSO,震荡15 min,酶标仪上490 nm处测A值,每组细胞4个复孔取平均值。
1.6 流式细胞仪检测细胞周期
取6孔板中对数生长期细胞,胰酶消化后,400目钢网过滤,使细胞成单个细胞悬液。将待测细胞转入1.5 mL Eppendorf离心管。1 000 r/min离心(r=16 cm),去上清液。PBS洗2次,加入1 mL 70%预冷的乙醇,4 ℃固定过夜。次日,将细胞1 000 r/min离心(r=16 cm)后PBS洗1次,去上清液。加入500 μL PBS,其中含50 μg/mL碘化丙啶(PI)、100 μg /mL RNase A和0.2% Triton X-100,4 ℃避光温育30 min。上FACSort流式细胞仪检测分析。
1.7 SP免疫组化检测CD44和BCSC-1的表达
免疫组化检测CD44和BCSC-1的表达[6]。按2×104/mL的细胞密度将细胞接种于培养皿中进行细胞爬片,5 d后进行免疫组织化学染色鉴定。PBS清洗细胞3次,4%多聚甲醛固定15 min,空气干燥5 min,PBS清洗标本 3次,加0.5% Triton X-100后温育20 min,加3% H2O2去离子水温育15 min,以消除内源性过氧化物酶活性;每片滴加试剂封闭用正常山羊血清工作液100 μL,室温温育15 min,倾去;分别滴加BCSC-1抗体(1∶2 000)、CD44抗体(1∶400),湿盒4 ℃过夜;PBS洗3次,滴加生物素化羊抗鼠IgG工作液,于37℃温育30 min;PBS洗3次,加辣根酶标记卵白素工作液于湿盒 37 ℃温育15 min;PBS洗 3次;DAB显色3 min,自来水冲洗,再用苏木素复染,常规脱水、封片。
1.8 统计学处理
采用SPSS 13.0统计软件,Student’s t检验进行组间比较,P<0.05为差异有统计学意义。
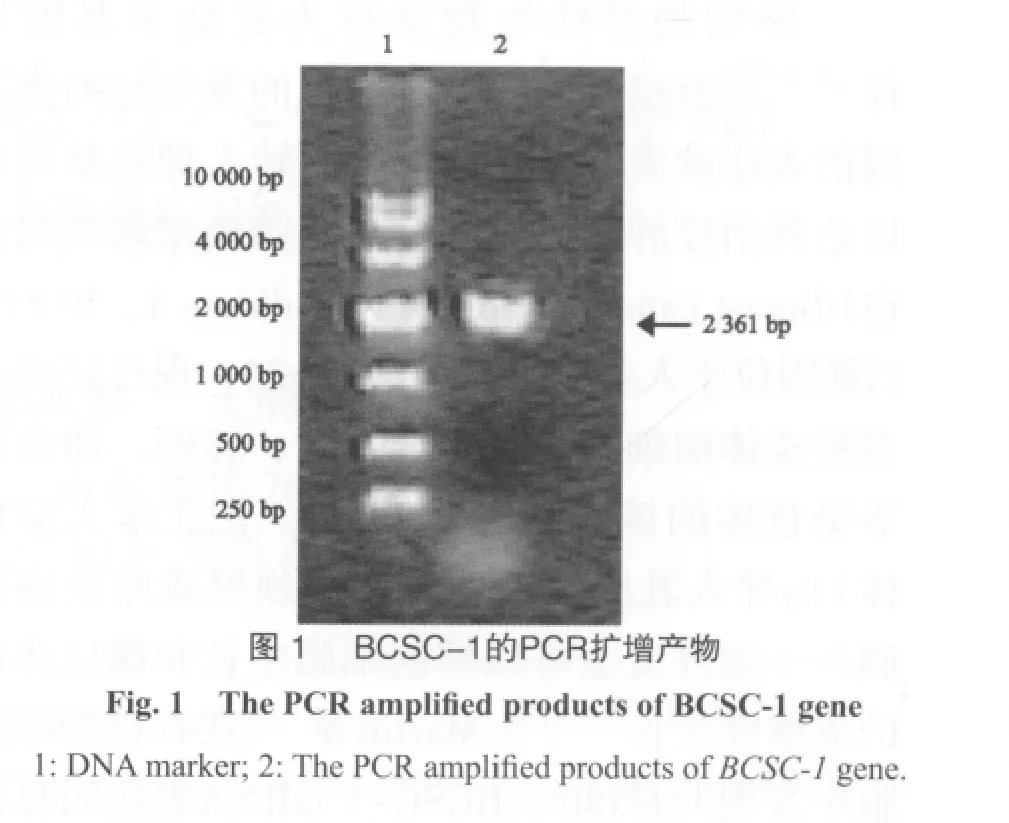
2 结 果
2.1 BCSC-1基因的扩增
以pDC316-BCSC-1为模板,扩增人BCSC-1基因,其全长为2 361 bp,PCR产物经琼脂糖凝胶电泳可见清楚的特异扩增带,片段大小与预期结果相符(图1)。
2.2 重组质粒pcDNA3.1/v5-His B-BCSC-1的构建
将PCR产物与质粒pcDNA3.1/v5-HisB进行EcoRⅠ和XbaⅠ限制性酶切,纯化后在T4连接酶作用下进行连接。重组质粒经酶切及PCR鉴定,目的片段大小与预期相符(图2)。经上海生工公司DNA测序后结果显示,目标序列与GenBank (Accession Number:NM_014622)相应序列相符,证实表达载体质粒pcDNA3.1/v5-HisBBCSC-1构建成功。

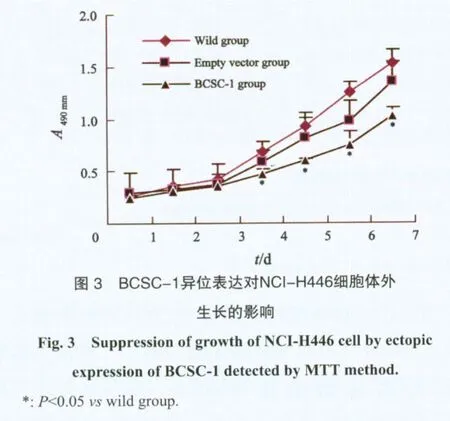
2.3 BCSC-1基因异位表达对NCI-H446细胞增殖能力的影响
细胞生长曲线显示,异位表达BCSC-1的NCI-H446细胞与空载体转染组和野生NCI-H446细胞相比,生长明显减慢。从实验第4天开始有差别,随培养时间延长差别越来越明显(P<0.05,图3)。
2.4 BCSC-1基因异位表达对NCI-H446细胞周期的影响
异位表达BCSC-1的NCI-H446细胞、空载体组及野生型NCI-H446的细胞分别有(58.11±2.3)%、(52.79±2.4)%、(45.95±0.9)%细胞处于G0/G1期,分别有(27.23±1.3)%、(34.45±2.4)%、(38.55±0.6)%细胞处于S期,分别有(14.66±1.8)%、(12.75± 2.0)%、(15.50±1.2)%细胞处于G2期(图4)。细胞周期分析显示,野生型NCI-H446细胞和转染空载体的NCI-H446细胞有较多细胞处于S期或G2/M期,而异位表达BCSC-1的NCI-H446细胞大部分阻滞在G0/G1期(P<0.01)。

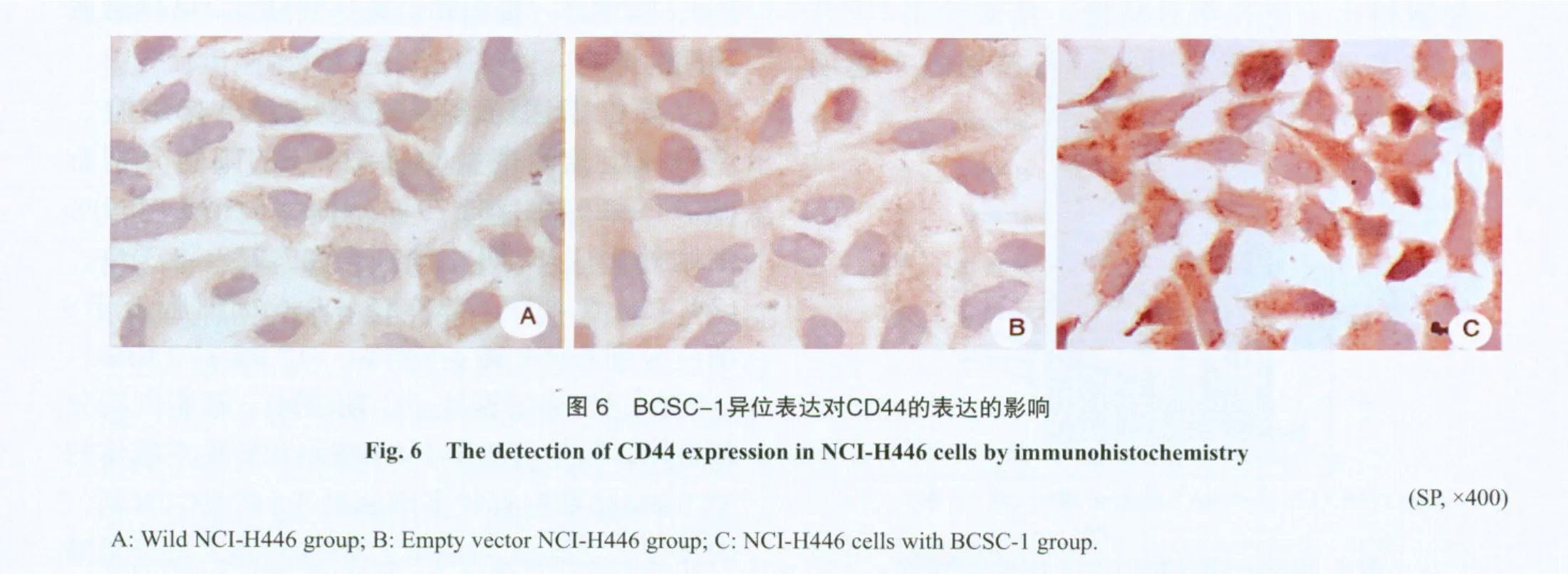
2.5 BCSC-1基因异位表达对BCSC-1和CD44的影响
用抗BCSC-1和CD44抗体进行免疫组化染色显示,BCSC-1在野生型NCI-H446细胞中表达很低,异位表达的BCSC-1主要集中在细胞质,在核周有聚集现象;与野生型NCI-H446细胞和转染空质粒的NCI-H446细胞相比,异位表达BCSC-1的NCI-H446细胞黏附分子CD44表达也增强(图5,图6)。

3 讨 论
基因治疗近年来已成为肿瘤研究的领域。鉴于抑癌基因在维持基因组完整性和调节细胞增殖、分化和凋亡中起重要作用,抑癌基因缺失或突变所致的功能异常直接与肿瘤发生相关,使用抑癌基因置换成增补患者体内有缺陷的基因是肿瘤基因治疗的研究热点之一[7-8]。
BCSC-1基因是近年发现的抑癌基因,其异位表达可以抑制鼻咽癌细胞的恶性生物学行为,提示了在人鼻咽癌细胞CNE-2L2中BCSC-1是抑癌基因[9]。野生型CNE-2L2细胞的BCSC-1基因表达极低,因此BCSC-1基因在CNE-2L2细胞的异位表达可以抑制细胞恶性生物学行为。而BCSC-1基因的异位表达是否对所有(或大多数)内源性低表达此基因的肿瘤细胞的恶性生物学行为均有明显的抑制作用?本研究将BCSC-1基因转染入人小细胞肺癌NCI-H446细胞,结果发现BCSC-1基因的异位表达明显抑制NCH-H446细胞的增殖,进一步证实了BCSC-1基因是一个抑癌基因。
此外,本实验通过对细胞周期的检测,发现转染BCSC-1基因的细胞发生G1期阻滞,而其他对照组细胞没有发生。这表明BCSC-1基因能抑制细胞生长,至少有部分是由于G1期阻滞所致。免疫组化的结果显示,异位表达BCSC-1的NCI-H446细胞黏附分子CD44的表达增高。CD44分子表达与肺癌细胞的增殖、转移和黏附有着密切关系,而CD44表达与肺癌转移是否相关现有资料尚有争论。一般认为,CD44在非小细胞肺癌中表达,在小细胞肺癌中不表达;在高分化肺癌中的表达高于低分化肺癌[10];Kazuhisa等[11]发现CD44的表达恢复有助于增强非小细胞肺癌细胞对巨噬细胞毒性的敏感性,但最近也有报道认为CD44是小细胞肺癌干细胞的标志[12]。因此,BCSC-1异位表达对CD44表达增强的调控可能是影响细胞增殖的重要因素,但其机制尚需进一步研究。通过本研究,我们可以初步认识BCSC-1的抑瘤作用,为肿瘤基因治疗提供新的策略。
[1]YOKOTA J. Tumor progression and metastasis [J].Carcinogenesis, 2000, 21(3): 497-503.
[2]CAIRNS R A, KHOKHA R, HILL R P. Molecular mechanisms of tumor invasion and metastasis: an integrated view [J].Curr Mol Med, 2003, 3(7): 659-671.
[3]MARTIN E S, CESARI R, PENTIMALLI F, et al. The BCSC-1 locus at chromosome 11q23-q24 is a candidate tumor suppressor gene [J]. Proc Natl Acad Sci USA, 2003,100(20): 11517-11522.
[4]WANG S S, VIRMANI A, GAZDAR A F, et al. Refined mapping of two regions of loss of heterozygosity on chromosome band 11q23 in lung cancer [J]. Genes Choromosomes Cancer,1999, 25(2): 154-159.
[5]MURAKAMI Y, NOBUKUNI T, TAMURA K, et al.Localization of tumor suppressor activity important in nonsmall cell lung carcinoma on chromosome 11q [J]. Proc Natl Acad Sci USA, 1998, 95(14): 8153-8158.
[6]袁芳, 鞠吉雨, 刘艳菲, 等. 抗人乳腺癌候选抑制蛋白1单克隆抗体的制备及鉴定 [J]. 细胞与分子免疫学杂志,2010, 26(12): 1226-1231.
[7]CRISS D, BURMESRER J K. Gene therapy for cancer treatment: past, present and future [J]. Clin Med Res,2006, 4(3): 218-227.
[8]FANG B, ROTH J A. Tumor-suppressing gene therapy [J].Cancer Biol Ther, 2003, 2(4): 5115-5121.
[9]陈双玲, 周异群, 田云, 等. BCSC-1异位表达抑制鼻咽癌细胞的恶性生物学行为 [J]. 中国医学科学院学报, 2007,29(5): 612-617.
[10]赵惠儒, 方军, 杜光烨, 等. CD44在肺癌中表达的临床研究[J]. 中华结核和呼吸杂志, 1998, 21(9): 541-543.
[11]TAKAHASHI K, TAKAHASHI F, HIRAMA M, et al.Restoration of CD44S in non-small cell lung cancer cells enhanced their susceptibility to the macrophage cytotoxicity[J]. Lung Cancer, 2003, 42(2): 145-153.
[12]高全立, 汪萍. 小细胞肺癌干细胞样细胞的分离鉴定[J]. 中国癌症杂志, 2010, 20(6): 421-426.
Inhibition of malignant proliferation of human small cell lung cancer cells by ectopic expression of BCSC-1 gene
YUAN Fang, JU Ji-yu, TANG Yuan-yuan, DI Da-lin, WANG Li-na, SUN Ping(Department of Immunology, Weifang Medical University, Weifang Shandong 261053, China)
JU Ji-yu E-mail:jujiyu@163.com
Background and purpose:BCSC-1 gene has been proven to be a new tumor suppressor gene.This study explored the effects of ectopic expression of BCSC-1 gene on the proliferation of human small cell lung cancer NCI-H446 cell by transferring BCSC-1 gene.Methods:The BCSC-1 cDNA was amplified and inserted into pcDNA3.1/v5-HisB. pcDNA3.1/v5-HisB-BCSC-1 and pcDNA3.1/v5-HisB were transfected into wild-type NCI-H446 cells with liposome. FACSort fl ow cytometry analysis was performed to assess the cell cycle by propidium iodide (PI)stained DNA. The proliferation of cell was detected by MTT method. The expressions of BCSC-1 and CD44 were detected by immunohistochemistry.Results:Eukaryotic recombinant expression vector pcDNA3.1/v5-HisB-BCSC-1 was successfully constructed. A stable cell line expressing BCSC-1 protein was successfully established. Cell cycle analysis showed that the NCI -H446 cells with ectopic expression of BCSC-1 was mostly blocked in the G0/G1phase(P<0.01). MTT assay showed that the growth of NCI-H446 cells with ectopic expression of BCSC-1 was inhibited(P<0.05) compared with control and blank groups. The expressions of BCSC-1 and CD44 were higher in the NCI-H446 cells with ectopic expression of BCSC-1 compared with control and blank groups.Conclusion:Ectopic expression of BCSC-1 gene exerts profound inhibitory effect on the malignant proliferation of NCI-H446 cel1s. This inhibition may be related to the cell cycle arrest and increased expression of CD44.
BCSC-1 gene; NCI-H446 cell; Growth curve; Cell cycle; CD44
10.3969/j.issn.1007-3969.2012.05.003
R734.2
A
1007-3639(2012)05-0336-06
山东省自然科学基金(No: 2009CM019);山东省教育厅资助项目(No: 2007WZ30)。
鞠吉雨 E-mail:jujiyu@163.com
2011-12-21
2012-03-21)
