红色荧光蛋白和荧光素酶双报告基因转基因小鼠的建立
2012-05-28张余琴林晓琳贾俊双谢饶英樊全荣赵尊兰杨升高飞姚开泰肖东
张余琴 林晓琳 贾俊双 谢饶英 樊全荣 赵尊兰杨升 高飞 姚开泰 肖东
南方医科大学肿瘤研究所,△比较医学研究所暨实验动物中心,广东 广州 510515
红色荧光蛋白和荧光素酶双报告基因转基因小鼠的建立
张余琴 林晓琳 贾俊双 谢饶英 樊全荣 赵尊兰杨升 高飞 姚开泰 肖东△
南方医科大学肿瘤研究所,△比较医学研究所暨实验动物中心,广东 广州 510515
背景与目的:活体动物体内光学成像(opticalin vivoimaging)主要采用生物发光与荧光两种技术。生物发光是用荧光素酶(luciferase,Luc)基因标记细胞或DNA,而荧光技术则采用荧光报告基团(GFP、RFP、Cyt及dyes等)进行标记,利用一套非常灵敏的光学检测仪器,能够直接监控活体生物体内的细胞活动和基因行为,生物发光成像具有高的灵敏度和特异性,同时生物发光信号可用于精确定量,而荧光成像具有方便、便宜、直观、标记靶点多样和易于被大多数研究人员接受的优点。本研究基于慢病毒介导的转基因方法制备红色荧光蛋白(red fluorescent protein,RFP)和Luc双报告基因转基因小鼠(即RL转基因小鼠),将这两种技术融为一体。方法:制备携带RFP和Luc基因(简写RL基因)的慢病毒,然后将携带RL基因的慢病毒注入小鼠单细胞受精卵卵周隙以感染受精卵,胚胎移植进假孕母鼠以获得仔鼠,应用小动物活体成像仪、体视荧光显微镜和PCR等在蛋白和DNA水平上筛选和鉴定,并获得RL转基因小鼠。结果:移植卵周隙注射有慢病毒的胚胎125枚给6只假孕母鼠,其中4只假孕母鼠怀孕,共生仔鼠20只;利用小动物活体成像仪检测RFP和Luc表达,在蛋白水平证实20只F0代中,3只高表达RFP和Luc;DNA水平检测证实,3只RFP和Luc阳性的小鼠基因组中确实整合有外源转基因RL,预示基因型鉴定结果很好验证了小动物活体成像仪筛选和鉴定结果。此外,RL转基因首建鼠基因组中整合的RL转基因可稳定遗传至下一代,并能正常表达。RL转基因小鼠主要脏器均可见红色荧光和Luc信号,但不同脏器间荧光和Luc强度有差异。结论:成功制备RL双报告基因转基因小鼠,为后续研究干细胞在肿瘤发生、发展和转移中的作用和造血重构等提供双报告基因标记的各种移植用供体细胞,并对此供体细胞及其在体内衍生的细胞进行灵敏的非损伤、实时可视化体内跟踪。
红色荧光蛋白;荧光素酶;慢病毒载体法;肿瘤干细胞;转基因小鼠
活体动物体内光学成像(opticalin vivoimaging)主要采用生物发光(bioluminescence)与荧光(fluorescence)两种技术。生物发光是用荧光素酶(luciferase,Luc)基因标记细胞或DNA,而荧光技术则采用荧光报告基因(GFP、RFP),或Cyt及dyes等荧光染料进行标记,利用报告基因产生的生物发光,荧光蛋白质或染料就可以形成体内的生物光源。两者的主要区别在于前者是动物体内的自发荧光,不需要激发光源,而后者则需要外界激发光源的激发。生物发光成像和荧光成像有各自的特点和优点,比如生物发光成像具有高的灵敏性和特异性,同时生物发光信号可用于精确定量;而荧光成像具有方便、便宜、直观、标记靶点多样和易于被大多数研究人员接受的优点。为将生物发光成像和荧光成像的优点集为一体,Cao等[1]将绿色荧光蛋白(green fluorescent protein,GFP)转基因小鼠和Luc转基因小鼠进行交配以获得双报告基因(GFP和Luc)的转基因小鼠,然后再从该双报告基因转基因小鼠骨髓中分离得到双报告基因标记的移植供体细胞——造血干细胞(hematopoietic stem cells,HSCs),以供移植实验来研究造血重构,从而在小鼠上实现了非损伤、实时和可视体内跟踪移植供体细胞及其在体内衍生的细胞,结果多报告基因(GFP或RFP和Luc)标记的移植细胞较单报告基因(GFP、RFP或Luc)标记的移植细胞在实际应用中更具有优势。目前,报告基因(GFP、RFP或Luc)表达受无细胞或无组织特异启动子驱动的转基因小鼠,绝大多数是单报告基因[1-3],而通过单报告基因小鼠交配的方法获得双报告基因标记的供体移植细胞需花费较长时间。为此,本实验应用慢病毒介导的转基因方法制备红色荧光蛋白(red fluorescent protein,RFP)和Luc (简写RL)双报告转基因小鼠,为相关研究提供双报告基因标记的各种移植用供体细胞,借助该类细胞有助于将生物发光、荧光两项技术融为一体,从而为实现灵敏的非损伤、实时和可视化体内跟踪移植供体细胞及其在体内衍生的细胞奠定基础。
1 材料和方法
1.1 材料
1.1.1 载体和细胞
慢病毒载体pRL由本课题组构建,pRL中含红色荧光蛋白(monomeric red fluorescence protein,mRFP)基因和萤火虫荧光素酶(Luc)基因,其表达受CAG (CMV early enhancer/chicken beta actin promoter)启动子调控。慢病毒包装系统psPAX2和pMD2.G由瑞士Didier Trono博士惠赠。293FT细胞来源和培养方法等参见文献[2]。
1.1.2 实验动物
C57BL/6小鼠和昆明小鼠(SPF级,6~8周龄,16~22 g)由南方医科大学实验动物中心提供[生产许可证号:SCXK(粤)2006-0015],饲养于SPF级屏障系统内,设施使用合格证号:SYXK(粤)2006-0074。C57BL/6小鼠用作以下群体:供受精卵用雌鼠和种公鼠,昆明小鼠用作以下群体:假孕母鼠和结扎雄鼠。
1.1.3 主要试剂
PCR扩增试剂dNTP和Taq酶及限制性内切酶等购自大连TaKaRa公司,质粒提取试剂盒购自QIAGEN公司,KSOM培养液和FHM操作液购自Chemicon公司,透明质酸酶、矿物油和细胞松弛素购自Sigma公司。细胞培养和转染用试剂等来源参见文献[4],其余试剂为国产或进口化学纯或分析纯。
1.1.4 主要仪器及原理
小动物活体成像仪(即Xenogen IVIS Lumina Imaging System)为精诺真(Xenogen)公司产品,其主要由超低温下的高度敏感的CCD相机及特别设计的成像暗箱、激光器、激发和发射滤光片、恒温台、气体麻醉系统、数据采集的计算机、数据处理软件(Living Imaging)等组成,可精确检测并记录这些光子[5-6]。正置荧光显微镜、倒置荧光显微镜均为尼康(Nikon)公司生产,冰冻切片机为莱卡(Leica)公司产品。
1.2 方法
1.2.1 慢病毒包装、浓缩及鉴定
慢病毒包装、浓缩和保存步骤和方法参见文献[4]和Invitrogen公司操作手册。经超速离心浓缩的病毒分装后于-80 ℃保存备用;用浓缩后的病毒感染293FT细胞,24~48 h后荧光显微镜下观察是否见红色荧光,以确认病毒是否成功生产。
1.2.2 慢病毒卵周隙注射制备RL转基因小鼠
超数排卵后采集受精卵,然后将浓缩后的病毒注射入小鼠受精卵的卵周隙中,并将注射后状态良好的受精卵移植进昆明假孕母鼠输卵管内,仔鼠一般19.5~20.0 d后出生。假孕母鼠和结扎雄鼠制备以及超数排卵、受精卵采集、病毒卵周隙注射和受精卵移植等方法参见文献[5-8]。
1.2.3 利用小动物活体成像仪筛选与鉴定RL转基因首建鼠
将出生几天后的仔代乳鼠置于小动物活体成像仪(即Xenogen IVIS Lumina Imaging System)内,检测RFP和Luc表达以初筛RL转基因小鼠,并从中选出荧光强度适中的乳鼠,作标记。
利用小动物活体成像仪检测Luc表达前,小鼠腹腔注射底物D-luciferin (0.15 mg/g),出生几天的小鼠不麻醉直接检测Luc,3周龄以上小鼠检测Luc时需先麻醉再检测;注射底物5~10 min后,利用小动物活体成像仪活体检测Luc表达。
1.2.4 采用PCR进行基因型鉴定以验证小动物活体成像仪鉴定结果
在利用小动物活体成像仪初筛和鉴定RL转基因小鼠的基础上,应用PCR验证RFP和Luc阳性的小鼠基因组是否成功整合转基因RL。
步骤与方法如下:小鼠出生3周后,剪鼠尾,采用基因组DNA 提取试剂盒(申能博彩生物科技有限公司)从潜在的RL转基因小鼠和野生型小鼠(阴性对照)鼠尾组织提取基因组DNA,操作参见试剂盒说明书和文献[7]。PCR扩增转基因用引物,P1:5’-GGGAGCGCGTGATGAAC-3’;P2:5’-CGTTGTGGGAGGTGATGTC-3’。PCR反应条件:95 ℃预变性7 min;95 ℃变性50 s, 54 ℃退火50 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min。PCR扩增后,取5 mL反应液进行2%琼脂糖凝胶电泳。
1.2.5 RL转基因首建鼠繁殖传代及转基因遗传和表达稳定性检测
将RFP和Luc表达阳性及PCR阳性的首建鼠与野生型小鼠交配以传代,获得F1后,用小动物活体成像仪检测RFP和Luc是否在F1代表达,对其表达稳定性作出判断,并进而间接判断外源转基因是否稳定遗传。
1.2.6 体视荧光显微镜检测RL转基因小鼠各器官RFP表达
小鼠出生>6周,深度麻醉后,用PBS自小鼠左心室注入至右心房流出,直至流出液变成无色透明后,收集主要脏器(如心脏、肺、脑、肾脏、胃、肝脏、脾脏、胸腺、小肠等),并在体视荧光显微镜下检测红色荧光,然后取心脏、肺、肾脏和胃行冰冻切片以在组织层面检测RFP表达。
2 结 果
2.1 携带RL基因慢病毒的包装、浓缩及成功生产鉴定
将pRL与病毒包装质粒共转染293FT细胞,48 h后倒置荧光显微镜下可见红色荧光,预示着转染成功。收集的病毒上清液(滴度为5.1×106TU/mL)经超速离心浓缩后(滴度为4.2×108TU/mL)感染293FT细胞,48 h后倒置荧光显微镜下可见红色荧光,预示病毒成功生产。
2.2 RL转基因小鼠的建立
本研究采用慢病毒卵周隙注射法建立RL转基因小鼠(10~100 pL/受精卵),示意图参见文献[2]。
移植卵周隙注射有慢病毒的125枚胚胎给6只假孕母鼠,其中4只假孕母鼠怀孕[受孕率为67% (4/6)],共生仔鼠20只[产仔率为16%(20/125)];利用小动物活体成像仪检测RFP和Luc表达,在蛋白水平证实20只F0代中,3只表达RFP和Luc (图1A);DNA水平检测证实,3只RFP和Luc阳性小鼠基因组中确实整合有外源转基因RL(图1B),预示基因型鉴定结果很好验证了小动物活体成像仪筛选和鉴定结果。

A: Screening RL transgenic founders by in vivo non-invasive bioluminescence and fl uorescence imaging. Two foster mothers gave birth to 5 and 6 F0 pups, respectively; 3 RFP and Luc-positive RL transgenic mice (referred to as R1, R2 and R3) were found via RFP and Luc assay by Xenogen IVIS Lumina Imaging System 2 days after birth. Figure a and d are taken under white light which respectively represent two different litters pups delivered by two different foster mothers, while fi gure b, e and c, f were gained respectively under Luc image (after injection of luciferase substrate) and RFP image by in vivo non-invasive bioluminescence and fluorescence imaging. B: RFP- and Luc-positive founders verified for RL transgene presence by PCR analysis. Three mRFP-Luc-positive mice (R1, R2, R3) were individually analyzed by PCR for the genomic integration of transgene with tail biopsy-derived DNA from mice (R1, R2, R3). Lane M: Maker 2000; Lane PC: Positive control (pCAGRL as template); Lane NC: Negative control using genomic DNA from WT mouse as template. Data are representative of three independent PCR experiments that yield similar results.
2.3 RFP和Luc转基因遗传和表达稳定性检测
为证实首建鼠所携带的外源基因可否稳定遗传,将RFP和Luc表达阳性及PCR阳性的首建鼠R1与野生型小鼠交配以获得F1代(图1)。小动物活体成像仪检测显示,新生的F1代小鼠中部分个体表达RFP和Luc(图2A),而成年小鼠也能正常表达Luc和RFP(图2B),这些预示外源基因RL不仅可以从一代向下一代稳定传递,且能够稳定表达。
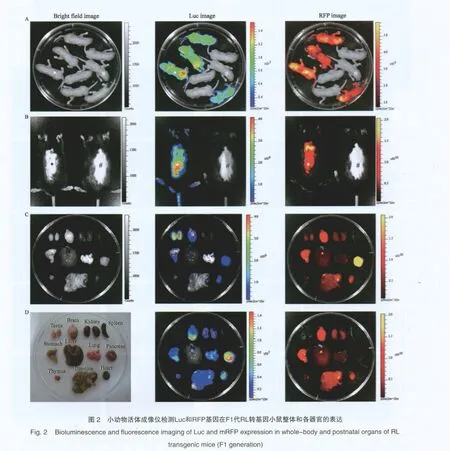
RFP and Luc expression in the whole-body and postnatal adult organs of RL transgenic mice was detected by the Xenogen IVIS Lumina Imaging System. A: F1 progeny inherit and express RFP and Luc transgene from founder R1. Whole-body bioluminescence and fl uorescence imaging for newborn offspring derived from the mating between founder R1 and wild-type mouse was performed. B: Whole-body bioluminescence and fl uorescence imaging for adult RL transgenic mouse (F1). The RFP- & Luc-positive RL transgenic mouse [marked by asterisk (*)] and RFP- &Luc-negative mouse [marked by pound (#)] shown in Fig. A were selected for whole-body bioluminescence and fl uorescence imaging. C: In vitro imaging of Luc and RFP expression in organs from the same mouse [marked by asterisk (*)]. The picture was taken after removing testis from the picture (B), while the picture (RFP image) was taken after removing testis and pancreas from the picture (B).
2.4 RFP和Luc转基因在RL转基因小鼠各器官上的表达
小动物活体成像仪检测离体器官Luc表达显示:RL转基因小鼠主要脏器(如睾丸、胰腺、脑、心、胃、肺、小肠、肾、胸腺和肝)均可见Luc信号,但不同脏器间Luc信号强度之间有差异(图2C)。
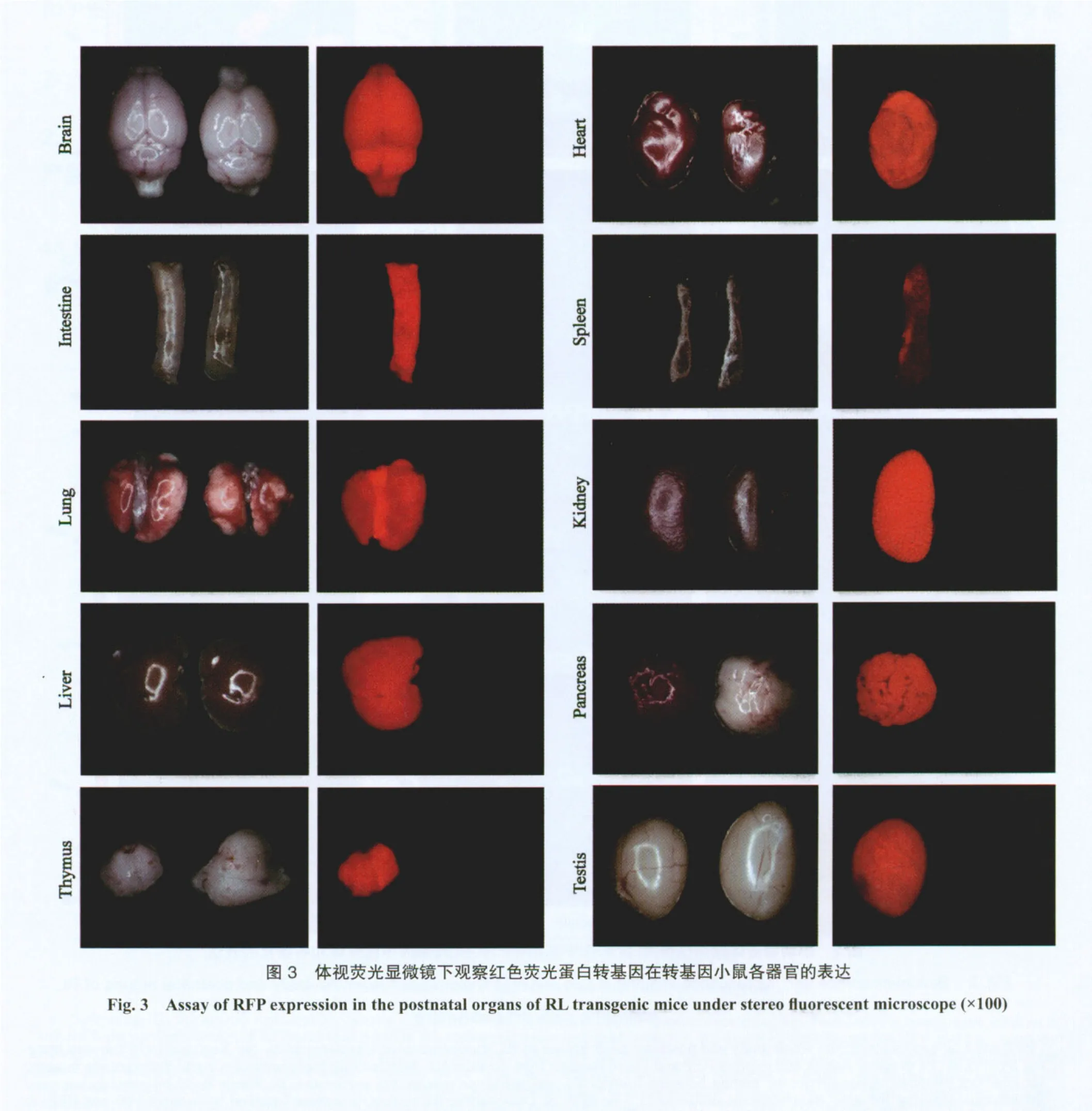
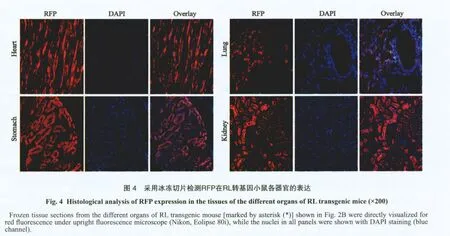
体视荧光显微镜检测RL转基因小鼠各器官RFP表达显示:RL转基因小鼠的主要脏器如睾丸、胰腺、脑、心、胃、肺、小肠、肾、胸腺和肝均可见红色荧光(图3),但不同脏器间荧光强度有差异,其中胰腺、脑、胃、小肠、心、睾丸和肾RFP表达水平较高,肝、肺、胸腺和脾RFP表达水平较低(图2C)。心脏、肺、肾脏和胃行冰冻切片后,亦可在组织层面检测到RFP表达(图4)。
3 讨 论
本研究在积极探索简便易行的“非损伤可视外源转基因跟踪”策略与方法,以便替代PCR和Southern blot等传统跟踪转基因的方法。如RL转基因小鼠筛选与鉴定过程中,应用小动物活体成像仪通过活体检测新生仔鼠整体RFP和Luc表达,进而成功筛选并鉴定出RL转基因小鼠,而对这些RFP和Luc阳性的个体行基因型鉴定(利用PCR技术),证实这些鼠基因组中确实整合了外源转基因RL。至此,本研究初步建立了简便易行的“非损伤可视外源转基因跟踪”策略与方法,该方法有望替代PCR和Southern blot等传统跟踪转基因的方法。
目前除胚胎干细胞外,小鼠不同组织来源的成体干细胞均未建立成熟的体外培养体系,这给外源基因(包括报告基因)导入带来诸多不便;为此,在进行移植实验时,往往从报告基因转基因小鼠(报告基因的表达受普遍性的无细胞或无组织特异的启动子调控)相应组织(如骨髓等)中获取报告基因标记的待移植细胞。目前,转基因报告小鼠主要为单报告基因,如单RFP、单Luc转基因小鼠[2,11],而活体内生物发光[用荧光素酶(Luciferase,Luc)基因标记细胞等)成像和荧光 [荧光报告基团(GFP和RFP等)]成像各有优点,如生物发光成像灵敏度高、特异性极强、可精确定量和组织穿透能力强等,而荧光成像虽有背景噪音、灵敏度低和穿透能力弱等缺点,但荧光信号强、标记靶点多样、观察直观和检测方便等[10-12]。因此,对于不同研究,应根据生物发光成像和荧光成像各自特点和优势进行选择。为将生物发光和荧光的优点融为一体,有研究者通过GFP转基因小鼠和Luc转基因小鼠交配以获得双报告基因(GFP和Luc)转基因小鼠,并进而从其骨髓中分离得到双报告基因标记的移植供体细胞——造血干细胞(HSCs),以供移植实验来研究造血重构,从而实现非损伤、实时和可视化体内监测造血重构过程。目前,报告基因(GFP、mRFP或Luc)表达受无细胞或无组织特异启动子驱动的转基因小鼠均是单报告基因的,而通过以上方法获得双报告基因标记的供体移植细胞需花费较长时间。而双报告基因RL转基因小鼠的成功建立将为相关研究提供双报告基因标记的各种移植用供体细胞,借助该类细胞有助于将生物发光、荧光两项技术融为一体,双报告基因(RFP和Luc)标记的移植细胞较单报告基因(GFP、RFP或Luc)标记的移植细胞在实际应用中更具有优势[15-18],如在细胞水平时,可以根据其细胞带有的RFP来筛选,体内跟踪实验时,又可以利用其带有的Luc报告基因进行追踪,特异性好,灵敏度高,组织穿透力强,从而充分发挥各自优势,更有利于实验研究。
综上所述,本研究成功建立了RFP和Luc双报告基因转基因小鼠,该小鼠将为相关研究(如干细胞移植、干细胞在肿瘤发生、发展和转移中的作用、造血重构等)提供双报告基因标记的各种移植用供体细胞,借助该类细胞有助于将生物发光、荧光两项技术融为一体,从而实现灵敏的非损伤、实时和可视化体内跟踪移植供体细胞及其在体内衍生的细胞[19]。
[1]CAO Y A, WAGERS A J, BEILHACK A, et al. Shifting foci of hematopoiesis during reconstitution from single stem cells[J]. Proc Natl Acad Sci U S A, 2004, 101(1): 221-226.
[2]贾俊双, 肖高芳, 林晓琳, 等. 慢病毒载体法制备红色荧光蛋白转基因小鼠 [J]. 中国比较医学杂志, 2010, 20(2):12-16.
[3]ZHU H, WANG G, LI G, et al. Ubiquitous expression of mRFP1 in transgenic mice [J]. Genesis, 2005, 42(2): 86-90.
[4]贾俊双, 孙妍, 肖东, 等. 慢病毒介导的外源基因体外投递系统的建立 [J]. 热带医学杂志, 2008, 8(10): 1028-1029,1037.
[5]RICE B W, CABLE M D, NELSON M B. In vivo imaging of light-emitting probes [J]. J Bionmed Opt, 2001, 64(3):249-255.
[6]ENDINGER M, CAO Y A, VERNERIS M R, et al. Revealing lymphoma growth and the efficacy of immune cell therapies using in vivo bioluminescence imaging [J]. Blood, 2003,101(2): 640-648.
[7]NAGY A, GERTSENSTEI M, VINTERSTEN K, et al.Manipulating the mouse embryo: a laboratory manual [M].Cold Spring Harbor Laboratory Press, 2004, 192-203.
[8]SINGER O, TISCORNIA G, IKAWA M, et al. Rapid generation of knockdown transgenic mice by silencing lentiviral vectors [J]. Nat Protoc, 2006, 1(1): 286-292.
[9]XIAO D, YUE Y, DENG X Y, et al. Rescue of the albino phenotype by introducing a functional tyrosinase minigene into Kunming albino mice [J]. World J Gastroenterol, 2007,13(2): 244-249.
[10]XU K, DENG X Y, YUE Y, et al. Generation of the regulatory protein rtTA transgenic mice [J]. World J Gastroenterol,2005, 8(19): 2885-2891.
[11]张余琴, 林晓琳, 贾俊双, 等. 慢病毒载体法制备荧光素酶转基因小鼠 [J]. 热带医学杂志, 2012, 12(3): 245-247.
[12]周涛, 韩彧, 巩伟丽, 等. 活体动物体内成像技术及其在生物医学中的应用进展 [J]. 中国体视学与图像分析,2007, 12(1): 69-74.
[13]张怡, 韩彧, 赵春林, 等. 活体动物体内光学成像技术的研究进展 [J]. 生命科学, 2006, 18(1): 25-30.
[14]陈陵, 高军. 活体生物光学分子成像技术研究进展 [J].医学综述, 2010, 16(24): 3800-3802.
[15]ZHANG W, PURCHIO AF, CHEN K et al, A transgenic mouse model with a luciferase reporter for studying in vivo transcriptional regulation of the human CYP3A4 gene [J].Drug Metabolish Disposition, 2003, 31(8): 1054-1064.
[16]JENKINS DE, OEI Y, HORNIG YS et al. Bioluminescent imaging (BLI) to improve and refine traditional murine models of tumor growth and metastasis [J]. Clin Exp Metastasis,2003, 20(8): 733-744.
[17]ZHU H, WANG G, LI G, et al. Ubiquitous expression of mRFP1 in transgenic mice [J]. Genesis, 2005, 42(2): 86-90.
[18]VAN DEN BRANDT J, WANG D, KWON SH, et al.Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo [J]. Genesis, 2004, 39(2): 94-99.
[19]LIAO CP, ZHONG C, SARIBEKYAN G. Mouse models of prostate adenocarcinoma with the capacity to monitor spontaneous carcinogenesis by bioluminescence or fluorescence [J]. Cancer Res, 2007, 67(15): 7525-7533.
Generation of RFP and luciferase double transgenic mice
ZHANG Yu-qin, LIN Xiao-lin, JIA Junshuang, XIE Rao-ying, FAN Quan-rong, ZHAO Zun-lan, YANG Sheng, GAO Fei, YAO Kai-tai,XIAO Dong(Cancer Research Institute, Southern Medical University, Guangzhou Guangdong 510515, China)
XIAO Dong E-mail:xiao_d@hotmail.com
Background and purpose:Opticalin vivoimaging includes bioluminescence and fl uorescence technology. Bioluminescence technique is that cells or DNA are labeled by gene luciferase (Luc), while fl uorescence technique is marked by a fl uorescent reporter (GFP and RFP, Cyt, and dyes, etc.), then using a very sensitive optical detection equipment to directly monitor the activity and gene behavior of the cells of living organismsin vivo.Bioluminescence imaging has high sensitivity and specificity compared with fluorescence imaging, moreover,bioluminescence signal can be used for precise quantitative while fluorescence imaging has the advantages of convenient, inexpensive, intuitive, and marking targets diversely and easily accepted by the majority of researchers.The study was aimed to generate red fl uorescent protein (RFP) and Luc double transgenic mice (i.e., RL transgenic mice) by lentivirus-mediated delivery of foreign genes into zygotes.Methods:RL transgenic mice were generated by the subzonal injection of lentivirus harboring RFP and Luc gene into single-cell fertilized eggs of mice to infect fertilized eggs, and subsequently embryos infected by lentivirus were transplanted into the pseudopregnant mice to attain F0 mice, followed by screening RL transgenic mice from potential founders via RFP and Luc assay by using the Xenogen IVIS Lumina Imaging System at birth, and subsequently conf i rmed the results of RFP and Luc assay by PCR-based genotyping.Results:In our study, 125 virus-injected eggs were transplanted into 6 pseudopregnant mice to attain 20 potential transgenic founders. Three RFP- and Luc-positive mice were found via RFP and Luc assay by using the Xenogen IVIS Lumina Imaging System 2 days after birth. PCR-based genotyping indicated that RL gene actually integrated into the genome of three RL-positive F0 mice, which conf i rmed the results of RFP and Luc assay.Furthermore, RL transgene could be transmitted from founders to subsequent generation (F1 progeny). Red fl uorescence and Luc could be detected in different adult organs including testis, kidney, stomach, intestine, lung, liver, brain,thymus, spleen and heart under stereo fl uorescence microscope and/or by the Xenogen IVIS Lumina Imaging System.Conclusion:RFP and Luc double transgenic mice were successfully produced to provide a variety of dual-reporter gene markers with donor cell transplantation for follow-up study of cancer stem cells in tumor development, metastasis and hematopoietic reconstruction, and traced this donor-derived cells and cells in the body with non-sensitive damage,real-time visualizationin vivo.
RFP; Luciferase; Lentiviral vector; Cancer stem cells; Ttransgenic mice
10.3969/j.issn.1007-3969.2012.05.001
R7XXX
A
1007-3639(2012)05-0321-08
国家自然科学基金委员会-广东省联合基金重点项目(No: u0732006);国家自然科学基金项目(No: 81172587;81100573);广东省自然科学基金项目(No: 9151063101000015);广东省科技计划项目(No: 2009B060300008);广东省医学科学技术研究基金(No: A2007359);南方医科大学优秀中青年科技人才库科研资助金和广州地区科学仪器协作共用网专用基金(No: 2006176)。
肖东 E-mail:xiao_d@hotmail.com
2011-12-10
2012-04-30)
