下调PAR基因表达对前列腺癌PC3细胞周期及Cdc25C蛋白表达的影响
2012-05-28徐晓峰周秀敏董杰张征宇葛京平周文泉魏武程文位志峰侯建全高建平
徐晓峰 周秀敏 董杰 张征宇 葛京平 周文泉 魏武程文 位志峰 侯建全 高建平*
1. 南京军区南京总医院泌尿外科,江苏 南京 210002;2. 苏州大学附属第一医院肿瘤科,△泌尿外科,江苏 苏州 215006
下调PAR基因表达对前列腺癌PC3细胞周期及Cdc25C蛋白表达的影响
徐晓峰1△周秀敏2董杰1张征宇1葛京平1周文泉1魏武1程文1位志峰1侯建全△高建平1*
1. 南京军区南京总医院泌尿外科,江苏 南京 210002;2. 苏州大学附属第一医院肿瘤科,△泌尿外科,江苏 苏州 215006
背景与目的:前列腺雄激素调节基因(prostate androgen regulated gene,PAR)在雄激素非依赖性前列腺癌中特异性高表达,可能与细胞恶性转化相关。本研究用RNA干扰技术下调PAR基因表达,并探讨其对前列腺癌PC3细胞细胞周期及调节因子Cdc25C表达的影响。方法:针对PAR基因的siRNA转染PC3细胞,以RT-PCR验证其对PAR基因表达抑制的有效性,用流式细胞术检测细胞周期,Western blot检测Cdc25C表达水平。结果:siRNA转染可抑制PC3细胞PAR基因表达,同时G2/M期细胞及凋亡细胞比例分别由(23.79±3.16)%及(1.49±0.13)%增加至(29.95±3.25)%和(20.61±2.73)%,Cdc25C蛋白表达水平明显下降。结论:PAR基因表达下调可诱导细胞G2/M期阻滞和凋亡,抑制细胞周期调节因子Cdc25C的表达。
PAR基因; 前列腺癌; 细胞周期; Cdc25C
前列腺癌(prostate cancer, PCa)是男性泌尿生殖系常见的恶性肿瘤。在欧美男性中,PCa位居癌症发病率之首[1-2]。前列腺雄激素调节基因(prostate androgen regulated gene,PAR)是前列腺癌特异性高表达的癌基因,且已有研究提示PAR基因与前列腺癌恶性转化相关[3]。
大量研究表明,肿瘤是细胞周期紊乱、细胞生长失控所致的疾病。Cdc25C是调控细胞周期进入M期的主要效应分子。Cdc25C在很多肿瘤中表达上调,且与肿瘤恶性程度、侵袭能力呈正相关[4-6]。
本实验采用RNA干扰技术抑制PAR基因在前列腺癌细胞系PC3中的表达,研究PC3细胞周期变化并检测Cdc25C蛋白表达水平,初步分析细胞周期变化的机制。
1 材料和方法
1.1 材料
人前列腺癌细胞株PC3购自中国典型培养物保藏中心,质粒psiRNA-hH1neo购自InvivoGen公司,限制性内切酶BbSⅠ购自Fermentas公司,总RNA提取试剂TRIzol和脂质体LipofectamineTM2000购自Invitrogen公司,M-MLV逆转录酶购自Promega公司,兔抗人的anti-Cdc25C一抗购自Santa Cruz公司,anti-ßactin购自Sigma公司,辣根过氧化合物(HRP)偶联的羊抗兔二抗购自Promega公司,HRP显色试剂盒购自Piece公司。
1.2 方法
1.2.1 SiRNA的设计与合成
从G e n B a n k查得人PA R基因(序列号为A F 1 1 5 8 5 0)序列,根据s i R N A的设计原则,选取序列如下:5’-CGTCCTGATAGATCCTCTGCT-3’(核苷酸序列AF115850 257~277)。用BLAST软件进行分析,未发现所选取的核苷酸序列与人体其他任何mRNA有同源性。设计好的序列送上海联合基因科技公司合成对应的siRNA-P。
1.2.2 细胞培养和siRNA转染
人前列腺癌细胞株PC3在含10%小牛血清的高糖型DMEM培养基中,于37 ℃、CO2体积分数为5%的条件下培养传代。PC3细胞以3×105个/孔的密度接种于6孔板。当细胞生长密度达到50%~70%时,用脂质体法转染,具体操作按试剂说明书进行。实验组每孔分别加入含有终浓度为50、100和200 nmol/L siRNA-P的OPTI-MEM无血清培养基,同时设立对照组(转染不针对任何靶基因的siRNA-C)。
1.2.3 逆转录PCR(RT-PCR)
转染48 h后,收集细胞,提取总RNA,以RNA逆转录后合成的第一条cDNA链为模板,进行PCR扩增。PAR基因的引物:上游引物5’-GTCAGCAAGCACCTCAAAT-3’;下游引物5’-GAAGAAGATGGGGAAAAGG-3’。β-actin基因的引物:上游引物5’-GTGCCACC AGACAGCACTGTGTTG-3’;下游引物5’- TGGAGAAGAGCTATGAGCTGCC TG-3’。PAR和β-actin基因的PCR扩增片断长度分别为451和202 bp。反应条件: 94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min(共30个循环);72 ℃终延伸10 min。扩增后的产物以1%琼脂糖凝胶电泳,EB染色,再经凝胶成像系统成像,用Gelworks 1D Advanced v4.01软件进行条带灰度分析。
1.2.4 流式细胞仪分析细胞调亡和细胞周期
用siRNA转染PC3细胞,转染后48 h收集细胞,然后用PBS洗涤2次,再以500 μL PBS重悬,加入-20 ℃预冷的85%的乙醇,4 ℃固定过夜。再用PBS洗涤2次,加入100 μL PC缓冲液(phosphate-citric acid buffer;0.2 mol/L Na2HPO4和0.1 mol/L 柠檬酸按192∶8的体积比混匀,pH=7.8),避光,置于室温20 min。再以PBS洗涤1次,加PI染液500 μL(含浓度为10 μg/mL的PI和100 μg/mL的RNase A),避光,置于室温30 min后上机,用流式细胞仪进行细胞调亡和细胞周期的检测。
1.2.5 Western blot检测
收集细胞,加入150 μL细胞裂解液进行裂解。于冰上裂解20 min,所得裂解液以14 000×g,4 ℃离心1 min。蛋白加上样缓冲液95 ℃变性5 min后进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后将蛋白转至PVDF膜上,5%脱脂奶粉37 ℃封闭1 h,加入兔抗人Cdc25C单克隆抗体,4 ℃过夜,TTBS洗膜4次,加羊抗兔IgG-HRP,室温杂交1 h,TTBS洗膜4次。用化学发光法显色。
1.3 统计学处理
使用SPSS 11.0统计软件对数据进行单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 转染siRNA对PC3细胞PAR mRNA表达的影响
针对PAR基因的siRNA转染PC3细胞48 h后,RT-PCR结果显示PAR mRNA的表达明显被抑制,且抑制作用随siRNA浓度增加而增强 (P<0.01,图1)。
2.2 细胞调亡和细胞周期变化
转染siRNA后48 h,对照组处于G2/M期的细胞为(23.79±3.16)%,凋亡率为(1.49±0.13)%;实验组处于G2/M期的细胞为(29.95±3.25)%,凋亡率为(20.61±2.73)%,与对照组相比,差异有统计学意义意义(P<0.01,表1,图2),说明转染针对PAR基因的siRNA对PC3细胞有明显的G2/M期阻滞作用,并能够诱导PC3细胞凋亡。
2.3 转染siRNA对PC3细胞Cdc25C蛋白表达水平的影响
Western blot结果显示转染针对PAR基因的siRNA,在50 nmol/L浓度即可观察到PC3细胞Cdc25C蛋白表达水平下调,且随着siRNA转染浓度的增加,抑制Cdc25C蛋白表达的作用亦增强,呈剂量-效应关系。与对照组相比,差异有统计学意义(P<0.01,图3)。
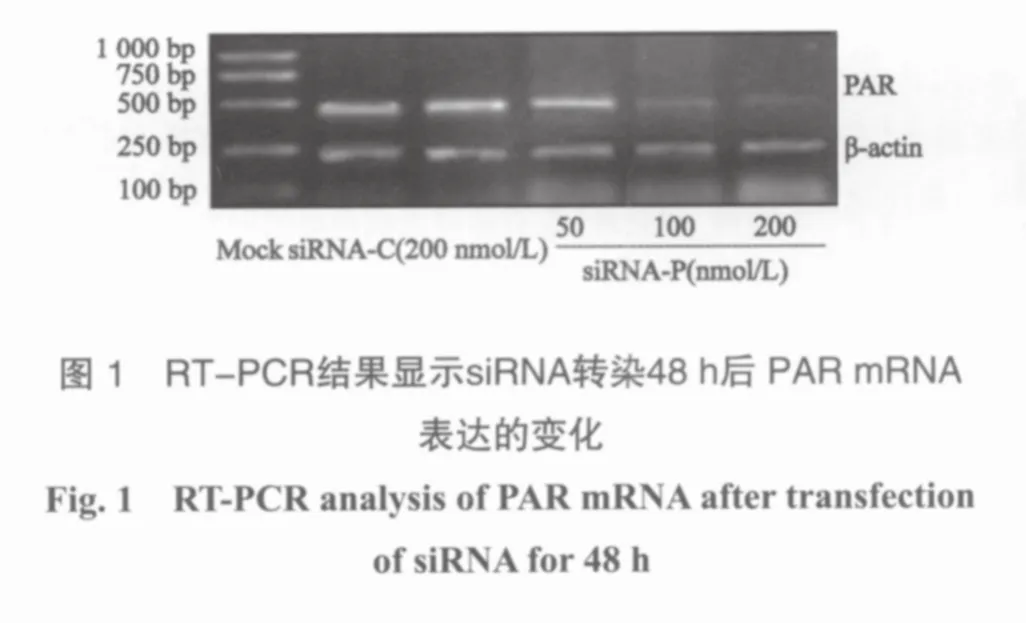

表 1 PAR基因表达抑制对PC3细胞周期和细胞凋亡的影响Tab. 1 Effects of PAR depletion on PC3 cell cycle distribution[±s(%)]

表 1 PAR基因表达抑制对PC3细胞周期和细胞凋亡的影响Tab. 1 Effects of PAR depletion on PC3 cell cycle distribution[±s(%)]
Cells Sub-G0/G1 G0/G1 S G2-M Control (siRNA-C) 1.49±0.13 55.68±3.20 19.05±2.12 23.79±3.16 siRNA-P 20.61±2.73 29.38±2.17 20.06±2.58 29.95±3.25 Treatment
3 讨 论
晚期PCa临床行内分泌治疗对病变进展起到一定抑制作用,但平均只能维持1~2年,之后常常因癌细胞出现雄激素非依赖性导致治疗失败[7]。近年来,人们在分子水平对雄激素非依赖性PCa的发病机制和治疗进行了大量的研究,不断寻找新的致癌基因并作为潜在的分子靶,而其中具有PCa组织特异性的致癌基因更有研究价值[8-9]。
在PCa中表达异常的基因PAR位于1号染色体,有1 038个碱基对,编码146个氨基酸的蛋白质,在正常的前列腺组织和癌组织中均有表达,但在大约67%癌组织标本中有更高的表达;PAR在LNCaP、DU145、PC3和LNCaP-OM等PCa细胞系中的表达也比正常的前列腺上皮细胞高;而在雄激素非依赖性细胞系DU145、PC3和LNCaP-OM的表达高于雄激素依赖性细胞系LNCaP。雄激素可以使雄激素依赖性细胞系的PAR表达下调,对雄激素非依赖性细胞系的PAR表达则无抑制作用[10]。Platica等[3]将PAR cDNA重组于质粒转染NIH3T3成纤维细胞系使其获得恶性表型。抑制PAR基因在雄激素非依赖性PCa细胞系中的表达,使其恶性表型逆转。
本实验采用靶向PAR基因siRNA转染PC3细胞,通过抑制PAR基因的表达研究其功能。转染siRNA的PC3细胞系与对照组相比,PAR基因的mRNA表达明显下调,提示RNAi技术可以有效抑制PAR的表达,有望作为PCa基因治疗的有效手段。
本研究进一步利用流式细胞术检测,发现PAR基因的mRNA表达下调能够明显引起PC3细胞G2/M期阻滞,凋亡增加。G2/M期检查点是细胞存活和死亡的重要决定点,细胞经过此点即进入分裂期[11-12]。下调PAR基因的表达抑制肿瘤细胞生长,其主要机制可能是诱导肿瘤细胞G2/M期阻滞和凋亡。
细胞周期进程是通过Cdc25磷酸酶激活细胞周期依赖性蛋白激酶(CDK)进行调控。已知Cdc25磷酸酶分3个亚型:Cdc25C、Cdc25B和Cdc25C。
Cdc2/cyclin B是G2/M期转变在G2期检查点的总开关,而Cdc25C是Cdc2/cyclin B的主要激活物。Cdc25C磷酸酶活性被抑制将导致Cdc2/cyclin B激活受阻,使细胞周期阻滞于G2/M期[13]。本研究检测抑制PAR基因表达后Cdc25C磷酸酶表达水平,发现Cdc25C磷酸酶表达下调,表明Cdc25C参与了PAR基因表达抑制后导致的PC3细胞G2/M期阻滞。
综上所述,PAR表达抑制能够引起PC3细胞G2/M期阻滞,凋亡增加。其机制可能是通过下调Cdc25C磷酸酶表达,进一步导致Cdc2/cyclin B激活受阻。
[1]AHMEDIN J, REBECCA S, JIAQUAN X, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60: 277-300.
[2]叶定伟, 李长岭. 前列腺癌发病趋势的回顾和展望[J].中国癌症杂志, 2007, 17(3): 177-180.
[3]PLATICA M, IVAN E, IONESCU A,et al. Transformation of NIH3T3 cells by enhanced PAR expression[J]. Biochem Biophys Res Commun, 2004, 314(3): 891-896.
[4]BAGHERIi-YARMAND R, NANOS-WEBB A, BIERNACKA A, et al. Cyclin E deregulation impairs mitotic progression through premature activation of Cdc25C[J]. Cancer Res,2010, 70(12): 5085-5095.
[5]WANG Z, TROPE C G, FLORENES V A, et al.Overexpression of CDC25B, CDC25C and phospho-CDC25C(Ser216) in vulvar squamous cell carcinomas are associated with malignant features and aggressive cancer phenotypes[J]. BMC Cancer, 2010, 10: 233.
[6]GARCIA-MORALES P, CARRASCO-GARCIA E, et al. Inhibition of Hsp90 function by ansamycins causes downregulation of cdc2 and cdc25c and G(2)/M arrest in glioblastoma cell lines[J]. Oncogene, 2007, 26(51):7185-7193.
[7]ATTAR R M, TAKIMOTO C H, GOTTARDIS M M.Castration-resistant prostate cancer: locking up the molecular escape routes[J]. Clin Cancer Res, 2009, 15(10):3251-3255.
[8]DEVLIN H L, MUDRY J M. Progression of prostate cancer:multiple pathways to androgen independence[J]. Cancer Lett, 2009, 274(2): 177-186.
[9]易晓明,周文泉. 内皮素系统在前列腺癌中的研究进展[J]. 医学研究生学报, 2011, 24(3): 327-332.
[10]LATICA O, CHEN S, IVAN E, et al. PAR, a novel androgen regulated gene, ubiquitously expressed in normal and malignant cells[J]. Int J Oncol, 2000, 16(5): 1055-1061.
[11]CHULU J L, LIU H J. Recent patents on cell cycle regulatory proteins[J]. Recent Pat Biotechnol, 2009, 3(1): 1-9.
[12]BUCHER N, BRITTEN C D. G2checkpoint abrogation and checkpoint kinase-1 targeting in the treatment of cancer[J].Br J Cancer, 2008, 98(3): 523-528.
[13]ARESSY B, DUCOMMUN B. Cell cycle control by the CDC25 phosphatases[J]. Anticancer Agents Med Chem, 2008, 8(8):818-842.
Cdc25C is involved in cell cycle G2/M arrest and apoptosis induced by siRNA targetingPARgene in human prostate cancer PC3 cells
XU Xiao-feng, ZHOU Xiu-min, DONG Jie, ZHANG Zheng-yu, GE Jing-ping, ZHOU Wen-quan,WEI Wu, CHENG Wen, WEI Zhi-feng, HOU Jian-quan,GAO Jian-ping(Department of Urology Surgery, Nanjing General Hospital of Nanjing Military Region,Nanjing Jiangsu 210002, China)
GAO Jian-ping E-mail:gao85680823@126.com
Background and purpose:The expression ofPARgene was higher in androgen-resistant prostate cancer (PCa) in comparison to androgen-sensitive PCa and may be involved in the cellular malignant transformation.This study was designed to investigate the effects of downregulatedPARexpression on the cell cycle of PC3 cells and to explore the role of Cdc25C in this process.Methods:Suppression ofPARexpression was achieved by transfection of PC3 cells with small interfering RNA (siRNA) target against PAR. Phase distribution of cell cycle was analyzed by fl ow cytometry. Western blot was performed to investigate the expression of Cdc25C.Results:The expression of PAR was suppressed by siRNA. Flow cytometry revealed a cell cycle G2/M arrest and induction of apoptosis. Western blot showed the expression of Cdc25C decreased afterPARexpression downregulated.Conclusion:Downregulated PAR expression inhibits the expression of Cdc25C and thus is involved in the G2/M arrest and apoptosis of PC3 cells.
PARgene; Prostate cancer; Cell cycle; Cdc25C
10.3969/j.issn.1007-3969.2012.01.001
R737.25
A
1007-3639(2012)01-0001-04
国家自然科学基金青年科学基金项目(No:30901716);南京军区南京总医院医药卫生科研基金项目(No:2009Q023)。
高建平 E-mail:gao85680823@126.com
2011-08-03
2011-11-07)
