乳腺叶状肿瘤的高频超声声像图分析
2012-05-17骆洪浩彭玉兰赵海娜
骆洪浩 彭玉兰 于 雷 赵海娜 史 岩
乳腺叶状肿瘤(phyllodes tumors of breast,PTB)是一种来源于纤维上皮的肿瘤,在临床上较为少见,据数据统计约占乳腺肿瘤的0.3%~1.0%[1-2],在超声声像图上的表现与纤维腺瘤极其相似,故超声的术前正确诊断率低,仅有21.3%[3]。肿瘤组织主要成分有两种,即上皮和间质纤维,病理改变上也不易与纤维腺瘤区分。约90%的乳腺叶状肿瘤具有良性过程,较少发生转移,易复发是其一个特点,患者年龄较大者较年轻患者复发率低[4]。叶状肿瘤复发的主要原因与病变切除是否彻底有关,复发率约15%~27%,恶性叶状肿瘤还可发生远处转移,约占恶性叶状肿瘤的10%~30%[5-8],因此术前乳腺叶状肿瘤的诊断和其他乳腺病变的鉴别诊断较为重要。本研究回顾性分析乳腺叶状肿瘤的超声声像图特征,以提高对本病的认识。
方 法
1. 临床资料
本院2004年12月至2011年4月经手术和病理证实为乳腺叶状肿瘤的149例患者纳入研究,均为女性,年龄11~76岁,平均(40.11±11.77)岁,以41~50岁多见(占41.6%)。良性叶状肿瘤96例(64.4%),交界性叶状肿瘤35例(23.5%),恶性叶状肿瘤18例(12.1%)。78例首诊时扪及乳腺肿块,病史1个月~7年不等,其中5例有“纤维腺瘤”手术史。
2. 仪器与方法
使用 Philips HDI5000及IU22彩色多普勒超声诊断仪,设置检查条件为乳腺,探头频率为5~12MHz。患者常规仰卧位,两臂上举置于头顶,充分暴露乳房和腋窝,在病变区做多切面扫查,观察肿块的大小、形状、边界、内部回声等,同时探测腋窝有无异常肿大淋巴结回声。应用彩色多普勒血流成像(color Doppler flow imaging,CDFI)观察肿块血供情况, 参照Adler半定量方法[9],将血流丰富程度分为4级:0级,肿块内未见血流信号;I级,少量血流,可见1~2处点状血流或短棒状血流;II级,中等血流,可见3~4处点状血流或一条管壁清晰的血管;Ⅲ级,丰富血流,可见4处以上点状血流或2条以上管壁清晰的血管。应用频谱多普勒观察血流频谱情况,记录最大血流速度(Vmax)及阻力指数(resistance index,RI),校正角度≤60°。
3. 统计学处理
结 果
1.高频超声声像图表现及诊断
肿块149个,大小1~20cm不等,122例可见完整或部分包膜回声,91例呈分叶或浅分叶状,81例团块内部回声不均匀,1例可见同侧腋窝淋巴结长大,7例乳腺后间隙消失,15例可见钙化(12例砂砾样钙化,3例粗大钙化),38例内部及周边可见不规则无回声区(良性20例,交界性13例,恶性5例)。
术前高频超声检查诊断叶状肿瘤30例(20.1%)、纤维腺瘤48例(32.2%)、乳腺癌9例(6%)、导管内肿瘤1例(0.7%)以及未定性61例(40.9%),诊断准确率仅20.1%。
2. 不同病理类型间声像图差异
2.1 肿瘤大小:良性组肿块明显小于交界性组及恶性组(P<0.05),而交界性组与恶性组之间没有显著性差异(P>0.05)。将交界性及恶性叶状肿瘤合并为一类,与良性叶状肿瘤进行ROC曲线分析(图1),显示曲线下面积为0.694,当肿瘤大小以3.3cm为分界值时,敏感度为76.9%,特异度为58.3%(图2)。
2.2 CDFI:CDFI血流信号分为4级,0级47例(良性36例,交界性8例,恶性4例),Ⅰ级54例(良性39例,交界性6例,恶性6例),Ⅱ级41例(良性21例,交界性20例,恶性1例),Ⅲ级7例(良性0例,交界性1例,恶性7例)。0~Ⅰ级血流中,良性75例,交界性和恶性共24例,显著少于良性(P<0.05);Ⅱ~Ⅲ级血流中,良性21例,交界性和恶性29例,两者未见显著性差异,总体上,良性和非良性的血流分级构成有显著性差异。
所有肿块可测得的血流速度Vmax:6.56~45cm/s,RI:0.56~1.0,其中仅有15例阻力指数RI超过0.70,其余肿块内阻力指数RI均小于0.70。

图1 良性叶状肿瘤、交界性及恶性叶状肿瘤的ROC曲线。 图2 良性、交界性及恶性的箱形图。

图3 良性叶状肿瘤。周边可见包膜回声,后方回声无改变。图4 良性叶状肿瘤。肿块可见1~2处点状血流信号,Ⅰ级。
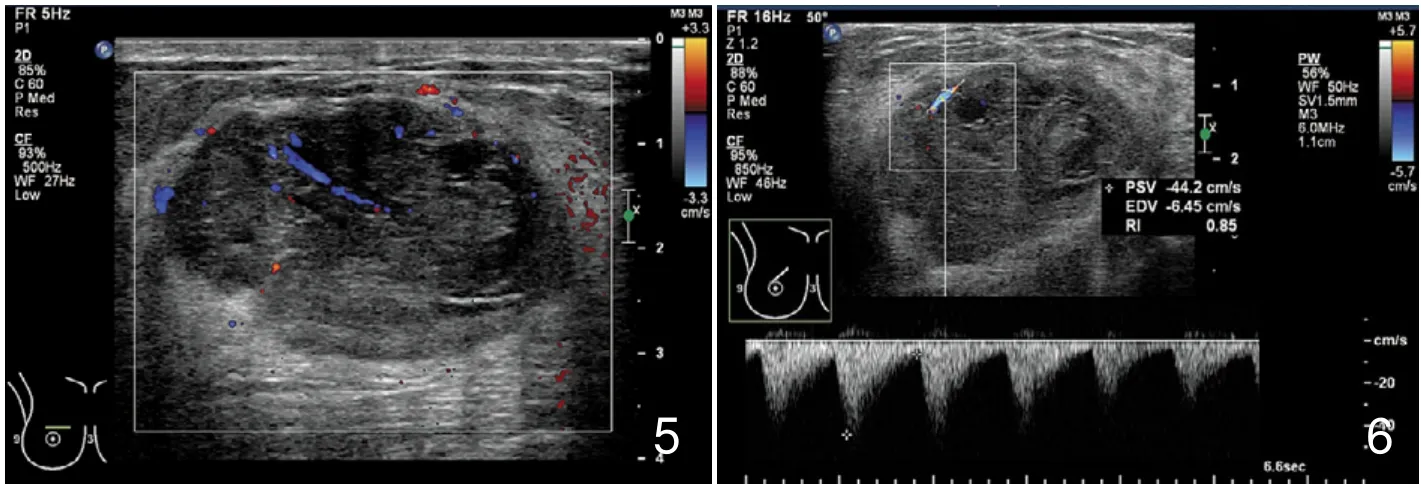
图5 交界性叶状肿瘤。包膜不完整,内可见不规则的液性暗区肿块可见条血流信号及点状血流信号,Ⅱ级。 图6 交界性叶状肿瘤。血流频谱示Vmax=44.2cm/s,RI=0.85。

图7 恶性叶状肿瘤。肿块体积大,无包膜回声,边界不清楚,浸润皮肤和皮下组织,后间隙显示不清,肿块内可见条状血流,内及周边有不规则网状液性暗区,血流Ⅱ级。图8 恶性叶状肿瘤。明显分叶状,周边可见暗区,Vmax=35.0cm/s,RI=0.85。
讨 论
乳腺叶状肿瘤是一种来源于纤维上皮性的肿瘤,病因不清,多数认为与雌激素分泌和代谢紊乱有关,大部分发生于中年妇女,本组好发年龄是41~50岁(62/149例,占41.6%)。本病曾用命名有假性肉瘤样腺瘤、乳腺混合瘤、假性肉瘤、叶状囊肉瘤等,2003年WHO乳腺肿瘤组织分类[10]将其定义为:一种类似于纤维腺瘤的局限性双相分化肿瘤,其特征为由两层上皮构成的裂隙及周围分布丰富的间质细胞共同形成的叶状结构,病理上分为良性、交界性和恶性三个亚型,其所占比例分别为60%、20%、20%。本组三个亚型分别为64.4%、23.5%和12.1%。乳腺原发性肿瘤中叶状肿瘤占有的比例为0.3%~1%,在所有乳腺纤维上皮性肿瘤中占2%~3%[11],发病年龄集中于40~50岁的中年妇女,比纤维腺瘤患者大10~20岁。临床首诊常以触及乳房肿块为主,无痛,肿块质中或偏硬,可推动,肿块常短期内迅速增大。肿块较大者,乳腺表面皮肤变薄、发亮,可见静脉曲张,供血障碍者乳腺表皮可发生破溃,但皮肤一般不受累,腋窝淋巴结转移罕见。本组无1例腋窝淋巴结转移,仅1例有腋窝淋巴结肿大,病理证实为淋巴结反应性增生。
叶状肿瘤大多数边界清楚,可见包膜样回声,但并非真正的包膜,而是因肿块呈膨胀性生长,压迫周围组织所构成的假包膜,部分交界性及恶性叶状肿瘤可呈浸润性生长出现边界模糊不清、毛刺状等。良性叶状肿瘤(图3,4)大多数边界清楚,周围可见假包膜形成,一般都可见分叶或浅分叶状,血流多数在0~Ⅰ级,钙化少见,较大者由于肿块压迫可以致后间隙消失;交界性(图5,6)及恶性叶状肿瘤(图7,8)边界清楚或不清楚,周围可见部分包膜形成,也可呈浸润性生长,分叶状明显,部分恶性叶状肿瘤可见成角,血流多数在Ⅱ级以上;钙化对于诊断叶状肿瘤没有特异性,虽然裂隙样及囊状液化对诊断PTB有重要价值,特异性较高,但是敏感性不高,本组肿块液化38/149例(25.5%),肿块内有无液化对于鉴别叶状肿瘤的良恶性没有明显的关联,但是对于与纤维腺瘤的鉴别有诊断意义[12]。
本研究发现,单从叶状肿瘤来说,交界性及恶性叶状肿瘤肿块大于良性叶状肿瘤(P<0.05),但ROC曲线下面积较小,仅0.694,对于区分良性与交界性及恶性叶状肿瘤诊断性一般,分析箱形图可知,良性与交界性及恶性叶状肿瘤大小有明显差异,但是重叠交叉部分也多,可能是造成ROC曲线下面积小,是诊断敏感性及特异性降低的主要原因,另一个原因是良性与交界性及恶性叶状肿瘤病例数分布不均,待将来收集更多病例进一步检验。
本研究表明,叶状肿瘤容易误诊为纤维腺瘤,本组误诊率为32.2%,还有40.9%的肿块难以定性,是超声诊断率低的一个原因,同时本病较为少见,认识不足,也较易引起误诊。重点可从以下几个方面进行鉴别诊断。
(1)叶状肿瘤与纤维腺瘤鉴别:纤维腺瘤发病年龄多较年轻,常见于30岁以下的年轻女性。瘤体体积较小,一般<5cm,生长速度也较慢,常呈圆形或椭圆形;而叶状肿瘤多发生于中年妇女,肿块多为单发,肿块常迅速长大,常为分叶状,内部回声可不均匀,有裂隙样及囊性暗区高度提示此病可能。
(2)叶状肿瘤与乳腺癌鉴别: 叶状肿瘤常呈膨胀性生长,体积较大时可使局部皮肤发红、水肿、溃烂,应与晚期乳腺癌相鉴别。乳腺癌常呈不规则生长,肿块常可见强回声晕、毛刺状、蟹足样以及微钙化等,病程更短,可使乳头内陷、皮肤呈橘皮样改变、腋窝淋巴结转移较常见。叶状肿瘤大多呈膨胀性生长,很少呈浸润性生长,当瘤体较大时,局部皮肤受压变薄,周围组织受压可见假包膜,腋窝淋巴结转移罕见。
(3)叶状肿瘤与导管内肿瘤鉴别:乳腺导管内乳头状瘤是常见的良性乳腺疾病,多见于40~50岁女性,为乳管内发生的乳头状新生物,当表现为囊实混合型团块时需要与叶状肿瘤鉴别,导管内乳头状瘤常有乳头溢液或溢血,肿块较小,肿块内液性暗区常位于实性成分周边,而叶状肿瘤常位于实性成分内。
由于叶状肿瘤术后较易复发,因此早期诊断、早期根除治疗很重要,临床上术前诊断困难,超声在术前诊断中误诊率也较高,但是超声声像图上还是有一些特征性改变,叶状肿瘤的肿块常呈分叶状,瘤体内可见裂隙样及囊性暗区,肿块一般不侵犯皮肤、皮下组织,恶性叶状肿瘤虽然不具有其他乳腺恶性肿瘤的常见特征,但是对于超声提示叶状肿瘤病变体积较大者、肿块内血供丰富、阻力指数偏高者可倾向于恶性。虽然叶状肿瘤在临床不常见,但是加深对该病的超声影像学认识可以减低超声误诊率。
1. Palmer M L, De Risi DC, Pehkan A, et a1. Treatment options and recurrence potential for cystosareoma phyllodes. Surg Gyneeul Obstet, 1990, 170: 193-196.
2. Bowell MD, Perry RR, Hsiu JG, et a1. Phyllodes tumors. Am J Slug,1993,165:376-379.
3. Meneses A, Mohar A, Dela Garza-Salazar J, et al. Prognostic factors on 45 cases of phyllodes tumors. J Exp Clin Cancer Res, 2000, 19;69-73.
4. Belkacemi Y, Bousquet G, Marsiglia H, et a1. Phyllodes tumor of the breast. Int J Radiat Oncol Biol Phys, 2008, 70: 492-500.
5. Liberm an L, Bonaccio E, Hamele-Bena D, et a1. Benign and Malignant Phyllodes Tumors: Mammographic and Sonographic Findings. Radiology. 1996, 198: 12l-124.
6. Pietruszka M,Barnes L. Cystosareoma phyllodes: a cinicopathologic analysis of 42 cases. Cancer, 1978, 41: 1974-1983.
7. Alam I, Awad ZT, Given HF. Cystosarcoma phyllodes of the breast: a clinicopathological study of ll cases. Ir Med J, 2003, 96: 179-180.
8. Feder JM, de Paredes ES, Hogge JP, et a1. Unusual breast lesions:radiologic-pat hologic correlation. Radio Graphic, 1999, 19: l 1-26.
9. Adler DD,Carson PL, Rabin JM, et a1. Doppler ultrasound color flow imaging in the study of breast cancer: preliminary findings.Ultrasound Med Biol, 1990, 16: 553-559.
10. Tavassli FA, Devilee P. WHO Classification of tumours. Pathology &Genetics, Tumours of the Breast and Female Genital Organs, Lyon:IARC Presss, 2003.
11. Rosen PP, Oberman HA. Cysmsareoma phyllodes. Rosai J, Sobin LH.Atlas of tumor pathology: tumors of the mammary gland, fasc7, ser3.Washington, DC; Armed Forces Institute of Pathology, 1993: 107-114.
12. 游珊珊,姜玉新,刘 赫,等. 乳腺叶状肿瘤的超声诊断. 协和医学杂志,2010, 1:66-71.
