抗菌医用导尿管的抗感染性能测试
2012-05-15魏丽乔陈晓丽许并社
张 利,刘 春,魏丽乔,陈晓丽,许并社
(1.太原理工大学 新材料界面科学与工程教育部重点实验室,材料科学与工程学院,太原030024;2.山西医科大学,太原030001)
随着现代医疗技术的发展,医用体内植入物已广泛应用,且范围日渐扩大,大大提高了医疗水平。导尿管使用相当普遍,大约25%的住院病人需要留置导尿管,同时又有相当一部分病人需长期留置导尿管[1]。
留置导尿管所发生的导尿管相关性尿路感染(CAUTIs)是一种常见的医院内感染。导尿管相关性尿路感染约占医院内感染的40%[2-3],其发生率稍低于呼吸道感染的医源性感染[4]。留置导尿管的病人中有30%的病人因导尿管相关性尿路感染而出现泌尿生殖系统或全身症状,有4%的患者发生菌血症,死亡率可高达30%,严重影响患者的生活质量和生命安全[5]。
然而,以往对于导尿管抗菌性能的研究并不理想[6]。本研究旨在制备新型抗感染导尿管,使其具有较强的抗菌性能,且作用持久,合成工艺简单,具有较强的临床实用价值。
1 材料和方法
1.1 抗菌导尿管的制备
以自制O-羧甲基壳聚糖-纳米银复合抗菌剂为有效抗菌成分,将复合抗菌剂与天然胶乳共混制备抗菌天然胶乳。将导尿管置50℃蒸馏水中浸泡10 min,清洗,用400目的砂纸打磨,用去离子水和无水乙醇清洗,室温晾干。将处理好的导尿管置于制备的共混型抗菌胶乳中浸泡5min,慢慢提拉出,间隔2min,重复浸渍提拉2~3次。室温晾干,得到具有均匀抗菌胶乳涂层的导尿管[7]。
1.2 抑菌环试验
选取大肠杆菌(ATCC11229)和金黄色葡萄球菌(ATCC6538)(由山西医科大学微免教研室提供),依照卫生部《消毒技术规范》2.1.8.2抑菌环试验方法,对样品进行抗(抑)菌试验。
在琼脂培养基培养皿上打孔,直径约0.6cm,去掉琼脂。用接种针将105个/mL营养肉汤大肠杆菌和金黄色葡萄球菌菌悬液分别均匀地涂到培养基上,再把长1cm的抗菌导管直立于琼脂培养基的孔腔中,同时用普通导管(青岛世运医疗器械)做对照。将培养皿置于37℃恒温培养箱培养24h,测量抑菌圈直径。
将制备的导尿管剪成1cm长的小段,浸泡于尿液中,置于37℃恒温箱内,每天更换尿液,于放置后1,3,7,14,21,28d,分别进行抑菌环试验,测定其对大肠杆菌和金黄色葡萄球菌的抗菌性能。
1.3 动物实验
实验动物采用雄性家兔40只,月龄3~4月,体重2.0~3.5kg,由山西医科大学动物中心提供。根据留置导尿管的不同时间,将家兔按照随机分为1周组、2周组、3周组、4周组,每组雄性家兔各10只;将每组随机分为抗菌导尿管组和普通导尿管组,每组各5只。
按0.1mL/kg剂量肌注速眠新Ⅱ注射液,麻醉家兔,消毒尿道外口;插管;在家兔尿道外口导尿管两侧行“U”字缝合,缝线贯穿导尿管壁,进行固定;每日对家兔尿道外口消毒2次;留置导尿管,分别于第1周、第2周、第3周和第4周采血2mL,进行酶联免疫吸附(ELISA)实验;之后以空气栓塞法处死实验动物,完整剥离尿道,用体积分数为4%中性甲醛溶液固定。进行苏木素-伊红(HE)染色实验。
1.4 HE染色
常规石蜡切片,进行HE染色,观察炎性细胞浸润情况。光镜下观察尿道组织病理切片。镜下可见:尿道黏膜上皮细胞排列规整,胞核呈深蓝色,胞浆及纤维组织显示为淡红色;中性粒细胞核呈杆状或分叶;单核细胞体积较大,胞浆丰富,呈蓝色,细胞大小不一;淋巴细胞胞核很大,圆形蓝染,胞质极少;浆细胞较小,核偏于细胞一侧,呈圆形,染色质粗,沿核膜排列成车轮状,胞质蓝染。
1.5 ELISA
采用ELISA法检测血液中的肿瘤坏死因子α(TNF-α)和白介素10(IL-10)(北京博奥森)的含量。按试剂盒说明书操作,酶标仪(ELX800,美国宝特)读值,波长450nm。
1.6 统计学处理
数据采用均值标准差(¯x±s)表示,并进行设计方差分析和t检验,认为P<0.05有显著性差异。
2 结果与讨论
2.1 体外抗菌性能
从体外抑菌环试验可见,制备的抗菌导尿管对大肠杆菌和金黄色葡萄球菌具有较好的抗菌性能,而且对金黄色葡萄球菌的抗菌性能优于大肠杆菌,而普通导尿管则未见抗菌性能。见图1表1所示。

表1 抗菌导尿管和普通导尿管体外

抗菌作用的比较(n=20)
从体外抗菌持续时间观察可以看出,抗菌导尿管对大肠杆菌和金黄色葡萄球菌产生抗菌作用,到4周时仍能保持一定的抗菌能力。但随着时间的推移,抗菌作用逐渐减弱。这可能和抗菌材料在尿液中逐渐消耗有关(见表2)。
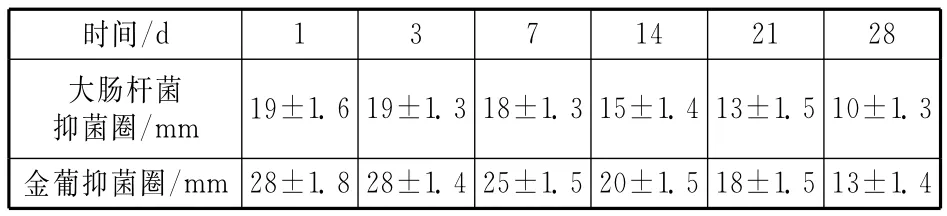
表2 抗菌导管不同时间的抗菌性能(n=5)
2.2 尿道黏膜HE染色
留置导尿管1周时,抗菌导尿管组尿路上皮细胞达3~5层,排列整齐,间质内血管扩张、充血,可见个别淋巴细胞浸润;普通导尿管组尿路上皮细胞2~3层,排列整齐,间质内可见较多慢性炎细胞浸润(见图2)。
留置导尿管2周时,抗菌导尿管组尿路上皮细胞达3~5层,排列整齐,间质内可见少量的以浆细胞为主的炎细胞浸润;普通导尿管组尿路上皮细胞达1~3层,排列整齐,间质内可见多量慢性炎细胞浸润,少量炎症细胞向上侵入到尿路上皮底层(见图3)。
留置导尿管3周时,抗菌导尿管组尿路上皮细胞达3~5层,排列较整齐,间质内可见少量以淋巴细胞、浆细胞为主的炎细胞浸润。普通导尿管组尿路上皮细胞达3~5层,排列较整齐,间质内可见较多量慢性炎细胞浸润(见图4)。
留置导尿管4周时,抗菌导尿管组尿路上皮细胞达3~5层,排列较整齐,间质内可见较多的慢性炎细胞浸润。普通导尿管组尿路上皮细胞达5~8层,排列齐性较差,间质内可见大量以淋巴细胞、浆细胞为主的慢性炎细胞浸润,少数炎症细胞向上侵入尿路上皮中表层(见图5)。

2.3 留置导尿管不同时间点兔血清IL-10和TNF-α的变化
随着时间的推移,两组家兔尿道黏膜IL-10表达的密度值均逐渐降低(P<0.01);不同时间段内,抗菌导管组IL-10的表达均高于对照组(P<0.01)。抗菌导尿管组在第4周时的表达与普通导尿管组第1周的表达差异无统计学意义(P>0.05)。如图6所示。

图6 留置导尿管不同时间点兔血清IL-10的变化
随着时间的推移,两组家兔血清TNF-α表达的密度值均逐渐升高(P<0.01);不同时间段内,抗菌导管组IL-10的表达均低于对照组(P<0.01)。抗菌导尿管组在第4周时的表达与普通导尿管组第1周的表达差异无统计学意义(P>0.05)。如图7所示。

图7 留置导尿管不同时间点兔血清TNF-α的变化
2.4 留置导尿管引起的相关性炎症
留置导尿管打破了机体正常的免疫机制[8]。尿道通常可以作为一种防御微生物入侵的屏障,正常情况下,机体能够阻止或最小化细菌和上皮细胞的相互作用。当微生物进入尿道,约99.9%可以通过尿液而排出,残余的部分被多核白细胞和膀胱黏膜的抗菌性能破坏分解。导尿管妨碍了微生物的有效清除,从而诱发了感染。任何一种导尿管都增加了导尿管相关性尿路感染的机会,增加了发生菌尿症的危险性。留置导尿管的病人在留置期间细菌会进入尿道,会促使导尿管和尿道黏膜之间形成一层生物膜,这为外界细菌入侵和繁殖提供了良好的环境。本研究自制的抗菌导尿管在第4周时,仍具有抗菌性,有效地延缓了细菌生物膜的形成。
炎症反应是临床常见的一个病理过程,是指具有血管系统的活体组织对损伤因子的防御反应。发生炎症反应的重要原因,可能是某些因素打破了抗炎症反应的细胞因子和促炎症发生的细胞因子之间的平衡。前者主要包括IL-10和IL-6,由活化的T细胞分泌,可以抑制炎症反应的发生;后者主要包括TNF-α和IL-8等,由活化的巨噬细胞分泌,可以促进炎症反应的发生[9-10]。
留置导尿管后,炎症反应就逐渐地启动,炎症在始动因素的作用下产生细胞因子,一方面由活化的巨噬细胞分泌TNF-α等促炎症细胞因子,它可以引起血管内皮细胞和白细胞的黏附,趋化白细胞向炎症部位聚集,有利于炎性细胞杀伤病源微生物,诱发炎症反应,导致组织损伤。另一方面分泌抗炎性细胞因子IL-10等,它在免疫抑制和内毒素的耐受中起重要作用,抑制活化的巨噬细胞分泌促炎性细胞因子如TNF-α和IL-8等,它可以抑制炎症反应的发展,促进组织修复和再生,较促炎性细胞因子反应延迟[10-12]。
研究结果显示,家兔在留置导尿管不同时间(分别为1周、2周、3周、4周)内,血清IL-10的表达不同,随着时间的改变,其数值逐渐降低,表明抗炎症反应的能力逐渐下降。但各时间段内,抗菌导尿管组的IL-10仍高于普通导尿管组,持续4周时,仍具有一定的抗炎症反应的能力(P<0.05)。IL-10的升高有助于机体修复炎症反应。
家兔在留置导尿管不同时间(分别为1周、2周、3周、4周)内,血清TNF-α的表达不同,随着时间的改变,其数值逐渐升高,表明炎症反应越来越明显。但各时间段内,抗菌导尿管组的TNF-α均低于普通导尿管组,持续4周时,仍较普通导尿管组低,说明炎症反应的强度较低,经统计学分析均具有统计学意义。
尿道黏膜中的抗炎因子IL-10和促炎症因子TNF-α,也显示同样的变化趋势,说明了炎症反应的轻重程度。在导尿管相关性尿路感染中,抗菌导尿管发挥着重要的作用,且抗菌作用较为持久,在留置4周时,仍具有一定的抗菌效果,远远超出普通导尿管的抗菌性能。
3 结论
本研究采用自制的抗菌胶乳涂层制备的抗菌导尿管具有良好的抗菌性能,对大肠杆菌和金黄色葡萄球菌均具有较强的抗菌能力,且抗菌性能持久。在动物实验中,抗菌导尿管组显示了良好的感染性能,与普通导尿管组相比,炎症反应轻微。无论在体外实验还是在动物实验中,抗菌导尿管在第4周时仍持有较好的抗菌性能。
[1] Patel HRH,Arya M.The urinary catheter:‘a voiding catastrophe’[J].Hosp Med,2000,62(3):148-149.
[2] Bologna RA,Tu LM,Polansky M,et al.Hydrogel/silver ion-coated urinary catheter reduces nosocomial urinary tract infection rates in intensive care unit patients:a multicenter study[J].Urology,1999,54(6):982-987.
[3] Trautner BW,Darouiche RO.Role of biofilm in catheter-associated urinary tract infection[J].Am J Infect Control,2004,32(3):177-183.
[4] Sedor J,Mulholland S G.Hospital-acquired urinary tract infections associated with the indwelling catheter[J].Urol Clin North Am,1999,26(4):821-828.
[5] Bryan CS,Reynolds KL.Hospital acquired bacteraemic urinary tract infection:epidemiology and outcome[J].J Urol,1984,132:494-498.
[6] Zhou NL,Liu Y,Li L,et al.A new nanocomposite biomedical material of polymer/Clay-Cts-Ag nanocomposites[J].Current Applied Physics,2007,7(1):e58-e62.
[7] 刘常胜,张利,王倩,等.液相还原法制备抗菌天然胶乳材料[J].太原理工大学学报,2001,42(s1):70-73.
[8] Warren JW.Urethral catheter,condom catheters and nosocomial urinary tract infections[J].Infect Control Hosp Epidemiol.1996,17(4):212-214.
[9] Guo H,Xu YM,Ye ZC,et al.Heat-shock protein70expression in the seminal plasma of patients with chronic bacterial prostatitis and chronic prostatitis/chronic pelvic pain syndrome[J].J Prostate Cancer Prostatic Dis,2010,13(4):338-342.
[10] Ding XG,Li SW,Zheng XM,et al.IFN-γand TGF-β1levels in Expressed prostate secretion of chronic abacterial prostatitis[J].Chin J Urol,2006,27(sppl2):73-75.
[11] Xie GQ,Jiang JX,Chen YH,et a1.Induction of acute hepatic injury by endotoxin in mice[J].Hepatobiliary Pancreat Dis Int,2002,1(4):558.
[12] Shannon E,Noveck R,Sandoval F,et al.Thalidomide suppressed IL1beta while enhancing TNF-alpha and IL-10,when cells in whole blood were stimulated with lipopolysaccharide[J].Immunopharmacol Immunotoxicol,2008,30(3):447-457.
[13] Stenvinkel P,Ketteler M,Johnson R J,et a1.IL-10,IL-6,and TNF-alpha:central factors in the altered cytokine network of uremia-the good,the bad,and the ugly[J].Kidney Int,2005,67(4):1216-1233.
