苜蓿假盘菌分离方法及培养性状比较研究
2012-05-13张君艳陈本建
张君艳,陈本建
(1.甘肃林业职业技术学院,甘肃 天水 741020;2.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
苜蓿假盘菌(Pseudopeziza medicaginis)是一种寄生性较强的病原菌,属于子囊菌亚门假盘菌属,可引发紫花苜蓿、三叶草、草木樨等多种豆科植物发生褐斑病[1],发病严重时,大量叶片从植株下部脱落,落叶率达50%以上,严重影响病株光合产物的积累,削弱生活力,影响抗逆性和越冬能力[2]。在新疆,苜蓿种植历史久,面积大,在农牧业生产中有相当重要的地位[3],但品质和产量同样受到苜蓿假盘菌的威胁。袁庆华等[4]对北京菌株,王蓟花等[5]对宁夏菌株,史娟等[6]对宁夏菌株进行了苜蓿假盘菌生物学特性和适宜培养基等方面的研究。但是,据报道[1],该菌是一种易发生变异的真菌,且该病菌致病力在地理上存在分化现象。因此,新疆对南、北疆菌株的培养特性做了研究,旨在寻找二者的联系与区别,为以后的研究奠定基础。
1 材料和方法
1.1 供试材料
1.1.1 供试菌种 苜蓿假盘菌分离自新疆北疆(乌鲁木齐)和南疆(阿克苏)苜蓿褐斑病的标本,寄主为新疆大叶苜蓿(Medieago sativa)。
1.1.2 供试培养基 ①V-8培养基(V-8汁200mL,为美国进口V-8蔬菜汁过滤所得,下同;蒸馏水800 mL);②V-8苜蓿汁培养基(苜蓿汁800mL,取新鲜幼嫩健康的苜蓿叶片80g,清洗干净,加蒸馏水800mL煮15min,过滤后补足800mL,下同;V-8汁200 mL);③V-8碳酸钙培养基(V-8汁200mL,CaCO32g,蒸馏水800mL);④V-8碳酸钙苜蓿汁培养基(V-8汁200mL,CaCO32g,苜蓿汁800mL);①~④中分别加入琼脂17g,制备为固体培养基,调整pH值为5.5,在121℃下灭菌30min。
1.2 研究方法
1.2.1 病原菌分离方法 离心稀释分离法[4]:各自选取子囊盘成熟极好的病叶,用无菌水冲洗数次,再用75%酒精浸泡3min,随后用无菌水冲洗,再用解剖刀切成小块,装入离心管,加少量无菌水,将病组织捣碎,8 000r/min速度下再离心5min,去上清液,反复3次。将处理好的分离沉积物用少量无菌水稀释,用d=1.5mm毛细管吸取一定量的分离物,移到载玻片上的水琼脂上。在显微镜下用d=0.2mm玻璃针挑取成熟子囊盘,转入V-8碳酸钙琼脂培养基上,用封口膜将培养皿封好后放入20℃培养箱内培养30d。此外,室内要保持清洁,温度30℃。
叶面弹射法:挑选子囊盘成熟较好的叶片,用无菌水清洗干净后用0.1%升汞浸泡15s,再用无菌水反复清洗后保湿,叶面朝上平铺于培养皿顶盖中,并倒扣在V-8碳酸钙琼脂培养基上进行弹射,密闭,放入20℃培养箱内培养30d。
1.2.2 孢子悬浮液的制备 选取分离后在V-8碳酸钙琼脂培养基上生长30d的菌落,置于小烧杯中,加入无菌水2mL,用镊子将其充分捣碎,40倍光学显微镜下观察,有大量子囊和子囊孢子的即为孢子悬浮液(孢子浓度为3.0×105~1.5×106个/mL)。
1.2.3 培养基对菌落形态的影响 用移液枪吸取南疆菌株的孢子悬浮液(孢子浓度为3.0×105~1.5×106个/mL)0.5mL,接种于4种供试培养基上,20℃培养30d。随机确定要观察的菌落10个,分别在生长的第5、9、13、17、21d和第30d观察菌落颜色、质地、外部形态、个数、成熟度,并用游标卡尺测量菌落直径(精确到0.01mm),重复5次,由此计算菌落生长速度(菌落平均直径与生长天数的比值)和菌落成熟率(菌落正面白色绒状物褪去的个数与总个数的比值[4])。分离形成菌落所需时间是指取少量离心稀释法制备的菌液,置载玻片上,在显微镜下找到成熟子囊盘,并将其挑入培养基,从此时开始到长出肉眼可见的菌落为止所需天数,重复5次。
1.2.4 病原菌形态观察 将2种菌株的定量孢子悬浮液接种在V-8碳酸钙琼脂培养基上,菌落成熟之后,用d=1.5mm的毛细管挑取少量的子实体在40倍光学显微镜下随机观察10个子囊盘及子囊孢子的大小,重复5次。观察时先将目镜测微尺与镜台测微尺进行校准,再确定目镜测微尺的实际测量值[7]。
2 结果与分析
2.1 分离方法
利用离心稀释法,能够使苜蓿假盘菌在培养基上生长并形成菌落,而在叶片弹射法实验中,虽然观察到在病斑保湿24h之后就有孢子弹射和孢子萌发的情况,但最终未见菌落形成。
2.2 培养基对菌落形态的影响
相同培养条件下,南疆菌株在4种培养基上均能形成纯化菌落,但培养性状有明显不同(表1),首先,菌落颜色基本出现2种情况:1)褐色或黑褐色;2)灰白色,前者菌落数量较多,直径较大,生长速度较快,子囊盘成熟率也较好,分布较为疏松。其次,生长速度也存在一定差异,虽然均表现为前期较慢(10d之前),生长中期(第14~17d)为快速生长期,到后期(21~30d)趋于稳定,即在整个生长时期表现为慢-快-慢的生长趋势。但在V-8苜蓿汁培养基上的生长速度各个时期都相对最快(图1)。
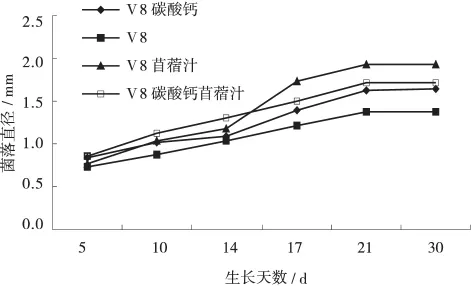
图1 南疆菌株在4种培养基上的生长曲线Fig.1 Growth curve of Nanjiang strains of Pseudopeziza medicaginisin four culture meadiums
综合生长速度、菌落量、子囊盘成熟率等各个因素,认为V-8苜蓿汁培养基的培养效果最好,它包含V-8汁和苜蓿煎汁两方面的营养,能够提供苜蓿假盘菌生长所需的养分。
2.3 不同菌株的菌落特征及病原菌形态
不同地理源的菌株在相同培养基上,菌落外观表现有一定差别(表2和图2A1、B1),表现在分离形成菌落所需时间上具有明显的差异,南疆菌株最快需要12d,而北疆菌株则需要16d,但平均生长速度之间二者不存在显著差异,都在0.05mm/d以下。
不同菌株病原菌的培养特征也有一定差别(表2和图2A2、B2),主要表现在子囊盘大小之间,南疆菌株子囊盘模糊,有趋于脱落的现象,但孢子数量相对较多;北疆菌株有时会出现只有子囊盘,而没有子囊孢子的现象,但子囊孢子大小之间二者并不存在显著差异。
3 讨论与结论
(1)在分离实验中得到,离心稀释法为苜蓿假盘菌较适宜的分离方法,而史娟等[5]的结果表明常规组织块分离法是最适宜的分离方法。这可能是由于供试菌株成熟度不一致所致,经笔者仔细观察,发现只有在苜蓿褐斑病发病叶片上病斑突起程度好(用手触摸能感觉到明显的突起),色泽呈黑褐色时,子囊盘成熟较好,才能用常规的组织块分离,否则只能用离心稀释法。

表1 苜蓿假盘菌南疆菌株在4种培养基上的特征Table 1 Characters of Nanjiang Strains of Pseudopeziza medicaginis in four culture meadiums
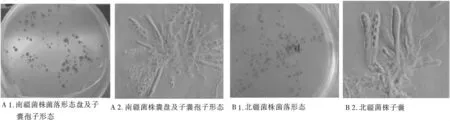
图2 南疆、北疆菌株培养后期的菌落形态、子囊盘及子囊孢子Fig.2 Colonial morphology,apothecium and ascospone of Nanjiang Strains and Beijiang Strains of Pseudopeziza medicaginis at the later culturing stage

表2 南疆和北疆菌株菌落颜色变化、生长速度、子囊盘及子囊孢子的对比Table 2 Comparision on the colony color changes,growth speed,apothecium and ascospone of Nanjiang Strains and Beijiang Strains of Pseudopeziza medicaginis
(2)在培养基对菌落形态影响实验中得到,V-8苜蓿汁培养基最适合菌落的生长和繁殖。分析认为苜蓿假盘菌既然能在苜蓿活体枝条上生长,那么苜蓿汁提供的营养对于假盘菌培养则是相当必要的。史娟等[5]研究发现苜蓿假盘菌最适宜生长在番茄培养基和V-8碳酸钙培养基上。袁庆华[3]也发现苜蓿假盘菌适宜生长和繁殖的培养基为V-8碳酸钙培养基,而本实验则是以前人的研究结论为基础,将已筛选出的适宜培养基做相应的改变(其中番茄汁由进口V-8蔬菜汁的过滤汁液代替),配合苜蓿汁液得出4种培养基,分别是V-8碳酸钙、V-8碳酸钙苜蓿汁、V-8苜蓿汁和 V-8培养基,再接种南疆菌株得出以上结论,所以V-8苜蓿汁培养基更适合苜蓿假盘菌南疆菌株的生长和繁殖,并且V-8蔬菜汁也价格便宜,使用方便,成本相对较低。
(3)不同地理来源的南、北疆菌株,菌落外观(颜色、大小等)不同,首先表现在分离形成菌落的时间上,并且,分离的菌落成熟后(分离培养30d),自动在其周围弹射出子囊孢子,然后再形成肉眼可见新菌落,但形成时间也同样存在明显不同,南疆菌株(平均培养45 d)明显快于北疆菌株(平均培养55d),这可能和不同来源菌株侵染寄主能力的强弱有关。苜蓿假盘菌的侵染能力的研究国内外较少,针对不同来源的菌株对寄主侵染能力的研究还没能深入,以后有待加强。其次,二者子囊盘大小上存在一定差异,可能与菌落(病斑)成熟度有关,成熟度越好,子囊盘越大。而子囊盘成熟度和寄主所处的环境条件(温度、湿度、光照等)有关,和地理位置之间应该没有必然的联系。并且不同来源的菌株子囊盘大小之间存在的差异不会体现在子囊孢子的大小上。
(4)北疆菌株有时会出现有子囊盘,但没有子囊孢子的现象,可能是这一菌株处于其无性时代,但依然没有足够的证据说明,而前人研究表明[5,8],该菌自然条件下未见无性态,培养条件下产生大量分生孢子结构,但该结构并不侵染寄主,关于苜蓿假盘菌无性世代说法,以及无性时代的存在与侵染能力、致病能力等方面有无必然联系,有待进一步的研究。
(5)苜蓿褐斑病对苜蓿产量的影响不亚于虫害[9]、水分、养分[10]等对其产量[11]的威胁,所以深入研究褐斑病致病菌的生物学特性和培养性状对苜蓿抗病育种有很大的贡献。在对苜蓿假盘菌的认识过程中,以后还需在不同来源菌株致病能力研究、人工培养条件下假盘菌致病能力分化、菌株营养体亲和性等方面做更深入研究,以便更好的预防和治理。
[1] 袁庆华,马鸿文,徐秉良.苜蓿假盘菌致病力分化研究[J].草地学报,2007,15(4):312-315.
[2] 侯天爵,白儒,王建峰.不同苜蓿品种对褐斑病抗性的研究[J].中国草原,1986(4):44-45.
[3] 苏生昌,王雪薇.苜蓿褐斑病在新疆的发生[J].草业科学,1997,14(5):31-33.
[4] 袁庆华,李向林,张文淑.苜蓿假盘菌及其生物学特性研究[J].植物保护,2001,27(1):8-11.
[5] 王蓟花,史娟.不同培养基上苜蓿假盘菌生长状况及形态学研究[J].农业科学研究,2007,28(1):15-17.
[6] 史娟,贺达汉,王蓟华.不同培养条件下苜蓿假盘菌培养特性及分离方法研究[J].西北农业学报,2007,16(3):260-263.
[7] 方中达.植病研究方法(第三版)[M].北京:中国农业出版社,1998,12.
[8] 刘若.草原保护学[M].北京:中国农业出版社,1984,1-288.
[9] 王国利,刘长仲,王秀芳.甘肃省苜蓿害虫种类调查[J].草原与草坪,2011(6):18-21.
[10] 王田涛,师尚礼,张恩和.灌溉与施氮对紫花苜蓿土壤水分动态和耗水强度的影响[J].草原与草坪,2011(1):41-44.
[11] 张小燕,马晖玲,马政生.喷施聚天门冬氨酸对不同品种紫花苜蓿产量及品质的影响[J].草原与草坪,2010(6):34-37.
