幼龄期游泳运动对大鼠成年后体成分和脂肪组织相关基因表达的长期影响
2012-05-12焦广发高峰李秀楠邓晓茜张海峰何玉秀
焦广发 高峰 李秀楠 邓晓茜 张海峰 何玉秀
1河北体育学院(河北 石家庄 050041) 2河北师范大学体育学院
婴幼儿时期是生长发育的关键时期,外界营养因素可以对机体能量代谢的调节活动产生程序化的作用。 1998 年,Lucas[1]提出“营养程序化(nutritional programming)”,即发育关键期或敏感期的营养状况将对机体各器官功能产生长期甚至终生的影响。Waterland[2]认为程序化的主要机制可能是通过早期营养诱导器官结构的改变和细胞数目的改变。研究发现,幼儿6岁开始脂肪迅速积累,使该时期的脂肪细胞数量增加与其成年后体成分的变化密切相关[3]。脂肪组织瘦素(Leptin)和肿瘤坏死因子(TNF-α)等细胞因子以及过氧化物增殖因子激活的受体(PPAR-γ)控制着脂肪细胞的能量代谢状态和增殖分化状态。Leptin与其他外周激素作为信号物质参与机体能量平衡机制的调控,影响程序化的形成[4]。本实验通过观察大鼠生长发育关键时期(3周断乳幼龄期)进行运动干预对其体内脂肪含量产生的长期效应,分析脂肪组织相关基因改变在其中的生物学作用。
1 材料与方法
1.1 实验动物与分组
10周龄清洁级SD纯系大鼠购自河北省动物实验中心,生产许可证编号SCXK冀2008-1-003。实验地点为河北师范大学实验中心,使用许可证编号SYXK (冀)2008-0026(换发),动物合格证编号811005。适应性喂养1周后,按雌雄2∶1合笼。孕鼠分娩后,选取每窝仔鼠数目在10~12只的母鼠和仔鼠(剔除体重过高或过低的仔鼠),按每笼雌雄仔鼠各6只的数量标准分笼,母鼠喂养21天后断乳。选取3周龄雄性幼鼠,随机分为对照组(C组),安静喂养到12周龄;运动3周组(E3组),游泳3周后安静喂养到12周龄;运动9周组(E9组),游泳9周到12周龄。每组各12只。
实验室内湿度控制在50±5%,温度控制在(23±2)℃,自然光照,自由饮水摄食。大鼠采用清洁自来水和国家标准大鼠混合饲料饲养。动物饲料由河北省动物实验中心提供。
1.2 运动方案
参考Ploug[5]游泳运动方案,根据预试验结果制定本实验运动方案:第1周为每天30分钟,每周增加15分钟,至第3周为60分钟,每周增加5分钟,至第9周为90分钟,到实验结束。水深50 cm,每只大鼠有200 cm2的活动面积,水温保持在(35±1)℃。每天游泳1次,每周6天。大鼠按实验计划完成运动,无意外死亡。
1.3 取材
大鼠12周龄、停止运动48 h、空腹8 h后腹腔注射0.5%的戊巴比妥钠(50 mg/kg)麻醉。心脏取血,制备血清,-20℃保存备用。每组有半数大鼠经生理盐水心脏灌流后,剪开腹腔取附睾和肾周脂肪垫称重,-80℃保存备用;剩余大鼠经生理盐水心脏灌流后,继续用4%多聚甲醛灌流,取肾周脂肪垫置于多聚甲醛固定液中4℃保存备用。
1.4 血清指标测试
血糖(GLU)测定采用德国Keysys全自动生化分析仪自动完成,所有样本测试在同一批次内完成。采用竞争型放射免疫法测试胰岛素(INS),试剂盒购于中国原子能科学研究所。Leptin采用ELISA-ABC法在芬兰Labsystems公司Wellscan MK2型酶标仪上测试,试剂盒购于美国Millipore公司。
1.5 内脏脂肪量计算
取附睾脂肪垫和肾周脂肪垫,电子天平称重,计算脂体比。 脂体比[6]=[附睾脂肪垫重量(g)+肾周脂肪垫重量(g)]/体重(g)×100%。
1.6 脂肪细胞数目的检测
取适量甲醛固定的肾周脂肪组织,常规石蜡包埋,切片,HE染色。每张切片用IPP软件在400倍视野下取4个视野,计数所有完整脂肪细胞。每组取6个样本,每个样本取两张切片进行计数。
1.7 脂肪组织目的基因表达水平测定
取400~500 mg组织放入玻璃匀浆器,加l ml TRIzol,提取脂肪组织总RNA。进行总RNA完整性分析和含量测定后,采用Fermentas公司反转录试剂盒 (ReverAidTM First Strand cDNA Synthesis Kit)进行反转录,反转录反应体系(20 μl):Total RNA 0.5 μg,Oligo (dT)18 primer 1 μl,5× Reaction Buffer 4 μl,Ribolock Rnase Inhibitor 1 μl,10 mM Dntp Mix 2 μl,ReverAidTM M-MuLV Reverse Transcriptase 1 μl, 加 DEPC-treated water至 20 μl。 反转录反应条件:42℃ 60 min,70℃ 5 min。
根据NCBI-Nucleotide数据库检索目的基因序列,引物采用Primer5.0软件设计,由上海英潍捷基(invitrgoen)公司合成,PCR引物见表1,内参引物为GAPDH。按Takara公司Real-time RT PCR试剂盒(SYBR Premix Ex Taq)配制PCR扩增反应体系,在Applied Biosystems(ABI 7000)定量 PCR 仪上扩增。扩增反应条件:95℃,10 s,1 Cycle;95℃,5 s,60℃,30 s,40 Cycle。反应结束后分析熔解曲线和扩增曲线,扩增产物单一,线性关系良好,进行定量分析。

表1 各目的基因引物序列和扩增产物量
每个样本采用3孔扩增,各孔样本CT值与内参结果比较后,再与第1孔对照组样本进行比较,计算方法为2-△△CT法,由PCR仪自带软件自动完成。每组取6个样本,重复2次,取每次扩增的平均值进行统计学分析。
1.8 统计学分析
在SPSS11.5统计软件上进行统计分析。所有数据以平均数±标准差()表示。Real time PCR 结果使用Wilcoxon非参数检验。脂肪细胞数目比较采用卡方检验。采用方差分析(ANOVA)进行不同组间其他指标比较,先进行正态分布检验,若有显著性差异且方差齐性再进行LSD多重比较。设定显著性水平,P<0.05表示差异具有显著性,P<0.01表示差异具有非常显著性。
2 结果
2.1 体重、内脏脂肪垫重量和脂体比
分组时各组实验大鼠体重无统计学差异,实验期间各组大鼠体重平稳增长,生长发育良好,见图1。表2显示,12周龄时,E9组大鼠体重低于C组,差异有统计学意义 (P<0.05),E3组与C组无统计学差异,但高于 E9组(P<0.05),见表 2。E3组和 E9组大鼠内脏脂肪垫重量和脂体比显著低于C组(P<0.01和P<0.01),E3组和E9组无统计学差异。

图1 实验期间各组大鼠体重变化
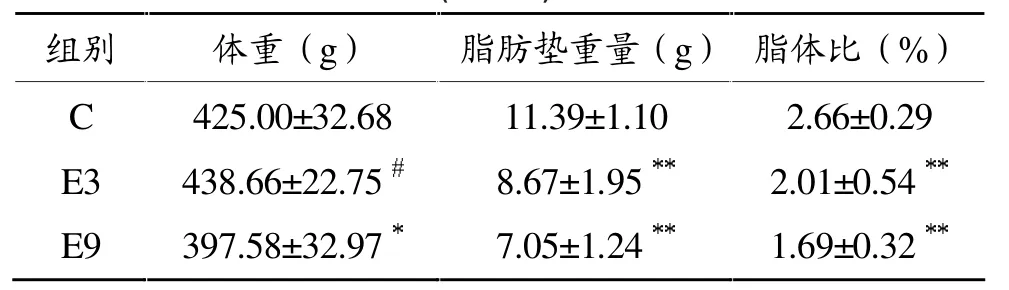
表2 12周龄时各组大鼠内脏脂肪垫重量和脂体比比较(n=6)
2.2 脂肪细胞数目
12周龄时各组大鼠脂肪细胞数目差异具有统计学意义,C组显著低于E3组和E9组 (P<0.01),E3组显著低于E9组(P<0.05),见图2。固定视野下各组大鼠脂肪细胞数目差异(图3)显示,E3组脂肪细胞体积小于C组,E9组小于E3组。

图2 12周龄时各组大鼠脂肪组织切片脂肪细胞数目比较(×400视野下)

图3 12周龄各组大鼠脂肪组织石蜡切片(HE染色,×400)
2.3 血清指标

表3 12周龄时各组大鼠血清指标比较(n=6)
表3显示,各组大鼠血清GLU和INS差异无统计学意义,表明幼龄期进行3周和9周游泳运动对大鼠血糖、胰岛素无明显影响,提示大鼠机体内能量代谢处于平衡状态。E9组大鼠血清Leptin显著低于C组(P<0.05),E3组与C组无统计学差异,但显著高于 E9 组(P<0.01)。
2.4 脂肪组织相关基因表达
图4显示,E3组和E9组大鼠脂肪组织Leptin mRNA表达水平均显著低于C组 (P<0.05),E3组与E9组之间差异无统计学意义。E9组大鼠PPAR-γ mRNA表达水平显著低于C组 (P<0.05),E3组低于C组但无统计学意义,E3组与E9组之间差异无统计学意义。E3组和E9组TNF-α mRNA表达水平显著高于C组(P<0.05),但E3组和E9组之间差异无统计学意义。
3 讨论
程序化理论认为,出生后的环境因素可在生长发育关键期产生潜在性的作用,并在成年时期放大代谢性疾病的风险[7]。生长发育早期营养改变可对机体糖脂代谢产生长期的影响,蛋白摄入超过正常代谢需要,可使胰岛素和IGF-1分泌增加,同时增加脂肪合成和脂肪细胞分化,因此高蛋白饮食易引发婴儿肥胖[8]。运动可消耗机体的能量,改变组织能量贮存状态,进而引起不同器官和组织细胞内基因表达的变化。有研究发现,长期运动后幼龄大鼠体重和体内脂肪含量未出现严重反弹现象[9],因此推测幼龄时期运动对机体脂肪组织代谢活动具有长期稳定的程序化影响。

图4 12周龄各组大鼠脂肪组织基因表达水平的比较
汪军等[10]研究发现,长期运动减慢大鼠体重增长,减少体内脂肪含量。本实验中9周运动大鼠体成分变化与前述研究基本一致。本研究结果显示,断乳后幼龄期3周游泳运动干预大鼠体内脂肪含量与连续9周运动大鼠无差异,且显著低于不运动大鼠。研究发现,在出生前后的发育关键时期,不同喂养条件可决定大鼠成年后的体重。蛋白质、不同脂肪酸及其他微量元素的摄入均可对大鼠成年后体重、脂肪含量以及某些疾病发病率产生显著影响[11,12]。综合分析本研究12周龄时大鼠体重、内脏脂肪垫重量、脂体比以及400倍视野下脂肪细胞数目结果,认为E3组大鼠体内脂肪量低于C组,但脂肪量高于E9组。这表明大鼠幼龄期进行3周运动降低了其成年时(12周龄)体内脂肪含量的积累,提示幼龄发育关键期的短期运动对大鼠成年时的体成分有长期的影响。
本研究还发现,运动3周大鼠脂肪组织Leptin表达水平低于不运动对照组大鼠,但血清Leptin含量与对照组无差异。Leptin是最早被发现的脂肪细胞因子之一,通过中枢和外周机制降低脂肪细胞内脂肪的积累。60分钟的中等强度运动后脂肪组织Leptin分泌量无变化,但有下降趋势[13]。长期运动降低血Leptin水平,但脂肪组织Leptin表达水平变化不确定[14]。本研究中,长期运动大鼠脂肪组织和血清Leptin表达和含量均低于对照组。其他组织细胞也表达和分泌Leptin[15],有学者分析认为运动后Leptin的降解机制不同[16],因此运动3周停止后的12周龄大鼠脂肪组织Leptin mRNA表达下降,但血清Leptin含量未下降。这可能是其他组织分泌Leptin以及运动停止后Leptin降解速率减慢的综合结果。经过3周游泳运动后的幼龄大鼠在12周龄时,其脂肪组织Leptin表达低于对照组,但与9周连续游泳运动大鼠一致。在断乳后进行短期和长期运动均使Leptin表达下降,提示幼龄期短时间的运动对Leptin表达可产生持续的抑制作用。
本研究观察到,幼龄期运动3周大鼠脂肪组织TNF-α表达水平高于不运动对照大鼠,而PPAR-γ表达水平无差异。但幼龄期9周游泳运动大鼠脂肪组织PPAR-γ表达下降,并与幼龄期3周游泳运动大鼠无明显差异,提示幼龄期进行游泳运动可能通过PPAR-γ抑制脂肪细胞的增殖分化。PPAR-γ是调节脂肪酸摄取和氧化的关键转录因子之一。本实验中,9周运动组大鼠脂肪含量较低,可能也是引起PPAR-γ表达下降的重要原因。PPAR-γ和TNF-α是与脂肪细胞增殖分化关系密切的核转录因子和细胞因子[17,18]。 我们前期研究发现,5 周龄大鼠进行 12周游泳运动后,安静状态下脂肪组织TNF-α表达水平无明显变化[19]。本研究发现,3周龄大鼠进行3周和9周运动后,脂肪TNF-α表达水平均升高,且两组之间无差异,说明3周龄进行运动对脂肪组织TNF-α表达有特殊影响。因此,推测幼龄期3周的运动对大鼠脂肪组织TNF-α表达产生长期的影响,是大鼠体内脂肪含量未显著增加的机制之一,生长发育关键时期进行运动对脂肪组织TNF-α表达水平有长期调节作用。
4 总结
大鼠幼龄期3周游泳运动使其在12周龄时仍保持较低的体脂量,脂肪组织Leptin和TNF-α基因表达改变可能是这一现象的生物学机制。
[1]Lucas A.Programming by early nutrition:an experimental approach.J Nutr,1998,128(Suppl):401S-406S.
[2]Waterland RA,Garza C.Potential mechanisms of metabolic imprinting that lead to chronic disease.Am J Clin Nutr,1999,69(2):179-197.
[3]Eriksson JG,Forsen T,Tuomilehto J,et al.Effects of size at birth and childhood growth on the insulin resistance syndrome in elderly individuals.Diabetologia,2002,45 (3):342-348.
[4]Remmers F,Delemarre-van de Waal HA.Developmental programming of energy balance and its hypothalamic regulation.Endocr Rev,2011,32(2):272-311.
[5]Ploug T,Stallknecht BM,Pedersen O,et al.Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle.Am J Physiol,1990,259(6 Pt 1):E778-786.
[6]赵丽军,孙长颢,张晓红,等.膳食铁对饮食诱导肥胖大鼠代谢影响.中国公共卫生,2006,22(1):74-76.
[7]Gorski JN,Dunn-Meynell AA,Hartman TG,et al.Postnatal environment overrides genetic and prenatal factors influencing offspring obesity and insulin resistance.Am J Physiol Regul Integr Comp Physiol,2006,291(3):R768-778.
[8]Druet C,Ong KK.Early childhood predictors of adult body composition.BestPractResClin EndocrinolMetab,2008,22(3):489-502.
[9]Bi S,Scott KA,Hyun J,et al.Running wheel activity prevents hyperphagia and obesity in Otsuka long-evans Tokushima Fatty rats:role of hypothalamic signaling.Endocrinology,2005,146(4):1676-1685.
[10]汪军,田吉明.8周跑台运动对肥胖大鼠下丘脑ghrelin和 obestatin 的影响.北京体育大学学报,2009,32(4):57-60.
[11]Ozanne SE,Hales CN.The long-term consequences of intra-uterine protein malnutrition for glucose metabolism.Proc Nutr Soc,1999,58(3):615-619.
[12]张晓宏,王舒然,赵丽军.断乳后不同饲料构成对高脂膳食大鼠肥胖发生的影响.卫生研究,2005,34 (4):439-441.
[13]Racette SB,Coppack SW,Landt M,et al.Leptin production during moderate-intensity aerobic exercise.J Clin Endocrinol Metab,1997,82(7):2275-2277.
[14]Kohrt WM,Landt M,Birge SJ Jr.Serum leptin levels are reduced in response to exercise training,but not hormone replacement therapy,in older women.J Clin Endocrinol Metab,1996,81(11):3980-3985.
[15]李宏睿,孙文夏,潘杰.瘦素功能研究进展.中国动脉硬化杂志,2004,12(1):108-112.
[16]胡建忠,王子朴.瘦素(Leptin)的生理作用机制及长期运动对其水平的影响.上海体育学院学报,2008,32(5):41-43,94.
[17]Yamauchi T,Waki H,Kamon J,et al.Inhibition of RXR and PPARgamma ameliorates diet-induced obesity and type 2 diabetes.J Clin Invest,2001,108(7):1001-1013.
[18]Prins JB,Niesler CU,Winterford CM,et al.Tumor necrosis factor-alpha induces apoptosis of human adipose cells.Diabetes,1997,46(12):1939-1944.
[19]焦广发,张海峰,高峰,等.12周游泳运动对高脂饮食大鼠脂肪组织UCP2mRNA和TNF-α的影响.中国运动医学杂志,2009,28(3):281-285.
