INF2基因在家族性局灶节段性肾小球硬化中的研究
2012-05-10综述审校
郝 旭 综述 陈 楠 审校
局灶节段性肾小球硬化(FSGS)是慢性肾脏病(CKD)的主要病因之一。国外报道成人原发性肾病综合征患者中,FSGS占肾活检的12%~35%[1],且近年来FSGS发病率呈逐年上升趋势,逐步成为研究的热点,根据病因可分为原发性、继发性和家族性三种。其中家族性FSGS(FFSGS)指同一家族有多人患病,目前研究表明FFSGS的遗传方式多为常染色体隐性遗传(AR)和常染色体显性遗传(AD)两种[2],临床上多表现为对激素和免疫抑制剂治疗不敏感,预后较差。近年来,国外学者通过对FFSGS的连锁分析及定位克隆研究,明确了多个FFSGS的致病基因[3]。2010年美国学者报道,INF2(inverted formin 2)基因是常染色体显性遗传性FFSGS的主要致病基因之一[4],为FFSGS致病基因的研究提供了新的视点。
INF2基因编码一种成蛋白(Formin)家族成员——INF2蛋白,目前国内外对该基因突变所导致的FFSGS致病机制研究尚少。本文将对INF2基因及INF2蛋白在FFSGS的研究进展进行一综述。
Formin概述
1982年,Kleinebrecht等[5]研究的小鼠 ld(limb deformity)基因是第一个研究的成蛋白基因,发现该基因的突变可导致小鼠不能形成(form)正常的肢体和肾,因此而得名Formin。目前酵母、真菌、哺乳动物和植物中的许多成蛋白基因或蛋白均已得到鉴定,其中哺乳动物中发现了15个成蛋白同种型,如mDia1(mouse Diaphanous 1),mDia2 等[6]。成蛋白包含多个不同功能的结构域,其典型结构特征是C端的FH区域,包括靠近N端的FH1结构域和靠近C端的FH2结构域两部分[7]。此外,其N端或C端还含有多种其他结构域,根据不同的调控区域成蛋白可分为不同的亚类。其中Diaphanous相关成蛋白家族(Diaphanous-related formins,DRF)成员因具有N端的GTP酶结合结构域(GTPase binding domain,GBD)、Diaphanous抑制结构域(Diaphanousinhibitory domain,DID)和C端的Diaphanous自调节结构域(Diaphanous-autoregulatory domain,DAD)而被定为成蛋白家族的一个亚类[8],广泛存在于从酵母到哺乳动物的真核细胞中,是目前研究最多的成蛋白家族成员之一。
研究表明,不同的结构域赋予成蛋白不同的功能,并将其与其他信号分子相联系,发挥正常的生物学功能。真核细胞存在动态的微丝骨架系统,对发育及环境刺激信号发生反应,可在聚合与解聚两种状态之间的转变而调节细胞生长、分裂和极性建立[9]。以DRF为例,基础状态下,细胞内 DRF的DID和DAD相互作用而处于自我抑制状态,当活化的Rho(ras homologus oncogenes)GTP酶与GBD结构域结合后,自我抑制状态被解除,从而暴露FH1和FH2功能结构域[10]。其中FH1结构域富含脯氨酸,可与另一种肌动蛋白结合蛋白前纤维蛋白结合,后者可加速微丝延长[11]。FH2结构域高度保守,体外研究已证实可与肌动蛋白直接作用,稳定肌动蛋白二聚体或三聚体,加速肌动蛋白聚合、成核,并刺激纤维状肌动蛋白(F-actin)的聚集,加速肌动蛋白的延伸[12,13]。由此可见,DRF作为一种重要的肌动蛋白成核因子之一,参与了形态的发生、胞质分裂、细胞极性的形成、细胞黏附和运动等多种以肌动蛋白为基础的生物学过程[14]。
INF2独特性及其生物学作用
INF2是由位于14q的INF2基因编码的一种成蛋白家族成员,DRF亚类,与普通成蛋白相比具有其独特性。正常情况下,球状肌动蛋白的自发聚合无法满足微丝骨架的快速动态变化,需要肌动蛋白成核因子来加速肌动蛋白聚合为微丝。成蛋白作为一种重要的肌动蛋白成核因子,可以促进肌动蛋白的聚合,在维持细胞骨架正常结构与功能方面发挥了重要作用。与普通成蛋白相比,INF2的独特性主要表现在其可同时促进肌动蛋白的聚合及解聚[15]。
目前已证实,INF2含有DID和DAD结构域,与其他成蛋白(如mDia1、mDia2)相似,两者的相互作用可影响INF2的功能结构域而调控其功能状态[8,16]。此外,INF2 的 C 端含有一个特殊的结构——肌动蛋白绑定的WH2(WASP homology 2)结构域,该结构域可与肌动蛋白直接作用(图1)。已有研究证实,INF2的DAD结构域与WH2结构域具有相似性,两者均具有三个高度保守的亮氨酸残基[20,21],该氨基酸序列对 WH2 的功能发生至关重要[22],在INF2中,WH2结构域在其自我调控中发挥着类似DAD的作用。肌动蛋白聚合微丝延伸过程中INF2结合在其生长端,当新的肌动蛋白亚单位结合到微丝的生长端时,与其结合的ATP水解成ADP和磷酸基团,后者诱使INF2切割已形成的微丝而引起肌动蛋白的解聚,而编码WH2的基因突变后,肌动蛋白的解聚功能受损,由此可见,INF2 C端的WH2结构域为 INF2的独特性提供了理论基础[15]。
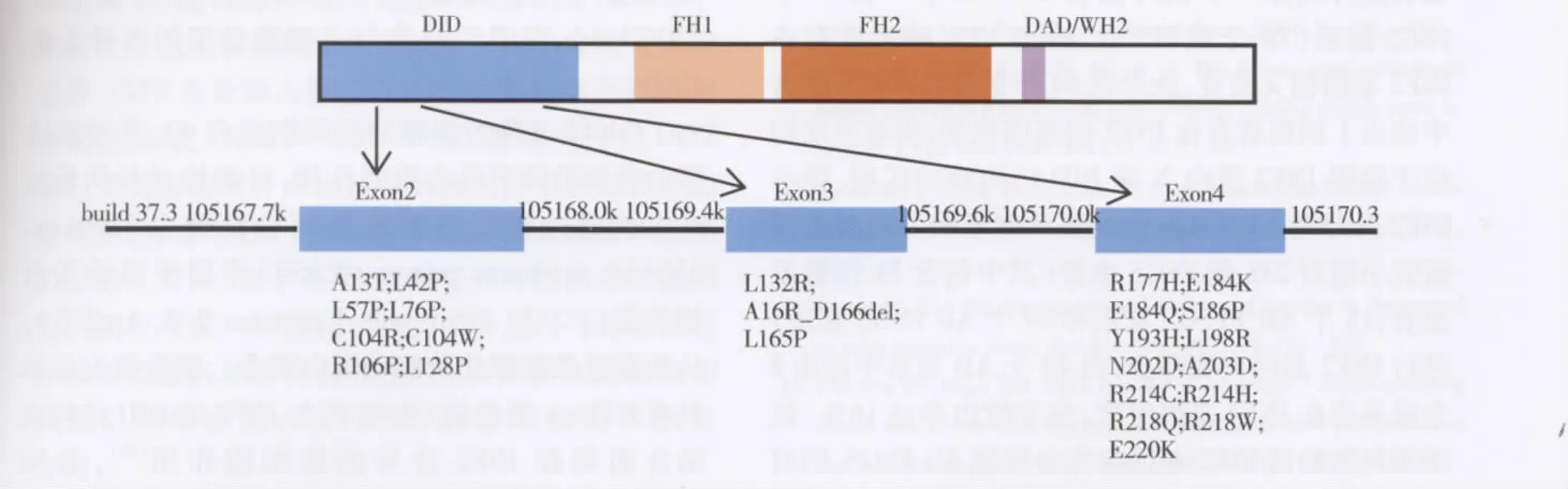
图 1 INF2 主要功能结构域及目前已知突变[4,17-19]
关于INF2的分子水平上的功能研究,Chhabra等[23]的研究首次提出INF2可通过其C端的法尼基基团的转录后修饰及膜离子作用而结合在内质网的胞质侧,提示肌动蛋白可在内质网表面聚合并发挥作用,但具体机制尚不清楚。此外该研究还发现,INF2的DID-DAD相互作用不能抑制FH2结构域的肌动蛋白聚合活性,反而抑制INF2所特有的依赖于DAD/WH2的解聚活性,提示DID可竞争性结合肌动蛋白单体,从而阻断DAD/WH2的解聚功能[23],可见INF2存在与成蛋白家族其他成员不同的自我调控机制。另有研究表明肌动蛋白参与了内质网的逆行运动[24,25],而INF2 作为肌动蛋白重要的调控因子,可能也参与了内质网相关的一系列生物学过程。
INF2基因在肾脏病领域的进展
自2010年Pollak团队首次报道INF2基因可导致常染色体显性遗传性 FSGS[4],该基因在 FFSGS的致病性逐渐引起关注。
INF2基因突变与 FFSGS 2010年,Brown等[4]对一个AD的FFSGS家系进行连锁分析表明FSGS发病与14q32连锁,随即对该区域所有15个已知基因进行外显子测序发现INF2基因与疾病相关,并检测出9个该基因的错义突变,所有突变位点均位于编码INF2 DID结构域的区域,该发现为FFSGS致病基因的研究提供了新的方向。
随即,韩国学者报道由INF2基因突变(E220K)所致的FFSGS新增家系,该家系中3个携带该突变的成员在发病年龄、肾病综合征及进展至终末期肾病(ESRD)的时间均存在明显差异,显示INF2相同的基因突变在同一家系中的不同成员其致病性具有显著的异质性[17]。此外法国 Corinne等[26]在54 个FSGS家系(78个成员)中,检出17%的家系存在INF2基因错义突变,此外在84个散发性FSGS患者中检出1例患者存在INF2的基因突变,所有突变均位于编码INF2蛋白N端DID结构域的区域,提示INF2是导致AD FSGS的主要致病基因。同时美国研究小组对248例FSGS患者(其中包含31位散发患者,15个AR FFSGS家系和49个AD FSGS家系)进行INF2基因突变筛查,在49个AD家系中检出8个家系存在INF2基因突变,突变检出率达16%,该结果再次验证INF2基因突变会导致AD FSGS,同时提出对该基因检测会成为快速、有效、无创的筛查AD FSGS的方法[27]。新近在NEJM中有研究对进行性神经性肌萎缩综合征合并肾脏损伤(主要表现为FSGS)患者进行INF2基因突变筛查发现,在16例患者中有12例患者存在INF2的基因突变,阳性检出率达75%,突变位点均位于2号和3号外显子,编码INF2蛋白DID结构域,该研究为INF2蛋白在肾小球足细胞及神经系统施万细胞中病理生理机制提供了新的视点[18]。目前为止在FFSGS中发现的INF2的基因突变总结见图1。
INF2基因突变在FFSGS中致病机制 作为一种新的家族性FSGS致病基因,INF2基因突变在FFSGS发病中的机制尚未完全清楚。目前所检测到的INF2基因突变位点均2、3、4号外显子,编码INF2蛋白DID结构域,该结构域是INF2蛋白重要功能调控区,其通过与DAD结构域的相互作用调节INF2的功能状态,因此关于其致病机制的研究主要集中于DID结构域功能的研究。
Brown等[4]研究表明原位杂交技术观察人类肾脏组织中INF2 mRNA主要表达于肾小球足细胞及部分肾小管上皮细胞,通过向足细胞中转染突变型INF2质粒发现,未明显改变纤维状肌动蛋白的聚合,而改变了F-actin在足细胞中的定位,表明疾病相关的INF2基因突变可影响肌动蛋白介导的足细胞骨架正常结构的维持其及自我修复功能,可能与突变影响了INF2蛋白DID结构域的正常生理功能有关。如前所述,Rho GTPase与GBP结合,可解除DID/DAD的自我抑制状态,暴露FH1/FH2的活性结构域从而有利于球状肌动蛋白向纤维状肌动蛋白的转化。目前研究较多的是可与INF2相互作用的Rho家族蛋白有细胞分裂周期蛋白2(Cdc42)及其效应分子IQ模体的RasGTP酶活化蛋白1(IQGAp1),两者广泛参与了细胞骨架的各种生理功能。
Cdc42又称为细胞分裂周期蛋白42,其对肌动蛋白骨架的调节具有重要作用,可调控丝状伪足的产生或通过靶蛋白人威-奥综合征蛋白(Wiskott-Aldridge syndrome protein,WASP)作用于肌动蛋白相关蛋白 2/3(Actin-related proteins 2/3,Arp2/3),从而促进微丝核化及肌动蛋白聚合。新近研究显示具有GTPase活性的Cdc42可与INF2的DID结构域结合而调控 INF2介导的跨细胞作用[28],表明Cdc42与INF2的DID之间存在相互作用。进行性神经性肌萎缩综合征合并肾脏损伤的研究结果显示,突变型INF2与Cdc42的活体形式Cdc42-Q61L之间的相互作用存在增强趋势,同时在含有突变型INF2的细胞中 Cdc42-Q61L的亚细胞定位发生改变,而未明显改变 Cdc42的活性[18],表明 INF2是Cdc42 下游的靶蛋白[29]。
众所周知,血清反应因子(serum response factor,SRF)是Rho家族介导的信号通路中重要的反式作用因子,介导某些足细胞特异性相关蛋白的基因表达(如 ACTN4、MYH9 等[30]),两者均已被证实为导致 FFSGS的致病基因[31,32]。有学者在研究INF2_DID与mDia_DAD之间相互作用时提出两者的相互作用可抑制肌动蛋白的聚集及Rho_和Cdc42依赖的SRF所介导的基因转录[33],进一步影响足细胞相关蛋白的表达进而影响足细胞功能。
IQGAp1是 Cdc42的重要效应分子[34],主要参与调控钙黏蛋白依赖性的细胞间黏附。IQGAp1的N端有4个可与钙调蛋白相互作用的IQ模体,参与钙离子介导的信号过程。以往研究免疫共沉淀实验已证实在细胞迁移及吞噬杯形成过程中,RhoA解除mDia的自我抑制状态后,IQGAp1可与mDia1_DID结合而发挥作用[35]。此外,IQGAp1还参与了肌动蛋白细胞骨架的动力学过程,并且可与足细胞相关蛋白,如 Nephrin[36]和 PLC1[37]相互作用。在研究INF2基因突变与FFSGS致病机理中,突变型INF2可能通过影响INF2-IQGAp1之间的相互作用,进而影响足细胞骨架蛋白的正常功能。
目前存在的问题 作为一种新近发现的可导致AD FFSGS的主要致病基因,INF2基因的研究目前主要集中于北美及欧洲地区,在亚洲尚无相关大样本研究,因此目前所报道的INF2基因在FFSGS中的突变率也主要适用于欧美地区。由于地域及人种差异,INF2在亚洲人群的突变率可能与现有报道存在偏倚,因此,在亚洲人群FFSGS患者中进行INF2基因突变的检测并确定其在亚洲人群中的突变率尤显重要,可为今后FFSGS的筛查提供更便捷和直接的方法。另外,关于IFN2基因突变导致的足细胞损伤机制尚需进一步研究,明确INF2蛋白与足细胞特异性相关蛋白是否存在相关性,以便建立足细胞相关蛋白网络框架,为 FFSGS的基础研究提供新方向。
小结:INF2基因作为一种FFSGS的主要致病基因,其阳性检出率达13% ~17%,但在亚洲人群中目前尚无相关报道。在可疑FFSGS患者中对该基因筛查可能为其诊断提供新的线索。而对于该基因的致病机制可能涉及多条通路,最终影响足细胞骨架蛋白的表达及足细胞特异性相关蛋白的结构与功能,进而影响足细胞正常生理功能而致病,其具体机制尚待进一步研究。
1 Pollak MR.Focal segmental glomerulosclerosis:recent advances.Curr Opin Nephrol Hypertens,2008,17(2):138 -142.
2 Rana K,Isbel N,Buzza M,et al.Clinical,histopathologic,and genetic studies in nine families with focal segmental glomerulosclerosis.Am J Kidney Dis,2003,41(6):1170 -1178.
3 Woroniecki RP,Kopp JB. Genetics of focal segmental glomerulosclerosis.Pediatr Nephrol,2007,22(5):638 -644.
4 Brown EJ,Schlöndorff JS,Becker DJ,et al.Mutations in the formin gene INF2 cause focal segmental glomerulosclerosis.Nat Genet,2010,42(1):72-76.
5 Kleinebrecht J,Selow J,Winkler W.The mouse mutant limbdeformity(ld).Anat Anz,1982,152(4):313 -324.
6 Higgs HN,Peterson KJ.Phylogenetic analysis of the formin homology 2 domain.Mol Biol Cell,2005,16(1):1 -13.
7 Castrillon DH,Wasserman SA.Diaphanous is required for cytokinesis in Drosophila and shares domains of similarity with the products of the limb deformity gene.Development,1994,120(12):3367 -3377.
8 Alberts AS.Identification of a carboxyl-terminal diaphanous-related formin homology protein autoregulatory domain.J Biol Chem,2001,276(4):2824-2830.
9 果春青,任海云.成蛋白:一种新的细胞微丝骨架组装的调控因子.科学通报,2006,51(19):2217 -2222.
10 Otomo T,Otomo C,Tomchick DR,et al.Structural basis of Rho GTPase-mediated activation of the formin mDia1.Mol Cell,2005,18(3):273-281.
11 Pollard TD.Regulation of actin filament assembly by Arp2/3 complex and formins.Annu Rev Biophys Biomol Struct,2007,36:451 -477.
12 Kovar DR,Kuhn JR,Tichy AL,et al.The fission yeast cytokinesis formin Cdc12p is a barbed end actin filament capping protein gated by profilin.J Cell Biol,2003,161(5):875 -887.
13 Tominaga T,Sahai E,Chardin P,et al.Diaphanous-related formins bridge Rho GTPase and Src tyrosine kinase signaling.Mol Cell,2000,5(1):13-25.
14 Goode BL,Eck MJ.Mechanism and function of formins in the control of actin assembly.Annu Rev Biochem,2007,76:593 -627.
15 Chhabra ES,Higgs HN.INF2 Is a WASP homology 2 motif-containing formin that severs actin filaments and accelerates both polymerization and depolymerization.J Biol Chem,2006,281(36):26754 -26767.
16 Li F,Higgs HN.The mouse Formin mDia1 is a potent actin nucleation factor regulated by autoinhibition.Curr Biol,2003,13(15):1335 -1340.
17 Lee HK,Han KH,Jung YH,et al.Variable renal phenotype in a family with an INF2 mutation.Pediatr Nephrol,2011,26(1):73 -76.
18 Boyer O,Nevo F,Plaisier E,et al.INF2 mutations in Charcot-Marie-Tooth disease with glomerulopathy.N Engl J Med,2011,365(25):2377-2388.
19 Boyer O,Benoit G,Gribouval O,et al.Mutations in INF2 are a major cause of autosomal dominant focal segmental glomerulosclerosis.J Am Soc Nephrol,2011,22(2):239 - 245.
20 Hertzog M,van Heijenoort C,Didry D,et al.The beta-thymosin/WH2 domain;structural basis for the switch from inhibition to promotion of actin assembly.Cell,2004,117(5):611 -623.
21 Paunola E,Mattila PK,Lappalainen P.WH2 domain:a small,versatile adapter for actin monomers.FEBS Lett,2002,513(1):92 -97.
22 Quinlan ME,Heuser JE,Kerkhoff E,et al.Drosophila Spire is an actin nucleation factor.Nature,2005,433(7024):382 -388.
23 Chhabra ES,RamabhadranV,GerberSA,etal.INF2 isan endoplasmic reticulum-associated formin protein.J Cell Sci,2009,122(Pt 9):1430-1440.
24 Terasaki MReese TS.Interactions among endoplasmic reticulum,microtubules,and retrograde movements of the cell surface.Cell Motil Cytoskeleton,1994,29(4):291 -300.
25 Waterman-Storer CM,Salmon ED.Endoplasmic reticulum membrane tubules are distributed by microtubules in living cells using three distinct mechanisms.Curr Biol,1998,8(14):798 -806.
26 Nicholson JK,Lindon JC,Holmes E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data.Xenobiotica,1999,29(11):1181 -1189.
27 Gbadegesin RA,Lavin PJ,Hall G,et al.Inverted formin 2 mutations with variable expression in patients with sporadic and hereditary focal and segmental glomerulosclerosis.Kidney Int,2011,81(1):94 - 99.
28 Madrid R,Aranda JF,Rodriguez-Fraticelli AE,et al.The formin INF2 regulates basolateral-to-apical transcytosis and lumen formation in association with Cdc42 and MAL2.Dev Cell,2010,18(5):814 -827.
29 Andrés-Delgado L,Antón OM,Madrid R,et al.Formin INF2 regulates MAL-mediated transport of Lck to the plasma membrane of human T lymphocytes.Blood,2010,116(26):5919 -5929.
30 Medjkane S,Perez-Sanchez C,Gaggioli C,et al.Myocardin-related transcription factors and SRF are required for cytoskeletal dynamics and experimental metastasis.Nat Cell Biol,2009,11(3):257 - 268.
31 Kaplan JM,Kim SH,North KN,et al.Mutations in ACTN4,encoding alpha-actinin-4,cause familial focal segmental glomerulosclerosis.Nat Genet,2000,24(3):251 -256.
32 Kopp JB,Smith MW,Nelson GW,et al.MYH9 is a major-effect risk gene for focal segmental glomerulosclerosis.Nat Genet,2008,40(10):1175-1184.
33 Sun H,Schlondorff JS,Brown EJ,et al.Rho activation of mDia formins is modulated by an interaction with inverted formin 2(INF2).Proc Natl Acad Sci U S A,2011,108(7):2933 -2938.
34 Swart-Mataraza JM,Li Z,Sacks DB.IQGAP1 is a component of Cdc42 signaling to the cytoskeleton.J Biol Chem,2002,277(27):24753 -24763.
35 Brandt DT,Marion S,Griffiths G,et al.Dia1 and IQGAP1 interact in cell migration and phagocytic cup formation.J Cell Biol,2007,178(2):193-200.
36 Lehtonen S,Ryan JJ,Kudlicka K,et al.Cell junction-associated proteins IQGAP1,MAGI-2,CASK,spectrins,and alpha-actinin are components of the nephrin multiprotein complex.Proc Natl Acad Sci U S A,2005,102(28):9814 -9819.
37 Hinkes B,Wiggins RC,Gbadegesin R,et al.Positional cloning uncovers mutations in PLCE1 responsible for a nephrotic syndrome variant that may be reversible.Nat Genet,2006,38(12):1397 -1405.
