几种水蛭抗凝血物质提取及活性分析*
2012-05-10吕军仪
张 彬,汪 波,龚 元,于 翔,吕军仪
(1.广西水产研究所广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021;2.北京师范大学珠海分校,广东 珠海519085;3.荆州市民康生物科技有限公司,湖北 荆州 434300;4.辽宁省淡水水产科学研究院,辽宁 辽阳 111000;5.中山大学生命科学学院,广东 广州 510275)
中药水蛭始载于《神农本草经》,具逐恶血瘀血月闭,破血瘕积聚的功效[1],临床上可用于脑血管疾病、精液不化、前列腺肥大、子宫卒中综合征等多种疾病的治疗[2]。现代药理研究表明,水蛭及水蛭提取液具有抗凝血、抗血栓形成的作用,并且不同提取方法具有不同的作用及强度,其活性成份是以水蛭素为主要代表的肽类化合物[3-5],其中水蛭素(Hirudin)是迄今世界上发现最强的天然凝血酶抑制剂[6]。不同种类的水蛭含有特定的活血有效成分[7]。分离纯化和活性检测工作是开发利用水蛭素等活性物质的基础[8]。水蛭素类物质分离提取方法报道较多[9-11],提取效率的高低是关键。对于水蛭抗凝血酶活性检测,主要集中在对不同物种及其部位抗凝血活性比较[12-14]。由于野生水蛭资源减少,人工养殖水蛭逐渐兴起[15]。而针对野生和养殖条件下水蛭活体、干体粉末及唾液腺分泌物抗凝成分提取方法和活性检测的研究目前未见报道。本研究以菲牛蛭提取液的抗凝血酶活性为指标,比较不同提取方法对水蛭抗凝血活性物质的浸提效果,并利用筛选的最佳提取方法对不同物种、地理分布、饲养条件和处理的水蛭样品进行比较分析,以期为中药水蛭的合理开发利用提供参考。
1 材料与方法
1.1 材料
野生宽体金线蛭Whitmaniapigra和光润金线蛭Whitmaniaacranulata活体于2006年采自江苏省宿迁市,野生尖细金线蛭Whitmanialaevis活体于2006年采自山东鱼台,野生日本医蛭活体Hirudonipponia于2007采自湖北省公安县,野生菲牛蛭Hirudinariamanillensis活体于2006年分别采自广东清远,广西南宁和海南琼中;不同营养饵料饲养的菲牛蛭活体由荆州市民康生物科技有限公司提供。本实验于2007年在中山大学水生经济动物研究所完成。
1.2 试剂
纤维蛋白原(上海生物制品研究所生产),凝血酶(天津生物化学制品厂生产),氯化钠、三羟甲基氨基甲烷、盐酸、三氯乙酸、氢氧化钠和乙醇等均为分析纯。
1.3 实验设备
TGL—16GB型高速离心机(上海安亭科学仪器厂),恒温水浴锅(山西省文水医疗器械厂),万能粉碎机(XA-I型,江苏姜堰市分析仪器厂生产),旋转蒸发仪(LABOROTA,4001-efficient Heidolph)和抽真空冷冻干燥器(CHRIST ALPHA 1-4)等。
1.4 实验方法
1.4.1 水蛭样品处理
水蛭干体粉末制备:自然风干后(平均气温低于20 ℃),用粉碎机制备成粉末,将粗粉样品过三号筛而得到的为细粉样品[16]。水蛭唾液腺分泌液采用特殊诱吐技术从活体吸血水蛭体内提取,置-75 ℃冰箱保存备用。水蛭湿体匀浆液样品通过组织匀浆机捣碎获得。
1.4.2 水蛭抗凝活性物提取方法
药液I(盐浸提法M1) 称取50 g水蛭样品(湿体匀浆液、干体粉末和唾液腺分泌液),用4倍体积生理盐水(w=0.9%NaCl)充分浸泡溶解30 min,其间不断搅拌;用φ=10%的三氯乙酸溶液调pH值至2.5,然后置于水浴锅内70 ℃水浴30 min,其间适当搅拌;4 ℃下,10 000 r/min离心10 min,弃沉淀,收集上清液;用1 mol/L的NaOH溶液调pH值至7.0;4 ℃下,12 000 r/min离心10 min,弃沉淀,收集上清液;所得上清液,用旋转蒸发仪90 r/min,30 ℃下减压抽真空浓缩至1/5体积,所得药液备用[10,17]。
药液II (丙酮浸提法M2) 称取50 g水蛭样品(湿体匀浆液、干体粉末和唾液腺分泌液),加入4倍体积冰箱(-10 ℃)中预冷的φ=85%丙酮液,搅拌后置于-20 ℃冰箱内充分溶解过夜;小心地吸出上层的丙酮液,4 ℃下,10 000 r/min离心10 min,弃上清液,收集沉淀;加入冰箱(-10 ℃)中预冷的φ=10%三氯乙酸溶液(20 mL),使其充分溶解;4 ℃下,12 000 r/min离心10 min,弃沉淀,收集上清液用1 mol/L的NaOH溶液调pH值至7.0后备用[18]。
药液III(醇浸提法M3) 称取50 g水蛭样品(湿体匀浆液、干体粉末和唾液腺分泌液),加入3倍体积的0.5 M NaCl溶液,室温下,充分搅拌溶解60 min;用3 N盐酸酸化至pH2.0,然后于水浴锅内70 ℃水浴15 min,其间适当搅拌;4 ℃下,10 000 r/min离心10 min,弃沉淀,收集上清液;向上清液中加入1.5倍体积的无水乙醇,再次离心弃沉淀;上清液在40 ℃下,用旋转蒸发仪,抽真空浓缩至原体积的1/5;加入等体积的丙酮液,离心去除形成的沉淀;上清液中,加入4倍体积的冷丙酮液(-10 ℃),有沉淀析出;收集沉淀,抽真空冷冻干燥后,固体粉末即为得到的粗品;用0.5 M NaCl溶液(80 mL)溶解冻干粉后备用[19-20]。
1.4.3 凝血酶滴定法
所用主要试剂:0.1 mol/L的Tris-HCl缓冲液(pH 7.4),0.5 mol/L HCl和w=0.5%的纤维蛋白原溶液;用0.5 mL生理盐水,轻摇溶解凝血酶,根据所购的凝血酶活性单位,依次配制成500、250、125、62.5、31.25和7.8125 NIH/mL系列浓度梯度,w=0.5%的纤维蛋白原溶液现配现用。具体测定方法:加200 μL血纤维蛋白溶液入2.5 mL圆底玻璃小试管(带试管夹)中,加待测提取样品液100 μL,加凝血酶溶液5 μL,略振,混匀,马上置37 ℃水浴中准确反应1 min,取出,观察玻璃试管内溶液是否胶冻化,若否,则每隔1 min滴定凝血酶一次,直至出现胶冻为止,记录加入的凝血酶量。此过程加的凝血酶浓度从高到低(500、250、125、…)逐步缩小凝血酶的活性范围。精确测量:根据测定结果,以获得最小滴定次数为目标确定滴加的凝血酶浓度的组合,重复测定3次。如果样品浓度过高,可用生理盐水稀释5~10倍后,再取样测活。抗凝活性效价计算:100 μL待测水蛭提取液活性=∑凝血酶浓度×滴加量,并由此折算单位质量或体积的抗凝血酶活性[21-22]。
1.5 数据处理
数据由平均数±标准差(Mean ± S.D.)表示,采用单因子方差分析(One-Way ANOVA)。如果差异显著(P<0.05),再进一步以Duncan’s法进行多重比较。所有数据均采用SPSS 11.5(Statistical Program for Social Sciences.11.5)统计软件进行分析。
2 结 果
2.1 不同提取方法对养殖菲牛蛭抗凝血酶活性的影响
由表1可知,不同提取方法对养殖菲牛蛭各处理品抗凝血酶活性物质提取效率依次为丙酮浸提法、盐浸提法和醇浸提法,且湿体匀浆液、干体粉末和其唾液腺分泌液在3种不同提取方法下均表现出一致的抗凝活性规律;其中丙酮浸提法在菲牛蛭各个处理样品中均具有最高的提取得率,在盐浸提法和醇浸提法下所测抗凝活性均显著低于丙酮浸提法(P<0.05)。

表1 不同提取方法下养殖菲牛蛭抗凝血酶活性效价比较1)
2.2 不同野生水蛭抗凝血酶活性比较
不同水蛭抗凝血酶活性检测结果见表2。宽体金线蛭和光润金线蛭2种非吸血蛭类的湿体匀浆液和干体均无抗凝活性,且非吸血的尖细金线蛭也显示很低的抗凝活性;同时检测出日本医蛭和菲牛蛭2种吸血蛭类具有较高抗凝活性,且菲牛蛭的抗凝活性显著高于日本医蛭(P<0.01),可见吸血蛭类不同种类间抗凝活性也存在一定差异。此外,日本医蛭和菲牛蛭的活体与干体之间活性效价也有较大差异,即从活体到干体,其活性大大损失,损失率超高50%。

表2 5种不同食性野生水蛭抗凝血酶活性效价比较1)
2.3 野生和养殖菲牛蛭抗凝血酶活性比较
由表3可见,3种不同地理分布的野生菲牛蛭(广东菲牛蛭、广西菲牛蛭和海南菲牛蛭)和2种不同饵料饲养的菲牛蛭(天然动物血液和人工饲料喂养),其湿体匀浆液、干体粉末和唾液腺分泌液的提取液抗凝活性均无显著差异(P>0.05),其中3种野生菲牛蛭湿体匀浆液和干体粉末的抗凝活性要略高于2种饲养菲牛蛭(P>0.05),而唾液腺分泌液的抗凝活性则无显著差异,且不同饵料饲养的菲牛蛭各处理品间抗凝活性亦无差异(P>0.05)。
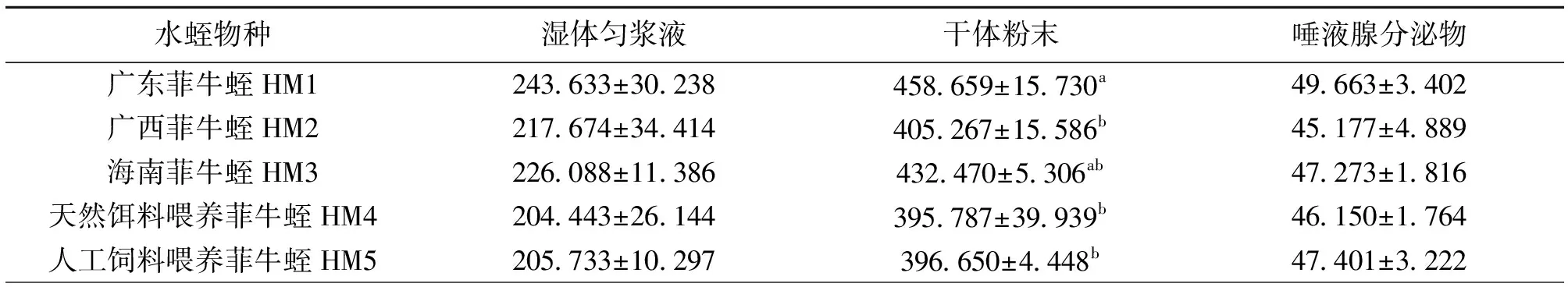
表3 野生和养殖菲牛蛭抗凝血酶活性效价比较1)
3 讨 论
不同提取方法对菲牛蛭抗凝血酶活性比较实验结果表明:3种不同浸提药液抗凝作用差异明显,其中丙酮浸提法具有最佳的抗凝活性,证明其提取得率最高;而盐浸提法和醇浸提法的抗凝活性均明显低于丙酮浸提法。分析原因一方面推测是有机溶剂的萃取作用优于盐溶液,但更可能是盐浸提法和醇浸提法中存在的高温处理对活性物质产生了不利影响,由于温度升高使部分蛋白质变性失活所致[10],而丙酮浸提法方法一直在低温下操作,所以获得最高的抗凝物质得率,这与覃树先[12]的研究结论一致。因此,筛选有效的提取方法能够高效利用水蛭类中药资源。
5种水蛭抗凝血酶活性效价比较实验结果表明,抗凝血物质的有无或强弱与水蛭食性有着直接关系[23],即吸血类的菲牛蛭和日本医蛭具有较强的抗凝活性,其中菲牛蛭的抗凝活性又高于日本医蛭,而依靠吸吮螺体、蚌壳等软体动物体液生存的3种非吸血类水蛭中,除尖细金线蛭具有弱的抗凝血酶活性外,宽体金线蛭和光润金线蛭均无抗凝活性,其体内可能不含水蛭素类的抗凝血酶活性物质,这与张汉贞等和欧兴长等的研究结论相一致[23-24]。吸血类的菲牛蛭和日本医蛭,其活体和干体的抗凝血酶活性均表现出较大差异,本实验结果表明上述两种水蛭在从活体到干体的处理过程中,其抗凝活性损失率均超过50%,这与汪文茉等[14]的研究结果一致。本实验中所测得日本医蛭活体和干体抗凝活性分别为161.2和361.9 AT-U/g,而张汉贞等[23]所测日本医蛭活体和干体抗凝活性分别为82.2和159.2 AT-U/g,两者差距较大,分析原因可能是由于所采用的浸提方法不同而致,前者采用丙酮浸提法,而后者采用生理盐水提取法。实验结果证明3种非吸血水蛭(宽体金线蛭、光润金线蛭和尖细金线蛭)的抗凝活性较弱或无,但不能由此推断其药理活性不强或无,因为本研究测定的仅是抗凝血酶活性,不能代表其全部药理活性,非吸血类水蛭的药用成分与其疗效的关系有待进一步深入研究[24]。
在实验中,我们根据吸血类水蛭的取食行为自行设计了一套从活体菲牛蛭和日本医蛭唾液腺中提取新鲜唾液腺分泌液的方法[18],对菲牛蛭和日本医蛭唾液腺分泌物的抗凝测定结果显示菲牛蛭的平均抗凝血酶活性均超过45 AT-U/mL,日本医蛭的抗凝活性为38.5 AT-U/mL,菲牛蛭的活性略高于日本医蛭,均具有较强的抗凝活性,并且一条水蛭可以反复提取数次,而不损伤或杀死蛭体,可有效提高对日益减少野生水蛭资源的利用率。
研究表明菲牛蛭具有较强的体外抗凝血酶活性,实验结果显示野生和养殖菲牛蛭的湿体匀浆液、干体粉末和唾液腺分泌液抗凝活性均无显著差异,并且不同饵料饲养的菲牛蛭抗凝活性也无明显差异,证明人工养殖对菲牛蛭的抗凝活性未产生不利影响。因此,开展菲牛蛭规模化人工养殖能够保证药源本身的安全和药效稳定性,是解决菲牛蛭野生资源日渐匮乏和满足日益增长市场需求的唯一途径。
参考文献:
[1]李文,廖福龙,殷晓杰,等.七种水蛭抗血小板凝聚与抗凝血研究[J].中药药理与临床,1997,13(5):32-34.
[2]陈世昆,马君涛,王文兰.水蛭的药理研究及其临床应用[J].中国医院药学杂志,1997,17 (10):472.
[3]周春阳,郑燕林,盛蓉,等.不同方法水蛭提取液对体外培养LEC影响的实验研究[J].四川中医,2006,24(7):11-13.
[4]董晓云,饶高雄,林亚明,等.以抗凝血活性指标筛选水蛭的提取工艺[J].云南中医学院学报,2002,25(3):23-25.
[5]姚楠,余顺慧,相宇,等.日本医蛭不同萃取部位体外抗凝活性的实验研究[J].时珍国医国药,2009,20(5):1092-1093.
[6]欧兴长,丁家欣,张玲.水蛭素的研究概况[J].中国药学杂志,1991,26 (7):396.
[7]丁家欣,欧兴长,张秋海,等.宽体金线蛭5种提取方法的比较[J].中国中西医结合杂志,1994,14(3):165-166.
[8]陈曦,刘光明,胡强,等.天然水蛭素的提取和纯化[J].华东师范大学学报:自然科学版,2004,2:105-106.
[9]黄仁槐,舒芹,梁宋平.抗凝血药物水蛭素的纯化与鉴定[J].湖南师范大学学报:自然科学版,1998,21(1):56-59.
[10]余兰,丁香安,李芳.宽体金线蛭提取工艺研究[J].中国药房,2005,16(10):734-736.
[11]刘君,杨松松.蚂蟥抗凝血活性成分的分离、纯化及检测[J].中成药,2007,29(4):590 -591.
[12]覃树先.水蛭与动物蚂蟥抗凝血作用的比较[J].广西中医学院学报,2000,17(3):78-79.
[13]吴志军,张灵霞,于立华.四种不同品种水蛭生物活性的研究与比较[J].中成药,2006,28(2):232-234.
[14]汪文茉,张秋海,欧兴长.水蛭头、尾抗凝活性的比较及晾干后对活性的影响[J].中国中药杂志,1998,23(3):176.
[15]ZHANG Bin,LIN Qiang,LIN Junda,et al.Effects of broodstock density and diet on reproduction and juvenile culture of the Leech,HirudinariamanillensisLesson,1842[J].Aquaculture,2008,276: 198-204.
[16]国家药典委员会.中华人民共和国药典(2005年版)[M].北京:化学工业出版社,2005:77.
[17]杨立新,秦海娜,李晓晖,等.水蛭素的分离纯化与检测方法研究进展[J].水产科学,2005,24(2):37-39.
[18]杨潼,李建秋,尹平.我国产日本医蛭水蛭素的分离和纯化[J].水生生物学报,1997,21(2):169-173.
[19]刘欣,张文清,夏玮,等.提取水蛭有效成分初探[J].中成药,2002,24(11):894-895.
[20]冯光军,朱正光,余传林,等.水蛭乙醇提取物体外抗凝血活性研究[J].中药材,2007,30(8):909-911.
[21]陈华友,黄静,蒋芝君,等.抗凝良药水蛭素的研究进展[J].生物学通报,2003,38(3):3-6.
[22]刘纯古,童张法.水蛭素活性分析方法的研究[J].当代化工,2004,33(4):243-245.
[23]张汉贞,桂玉兰,聂诗明,等.不同食性的水蛭抗凝血酶活性的比较[J].中药材,1998,21(12):599-600.
[24]欧兴长,张秋海,丁家欣,等.四种水蛭抗凝血酶作用的研究[J].天然产物研究与开发,1996,8(2):54-56.
