产蛋白酶菌株Bacillus subtilis GS-1发酵条件优化及蛋白酶水解应用初步研究*
2012-05-10王方华王永华
王方华,刘 亮,王永华,杨 博
(1.华南理工大学轻工与食品学院,广东 广州 510640;2.华理工大学生物科学与工程学院,广东 广州 510641)
蛋白酶在洗涤剂、皮革制备、蛋白水解加工等行业已经得到了广泛的应用[1]。经过蛋白酶水解修饰后的蛋白,其自身的溶解性、热稳定性以及在酸性条件下的抗凝集性均能得到有效提高。同时,在水解过程中所产生的多肽和自由氨基酸,使得其自身的功能特性和营养价值也有所提高[2-4]。研究表明,低分子量的多肽能被肠道直接吸收且很少发生过敏反应。另外,已报道多种具有生物学功能的多肽能增加营养的高效利用[5-6]。因此,在食品加工行业中,利用蛋白酶水解的方法改善食品的风味及营养价值备受推崇。目前,微生物来源的蛋白酶以其自身的优势和特异性,得到了广泛的应用。其中以来源于芽孢杆菌属及曲霉属的微生物发酵制备蛋白酶最为常见。大部分枯草芽孢杆菌被发现可发酵产蛋白酶[1,7-12]。然而,尽管蛋白酶有着不同的微生物来源[9-15],并表现出潜在应用价值,但是目前开发的蛋白酶还不能满足市场的多样化需求。其中,蛋白酶制剂开发的高成本成为限制其广泛应用的一大瓶颈[16]。因此,高效经济的开发获得更多能广泛应用的蛋白酶受到越来越多的关注。
出于成本考虑,目前多数的商品化蛋白酶为发酵液的粗提物。微生物发酵过程中产蛋白酶的活力受多种因素的影响。其中,培养基的标准化和发酵条件的优化成为关键的决定因素。在条件优化方面,统计学实验设计是公认的一种快速有效的解决方法,它们提供的数学统计模型能提供不同变量之间的关系以及预测最大蛋白酶产量的信息[17]。其中,Plackett-Burman (PB) 设计和响应面(RSM)是最常用的方法。PB设计主要用于从众多变量中筛选出关键影响变量,在最初的优化设计中显得尤为重要[18]。响应面是一项经验模型技术,被用来评估一系列可控的实验因素和被观测值之间的关系。其中涉及到的中心实验设计(CCD) 常被用于分析自变量对因变量的影响[19]。实践证明,利用以上方法优化所得的发酵参数进行发酵,不但生产成本得到减少,而且酶活力得到显著提高[7,12,20]。
我们研究发现,枯草芽孢杆菌GS-1菌株在发酵过程中能产生胞外蛋白酶并具有水解活性。本文通过PB设计和响应面实验优化了培养基的组成和发酵过程中的各种物理参数,以期提高其蛋白酶的活力。另外,用发酵所得的粗酶液水解不同的动物蛋白和植物蛋白,以比较其水解效果及对底物的偏好性。以上研究结果不仅为进一步开展该蛋白酶的生化及分子特性研究奠定了基础,同时也为该蛋白酶制剂的开发应用提供数据参考。
1 材料和方法
1.1 菌种和培养基
实验用菌株为枯草芽孢杆菌BacillussubtilisGS-1,低温冻存的菌种首先用Luria-Bertani (LB) 培养基进行种子液的培养。LB培养基组成为:蛋白胨10.0 g/L,酵母膏10.0 g/L,NaCl 10.0 g/L,pH 7.0。发酵用培养基组成为:玉米淀粉 (15.0 g/L),玉米浆干粉 (15.0 g/L),蛋白胨 (1.0 g/L),NH4Cl (5.0 g/L),KH2PO4(1.0 g/L),Na2HPO4(5.0 g/L),MgSO4·7H2O (0.2 g/L),MnSO4(0.1 g/L)。
1.2 发酵粗酶液制备
取5 mL于37 ℃培养了24 h的种子培养液接种于含100 mL发酵培养基的三角瓶中。37 ℃摇床培养48 h (200 r/min),将发酵所得菌液8 000 r/min离心10 min获得发酵液上清,即为蛋白酶的粗酶液,用于蛋白酶活性测定。
1.3 酶活力测定
蛋白酶活性测定参照Folin 和 Ciocalteu的方法进行[21],并稍作修改。取1 mL蛋白酶液加入到含有酪蛋白 (w=2%) 的磷酸缓冲液 (0.1 mol/L,pH 7.0) 中,在40 ℃恒温水浴中反应20 min,然后加入2 mL的三氯乙酸 (0.4 mol/L) 以终止反应。10 000 r/min离心15 min,取1 mL离心后上清加到Na2CO3(w=10%) 和福林试剂 (0.8 mol/L) 的混合液中,于40 ℃ 孵育20 min,680 nm处测定其吸光值。酶活单位定义为在上述条件下,每分钟水解酪蛋白产生1 μg 酪氨酸所需的酶量。
1.4 PB实验设计
选取影响蛋白酶发酵酶活的10个因素,包括培养基组成 (玉米淀粉,玉米浆干粉,蛋白胨,NH4Cl,KH2PO4,Na2HPO4,MgSO4·7H2O,MnSO4) 和发酵参数 (起始pH和培养温度),用于关键变量的筛选。实验设计如表1所示,10个变量分别通过12次实验进行评价分析,每个变量通过两个水平 (低水平-1和高水平+1) 来检测。响应值通过蛋白酶活力 (3次实验的平均值) 来衡量。每个变量的显著性通过P值和显著水平确定。
1.5 最陡爬坡实验及相应面优化

1.6 蛋白水解实验
实验选取大豆蛋白,蚕蛹蛋白,虾蛋白 (购自北京奥博星生物技术有限公司) 作为水解底物来考查蛋白酶的水解活力。酶与底物比例 (E/S) 为5%,于50 ℃pH 7.0的条件下反应6 h,每隔1 h取样,沸水中加热处理20 min后,10 000 r/min离心30 min,上清用0.22 μm的滤膜过滤,即获得蛋白水解液,于-70 ℃冰箱保存备用。蛋白水解液的水解度 (DH)、水解液中多肽的分子量分布及自由氨基酸组成参照文献中报道的方法进行。水解度指蛋白水解过程中释放的自由氨基酸的含量,通过α氨基氮与总氮的比值来计算。氨基氮用甲醛滴定法测定[23],总氮用凯氏定氮法测定[24]。水解产物的分子量分布通过分子筛的方法测定[25]。氨基酸组成由反相高效液相色谱方法测定。每个实验重复3次,数据采用SPSS 13.0进行显著性分析 (P<0.05)。
2 结果和讨论
2.1 PB实验确定影响发酵产蛋白酶活力的关键变量
发酵过程中产蛋白酶的活力主要受培养基组成 (如碳源、氮源、金属离子) 以及发酵参数 (如通气量、培养温度、发酵时间等) 的影响[15]。因此,本研究确定了10个可能的因素并从中筛选出最关键的影响变量 (表1)。基于PB实验设计,得到相应的效应值、t值和P值等统计结果 (表2)。其中,效应值用来反应变量的浓度水平,正效应表明变量的浓度水平过低,负效应表明变量的浓度水平过高。从表2中可以看出,X2(玉米淀粉),X3(蛋白胨),X5(KH2PO4),X6(Na2HPO4) 和X7(MgSO4·7H2O) 都表现为正效应。因此,在后续实验中选择它们较高的水平。而其它因素表现为负效应,则选取它们较低的水平。从变量的P值可以看出,X4(NH4Cl),X9(起始pH值) 和X10(培养温度) 的可信度大于90%,因此确定这3个变量为关键变量。由此得到的模型方程为:
Y1= 149- 8.48X1+ 8.62X2+ 4.47X3-11.8X4+ 3.97X5+ 4.54X6+ 4.12X7-4.26X8-15.4X9-11.3X10,方程中Y1为预测的酶活力,Xi为变量。决定系数 (R2) 为0.997 2,调整系数 (adjR2) 为0.969 3,表明该数学模型能较好的表征实验的实际情况。

表1 PB实验矩阵设计筛选影响蛋白酶活力的关键因素1)

表2 PB实验结果的效应评价
2.2 最陡爬坡实验
最陡爬坡实验是通过线性效应的大小和符号来确定预测更高响应值的方向。步伐开始于当前设计区间的中心点并向外延伸。通过选取沿步伐不断延伸的不同区间点来确定一系列实验[26]。本实验中,由于3个关键变量皆表现为负效应,因此,爬坡实验从PB实验的中心点开始,并沿变量水平减少的方向进行。通过相应的计算公式[27],X4,X9和X10的步长分别为-0.738,-0.8 和-2.8。如表3中所示,共设计了6组实验用以确定中心复合实验的中心点。其中,第4组实验中得到了酶活性的最大值。因此,确定其中心点为:NH4Cl质量浓度3.411 g/L,起始pH 5.1,培养温度26.1 ℃。
2.3 响应面分析
本研究中,中心复合实验被用于蛋白酶发酵的响应面分析。结果如表4所示,响应值 (Y) 为3次实验的平均值,预测的响应值根据数学模型计算获得。通过实验设计软件确定的二次方程为:

表3 最陡爬坡实验设计以及相关结果
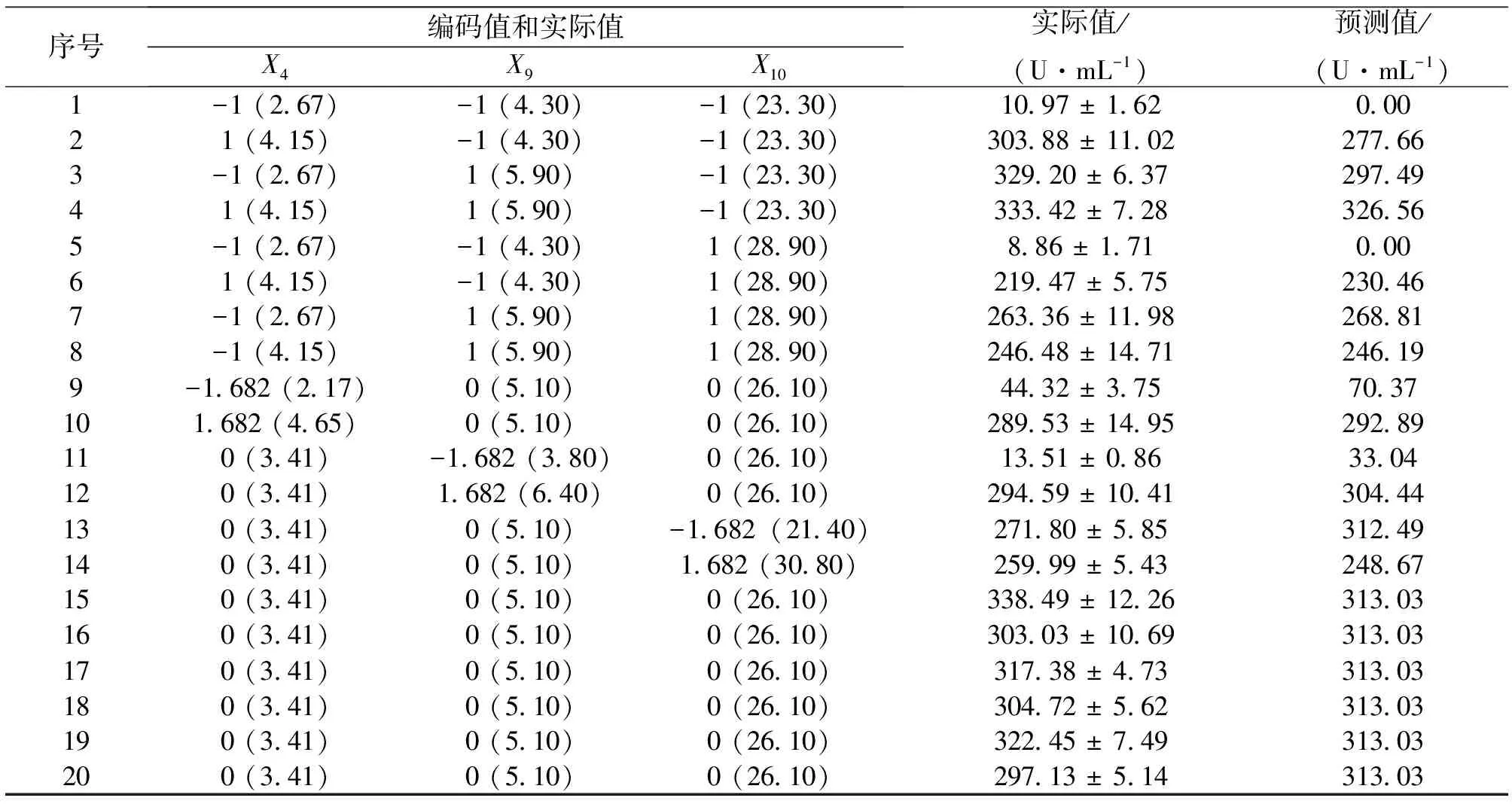
表 4 蛋白酶活力的中心复合实验矩阵设计及响应面分析1)


表5 蛋白酶活性优化的模型适配和方差分析结果1)
为进一步优化发酵产蛋白酶的活力,等高线图和三维立体图被用于对实验数据进行分析。它们能更直观的显示不同变量以及它们的交互作用对响应值的影响。等高线的形状能够反应交互作用是否显著。椭圆表示交互作用显著,而非椭圆则相反。本实验在确定一个因素在最优水平条件下,另外两个因素的相互作用进行观察。等高线图 (图1a,图2a,图3a) 清晰的表明,NH4Cl质量浓度和起始pH之间的交互作用显著,而NH4Cl质量浓度和培养温度,以及起始pH和培养温度之间交互作用不显著。该结果和表5中的分析结果一致,表明这些结果真实反应了不同变量之间的相互作用。同时,从三维立体图 (图1b,图2b,图3b) 可以看出,随着NH4Cl质量浓度和起始pH的增加及培养温度的降低,蛋白酶活力得到显著提高。
当确定起始pH为5.6时,在椭圆中心获得酶活力的最大值,相应的NH4Cl质量浓度和培养温度分别为3.8 g/L和22.4 ℃。如图1-3所示,每一个图都标注了最大酶活力值和相应的变量值。同时,通过实验设计软件得出的数学方程,也得到了预测的最大酶活力值。即当NH4Cl质量浓度为3.768 g/L,起始pH为5.6,培养温度为22.4 ℃时,预测的最大酶活力为365.348 U/mL,与响应面图中获得的优化值一致。同时,我们进行了模型的验证实验,在最优条件下,通过3次平行实验,获得的实际酶活力值为372.814 U/mL。实际值与预测值非常接近,表明该模型能用于发酵过程的预测。

图1 发酵温度确定为22.4 ℃时,NH4Cl质量浓度和起始pH对枯草芽孢杆菌蛋白酶活力影响的等高线图 (a) 和响应面图 (b)
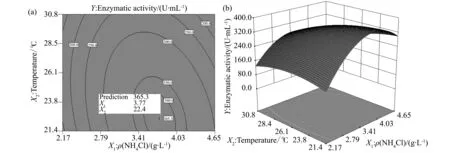
图2 起始pH确定为5.6时,NH4Cl质量浓度和发酵温度对枯草芽孢杆菌蛋白酶活力影响的等高线图 (a) 和响应面图 (b)
2.4 蛋白酶水解实验
蛋白酶发酵液对不同底物的水解度如图4所示。对不同的底物,蛋白酶表现出不同的水解活性。对于植物蛋白 (大豆蛋白)来说,不同时间点取样测得的水解度差异不大 (P>0.05),最高水解度在水解时间为6 h时获得 (约7%)。而与水解植物来源的蛋白相比,该蛋白酶对于动物来源的蛋白 (蚕蛹蛋白,虾蛋白) 的水解更显优势。在水解6 h后,虾蛋白获得的最大水解度为14.4%。蛋白酶对动、植物蛋白表现不同的水解度,推测其原因主要有两点,一是动、植物蛋白的氨基酸组成不同,二是植物蛋白本身含有的多糖或其它成分,可能限制了蛋白酶对蛋白的水解,从而导致低水解度。
不同水解组分的肽段分子量分布结果表明水解产物都富含小相对分子质量片段 (<1 000),分别为94.3% (虾蛋白),91.1% (蚕蛹蛋白),85.7% (大豆蛋白) (图4b)。另外,动物蛋白水解液中的小分子片段所占比例 (<300,蚕蛹蛋白36.8%;虾蛋白35.1%) 比植物蛋白水解物中的小分子片段 (<300,大豆蛋白18.7%)(P<0.05)更多。动物蛋白水解产物较高的小肽分布与蛋白酶对动物蛋白所表现出较高的水解活性结果相吻合。Quist 等发现蛋白在水解过程中首先被内切酶水解成较大的分子肽段,然后经外切酶作用,水解成更小的片段[4]。水解产物中众多的小肽表明粗酶液既有内肽酶活性又有外肽酶活性。因此,下一步工作将确定粗酶液中蛋白酶的组成及其在水解过程中的功能。

图4 蛋白酶水解不同蛋白的水解度(a)和不同水解产物中肽段的相对分子质量分布(b)
针对不同底物的水解产物自由氨基酸组成如表6所示。该结果与Benjakul 和 Morrisey[28]获得的结果相似。底物蛋白经蛋白酶水解作用后,自由氨基酸含量得到显著提高。表6中结果表明,Glu,Val,Ile,Leu,Phe,Arg等氨基酸的含量得到显著提高,说明蛋白酶易于水解由这些氨基酸组成的化学键,这些氨基酸的序列结构和含量决定了底物蛋白的最终水解度。另外,水解产物中较高的必需氨基酸 (His,Arg,Thr,Tyr,Val,Ile,Leu,Phe) 含量也表明水解物营养丰富。蛋白的氨基酸组成是分析其营养成份的关键因素之一。任何成份的营养价值依赖于蛋白满足有机体所需必须氨基酸的能力[29]。提高水解产物中必须氨基酸的含量是提升水产养殖和动物、人类营养的一个有效途径。因此,利用枯草芽孢杆菌GS-1发酵所产蛋白酶对不同底物进行水解加工在食品加工行业中具有巨大的应用价值。

表6 不同底物蛋白水解液的自由氨基酸组成
3 结 论
本研究通过一系列统计学方法成功的对枯草芽孢杆菌GS-1产蛋白酶的发酵过程进行了优化,使得蛋白酶的最高酶活力达到372.814 U/mL。虽然与其它已报道的菌株产蛋白酶的活力相比并不是很高,但这也是一个有意义的尝试。统计优化及实验验证的结果表明该方法用于菌株发酵产蛋白酶活力的优化是切实可行的。至于其酶活力不高,其原因可能与菌株自身的特性有关。本文的研究方法和结果将为该菌株所产蛋白酶的深入研究提供方法和数据上的参考。然而,由于粗酶液中蛋白酶的成份相对复杂,不便于开展蛋白酶的相关酶学性质研究。因此,下一步将集中开展蛋白酶的纯化以及优化蛋白酶的水解条件工作,以便于其在蛋白水解工业上的应用。
参考文献:
[1]OSKOUIEA S F G,TABANDEHB F,YAKHCHALIB B,et al.Response surface optimization of medium composition for alkaline protease production byBacillusclausii[J].Biochemical Engineering Journal,2008,39: 37-42.
[2]GUERARD F,DUFOSSE L,BROISE D D L,et al.Enzymatic hydrolysis of proteins from yellowfin tuna (Thunnusalbacares) wastes using Alcalase[J].Journal of Molecular Catalysis B: Enzymatic,2001,11: 1051-1059.
[3]QUIST E E,PHILLIPS R D,SAALIA F K.The effect of enzyme systems and processing on the hydrolysis of peanut (ArachishypogaeaL.) protein[J].LWT-Food Science and Technology,2009,42: 1717-1721.
[4]YU J,AHMEDNA M,GOKTEPE I.Peanut protein concentrate: Production and functional properties as affected by processing[J].Food Chemistry,2007,103: 121-129.
[5]CLARE D A,SWAISGOOD H E.Bioactive milk peptides: A prospectus[J].Journal of Dairy Science,2000,83: 1187-1195.
[6]ELIAS R J,KELLERBY S S,DECKER E A.Antioxidant activity of proteins and peptides[J].Critical Reviews in Food Science and Nutrition,2008,48: 430-441.
[7]RAMNANI P,GUPTA R.Optimization of medium composition for keratinase production on feather byBacilluslicheniformisRG1 using statistical methods involving response surface methodology[J].Biotechnology and Applied Biochemistry,2004,40: 191-196.
[8]HADDAR A,FAKHFAKH-ZOUARI N,HMIDET N,et al.Low-cost fermentation medium for alkaline protease production byBacillusmojavensisA21 using hulled grain of wheat and sardinella peptone[J].Journal of Bioscience and Bioengineering,2010,110: 288-294.
[9]KUMAR R,BALAJI S,UMA T S,et al.Optimization of influential parameters for extracellular keratinase production byBacillussubtilis(MTCC9102) in solid state fermentation using Horn meal—a biowaste management[J].Applied Biochemistry and Biotechnology,2010,160: 30-39.
[10]BHUNIA B,DUTTA D,CHAUDHURI S.Extracellular alkaline protease fromBacilluslicheniformisNCIM-2042: Improving enzyme activity assay and characterization[J].Engineering in Life Sciences,2011,11:207-215.
[11]LIU S,FANG Y,LV M,et al.Optimization of the production of organic solvent-stable protease byBacillussphaericusDS11 with response surface methodology[J].Bioresource Technology,2010,101: 7924-7929.
[12]RAI S K,MUKHERJEE A K.Statistical optimization of production,purification and industrial application of a laundry detergent and organic solvent-stable subtilisin-like serine protease (Alzwiprase) fromBacillussubtilisDM-04[J].Biochemical Engineering Journal,2010,48: 173-180.
[13]RAI S K,MUKHERJEE A K.Optimization of production of an oxidant and detergent-stable alkaline (-keratinase fromBrevibacillussp.strain AS-S10-II: Application of enzyme in laundry detergent formulations and in leather industry[J].Biochemical Engineering Journal,2011,54: 47-56.
[14]MANIKANDAN A,KANNAN V,VELIKONJA B H,et al.Optimization of growth medium for protease production byHaloferaxlucentensisVKMM 007 by response surface methodology[J].Brazilian Journal of Microbiology,2011,42: 818-824.
[15]WANG Q,HOU Y,XU Z,et al.Optimization of cold-active protease production by the psychrophilic bacteriumColwelliasp.NJ341 with response surface methodology[J].Bioresource Technology,2008,99: 1926-1931.
[16]LI Z Y,YOURAVONG W,H-KITTIKUN A.Protein hydrolysis by protease isolated from tuna spleen by membrane filtration: A comparative study with commercial proteases[J].LWT-Food Science and Technology,2010,43: 166-172.
[17]WANG Y H,JING C F,YANG B,et al.Production of a new sea anemone neurotoxin by recombinantEscherichiacoli: Optimization of culture conditions using response surface methodology[J].Process Biochemistry,2005,40: 2721-2728.
[18]FAKHFAKH-ZOUARI N,HADDAR A,HMIDET N,et al.Application of statistical experimental design for optimization of keratinases production byBacilluspumilusA1 grown on chicken feather and some biochemical properties[J].Process Biochemistry,2010,45: 617-626.
[19]PAI C K,ZENG Y F,YUEH P Y,et al.Prediction of optimum reaction conditions for the thermo-tolerant acetylxylan esterase fromNeocallimastixpatriciarumusing the response surface methodology[J].Journal of Chemical Technology and Biotechnology,2010,85: 628-633.
[20]PLACKETT R L,BURMAN J P.The design of optimum multifactorial experiments[J].Biometrika,1946,33: 305-325.
[21]FOLIN O,CIOCALTEU V.On tyrosine and tryptophane determinations in proteins[J].Journal of Biological Chemistry,1927,73: 627-650.
[22]SU G,REN J,YANG B,et al.Comparison of hydrolysis characteristics on defatted peanut meal proteins between a protease extract fromAspergillusoryzaeand commercial proteases[J].Food Chemistry,2011,126: 1306-1311.
[23]BROWN J H.The formol titration of bacteriological media[J].Journal of Bacteriology,1923,8: 245-267.
[24]CHIANG W D,SHIH C J,CHU Y H.Functional properties of soy protein hydrolysate produced from a continuous membrane reactor system[J].Food Chemistry,1999,65: 189-194.
[25]SHEN Y F,WANG F H,LAN D M,et al.Biochemical properties and potential applications of recombinant leucine aminopeptidase fromBacilluskaustophilusCCRC 11223[J].International Journal of Molecular Sciences,2011,12: 7609-7625.
[26]CHEN Q H,HE G Q,ALI M A M.Optimization of medium composition for the production of elastase byBacillussp.EL31410 with response surface methodology[J].Enzyme and Microbial Technology,2002,30: 667-672.
[27]BAI D,WU J,XU G,et al.Optimization of the production conditions of HMPC hydrolase employing response surface methodology[J].Journal of Food Science and Biotechnology,2007,26: 71-76.
[28]BENJAKUL S,MORRISEY M T.Protein hydrolysate from pacific whiting solid waste[J].Journal of Agricultural and Food Chemistry,1997,61: 131-138.
[29]BHASKAR N,BENILA T,RADHA C,et al.Optimization of enzymatic hydrolysis of visceral waste proteins of Catla (Catlacatla) for preparing protein hydrolysate using a commercial protease[J].Bioresource Technology,2008,99: 335-343.
