天麻色谱学分类与品质评价
2012-05-07谭碧君孔海文
谭碧君,孔海文,陶 钧
(长沙理工大学化学与生物工程学院,湖南 长沙 410114)
生化指纹图谱技术是鉴定和评价中药和天然药物质量最有效的科学方法之一。通过测定生化指纹图谱能检测到药用植物中绝大多数生化成分,不仅能反映不同来源的同种药物的共性,而且能显示同种不同遗传类群天然药物的特殊性,并能根据指纹图谱相似性对其进行系统分类,也能根据各种生化成分的峰面积确定其含量并作出科学评价,还能用于不同来源的同种药物以及同一来源的不同种药物的鉴定。HPLC指纹图谱精确、高效,是测定生化指纹图谱最常用的方法[1~3]。因此,中国食品药品监督管理局已将HPLC指纹图谱列为中药和天然药物的质控标准[SFDA,2007(743号)]。研究先进、实用的天然药物生化指纹图谱鉴定技术已成为研究热点[4~7]。
天麻是我国四大名贵中药材(冬虫夏草、人参、鹿茸)之一。天麻及其有效成分天麻素具有多种药理作用[8~12],且毒副作用小。天麻的质量和真伪通常凭肉眼观察和经验,根据天麻个体大小、成色和原产地来判断,缺乏科学性。为了建立天麻质量和真伪的评价方法,王莉等[13]、谢笑天等[14]、张炜等[15]研究了天麻的HPLC指纹图谱识别和评价方法,但存在分离效果差、检测到的生化成分少、图谱不够清晰、检测时间长、浪费大量化学试剂等问题,尤其未见利用指纹图谱相似性对药用植物进行分类和评价,探讨生化指纹图谱、有效成分含量和原产地三者之间关系的报道。
为了建立天麻生化指纹图谱最佳测定方法,利用指纹图谱对天麻进行科学分类和评价,作者运用优化的高效液相色谱方法测定了9种天麻的生化指纹图谱及其天麻素含量;运用分析软件计算了它们的生化指纹图谱的相似系数;运用聚类分析方法和相似系数对天麻进行系统分类;并根据天麻素含量和色谱峰面积对天麻品质进行综合评价。
1 实验
1.1 材料、试剂与仪器
9种天麻样本分别采自湖南石门、湖北宜昌、安徽大别山、贵州大方、陕西略阳、西藏察愚、云南彝良、四川凉山和吉林长白山。每种天麻采集12个样本(大、中、小各4个),由湖南德海药材开发公司专家鉴定后,储存于-70 ℃冰箱中。
标准天麻(批号120944-200905)、天麻素对照品(批号110807-200905,纯度99%以上),中国药品与生物制品检定所。
乙腈为色谱纯,其它试剂均为分析纯。
Agilent 1100型高效液相色谱仪[DE43628782型液压泵、JP40718258型样本注射器、DE43623222型检测器、Eclipse XDB-C8色谱柱(4.6 mm×150 mm,5 μm)],德国Waldbronn公司;JY92-2D型超声波细胞破碎器,浙江。
1.2 天麻素对照品溶液的制备
精确称取天麻素对照品(80 ℃干燥1 h)0.5 mg,置10 mL容量瓶中,用10%乙腈溶液稀释至刻度,摇匀,用0.45 μm滤膜过滤,置冰箱中备用。
1.3 天麻样本处理
新鲜天麻蒸煮、烘干后,研成粉末,过80目筛,然后置80 ℃ 干燥箱中烘1 h。精确称取1 g天麻粉末置萃取器中,加70% 乙醇溶液混匀。先将萃取器置于97 ℃热水中处理20 min;再用超声波处理25 min(超声波处理9 s,停2 s,功率250 W)。超声波处理后用乙醇溶液补足损失的水分。同法重复处理1次。用滤纸过滤处理过的样本溶液,收集滤液。蒸发,获得干燥萃取物。用流动相溶解萃取物,用0.45 μm滤膜过滤,置冰箱中备用。
1.4 色谱条件的筛选
基本色谱条件为:柱温25 ℃,流速1 mL·min-1,进样量20 μL。
以10%乙腈溶液和梯度浓度乙腈溶液(0~1.5 min为纯水,1.6~3.5 min为5%乙腈,3.6~8 min为10%乙腈)为流动相,以221 nm为检测波长,用高效液相色谱仪测定天麻样本的生化指纹图谱,比较两种不同流动相的分离效果,筛选最适流动相。
以优化的梯度浓度乙腈溶液为流动相,比较5种检测波长(221 nm、219 nm、217 nm、215 nm、213 nm)检测效果,筛选最佳检测波长。
1.5 方法的精密度、天麻素的稳定性和回收率测定以及样本量与天麻素含量的线性分析
方法的精密度、天麻素的稳定性和回收率参照文献[14]进行。样本量与天麻素含量的线性分析参照文献[16]进行。
1.6 天麻生化指纹图谱测定
采用优化的参数(梯度浓度乙腈溶液、219 nm波长)和选定的基本色谱条件测定天麻样本的生化指纹图谱。
1.7 数据统计与处理
样本天麻素含量采用下式计算:
式中:YYH为单位质量样本的有效成分含量;YYM 为样本有效成分峰面积;YDZ 为有效成分对照品的质量;YDM 为有效成分对照品峰面积;YZ为样本的质量。
运用中药色谱指纹相似度评价系统(2004A,由中南大学设计)计算样本色谱指纹图谱的相似系数。运用SPSS11.5软件(类平均聚类法)和相似系数构建相似树状图。根据相似树状图对天麻种群进行系统分类。采用非配对两样本平均数差异显著性t检验[16],分析天麻类群之间的天麻素含量差异显著性。根据平均天麻素含量和分离峰总面积对天麻样本和种群的品质进行鉴定与评价。通过比较,阐明天麻生化指纹图谱、有效成分含量和来源地的关系,从而发现优良天麻品种和适宜种植地区。
2 结果与讨论
2.1 最佳流动相的筛选
分别以10%乙腈溶液和梯度浓度乙腈溶液为流动相,以221 nm为检测波长,测定天麻标准品的生化指纹图谱,结果见图1。

图1 以10%乙腈溶液(A)、梯度浓度乙腈溶液(B)为流动相的天麻标准品的生化指纹图谱
由图1可知,梯度浓度乙腈溶液比10%乙腈溶液的分离效果好。前者分离出18种成分,而后者只得到9种成分,而且分离效果差。这是由于10%乙腈对天麻化学成分具有很强的洗脱作用,洗脱速度过快。因此,选择梯度浓度乙腈溶液为流动相。
2.2 最佳检测波长的筛选
以优选的梯度浓度乙腈溶液为流动相,以221 nm、219 nm、217 nm、215 nm、213 nm 5种波长测定天麻标准品的生化指纹图谱。结果发现,219 nm下获得的天麻素峰面积(3次平均值,mAU*s)最高,为9565.9,其余分别为9528.3、9372.7、9101.3、8832.6,相对其降低了0.4%、2%、4.9%、7.7%,表明用219 nm波长检测天麻样本能得到最大天麻素峰面积,检测波长增大或减小都会使天麻素峰面积减少。5种波长下获得的天麻各种生化成分总峰面积(mAU*s)分别为:48401.1、51671.6、54129.5、56964.1、59783.3。表明各种生化成分的总峰面积随检测波长的减小而增加。综合考虑,选择检测波长为219 nm。
2.3 方法的精密度、天麻素稳定性和回收率检验
采用优化参数和选定的色谱条件重复测定天麻标准品的天麻素含量5次,相对标准偏差(RSD)为1.41%。 分别于0 h、12 h、24 h、48 h、96 h测定天麻标准品的天麻素含量,不同时间测定结果的RSD为1.36%。将1 mL天麻素对照品(1 mg·mL-1)分别加入到5个已知天麻素含量的天麻样本中,再测定其回收率,平均回收率为97.7%、RSD为2.6%。
2.4 样本量与天麻素含量的线性关系
采用优化参数和选定的色谱条件测定4 μL、8 μL、12 μL、16 μL和20 μL天麻标准品的天麻素含量。结果表明:样本量x与天麻素含量y呈良好线性关系,拟合线性回归方程为:y=0.40795x+0.3332,R=0.9998。
2.5 天麻的生化指纹图谱测定
以梯度浓度乙腈溶液为流动相、以219 nm为检测波长,在基本色谱条件下测定9种天麻样本的生化指纹图谱,选取有代表性的3类图谱(其它图谱未列出),结果见图2。

图2 湖北天麻(A)、云南天麻(B)、四川天麻(C)萃取物的生化指纹图谱
由生化指纹图谱可见,来自同一地区或不同地区的同类型天麻(根据聚类分析判断)具有十分相似的生化指纹图谱;来自不同地区的不同类型天麻具有不同形状的生化指纹图谱和不同数量的分离峰(15~21个)。但所有天麻样本都有8个共有特征峰,分别位于 1.29 min、2.70 min、4.88 min、5.44 min、5.83 min、6.37 min、6.60 min和7.09 min左右,平均RSD为1.36%,其中天麻素峰最稳定(位于5.44 min左右),其RSD 为0.36%。
2.6 天麻生化指纹图谱的相似性分析和种群分类
运用相似度评价系统计算天麻种群内样本之间的生化指纹图谱相似系数和种群之间的生化指纹图谱相似系数,见表1和表2。
运用SPSS11.5软件和表2中的相似系数构建天麻相似树状图,见图3。

表1 天麻种群内样本之间生化指纹图谱的相似系数
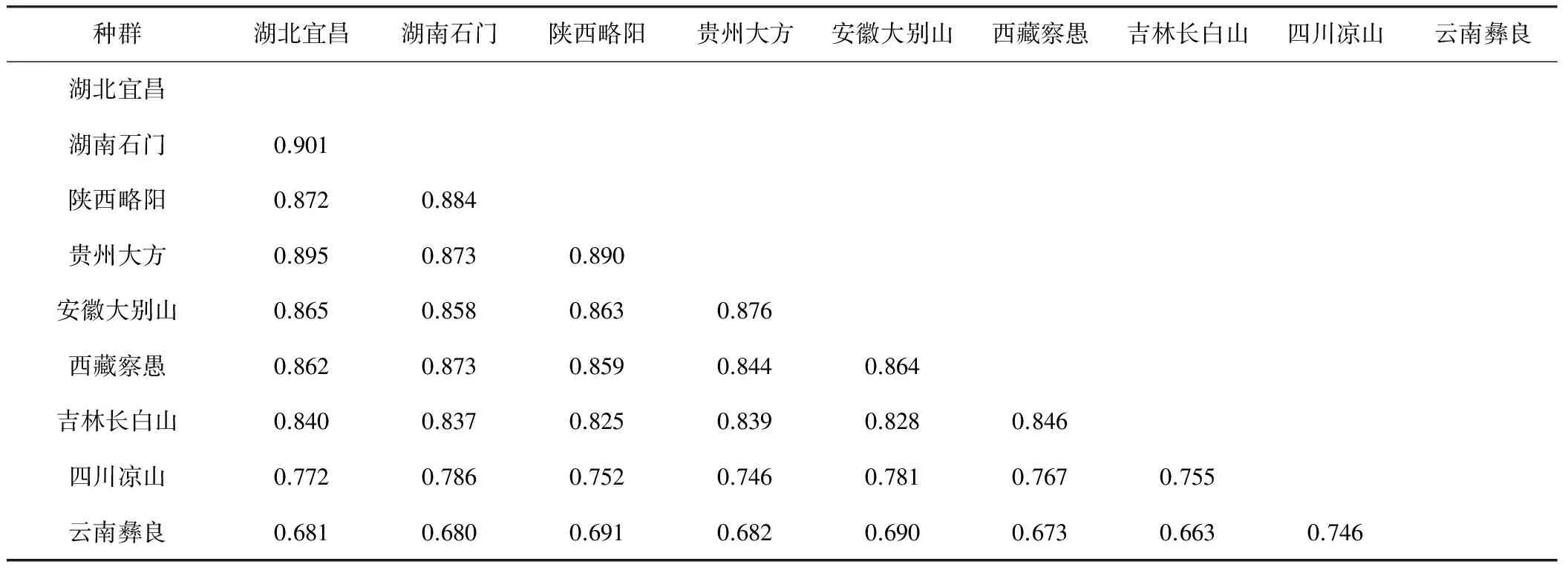
表2 9个天麻种群之间生化指纹图谱的相似系数
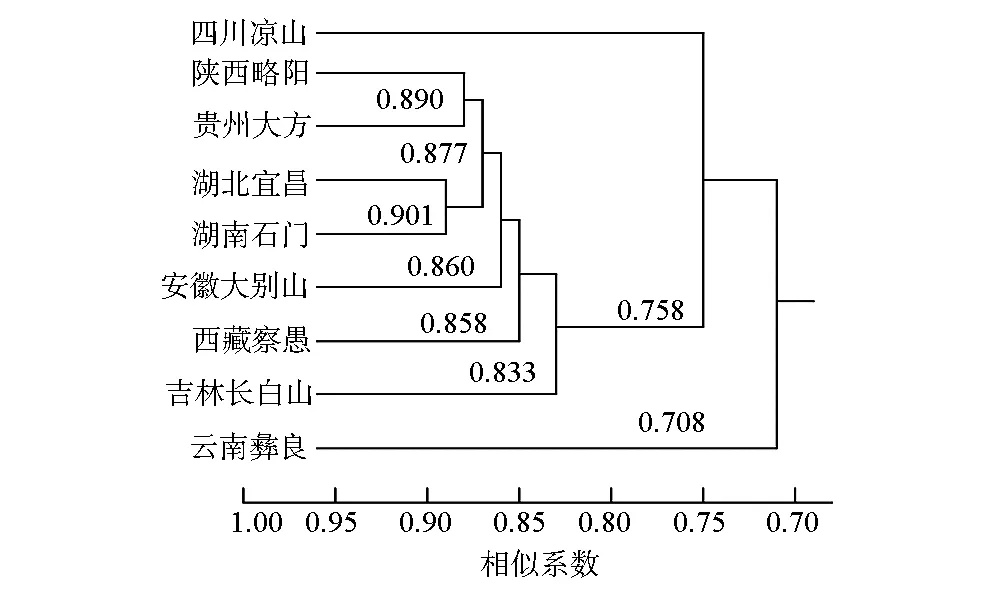
图3 9个天麻种群之间生化指纹图谱的相似树状图
根据相似树状图可将9种天麻分成3个不同的类群:第Ⅰ类包括天麻标准品、湖南石门、湖北宜昌、安徽大别山、贵州大方、陕西略阳、西藏察愚和吉林长白山天麻,这一类天麻的生化指纹图谱特征是:天麻素分离峰比其它所有成分的分离峰都高;第Ⅱ类包括云南彝良天麻,这一类天麻的指纹图谱特征是:在2.4 min左右和7.0 min左右处有两个高大的峰(分别占总峰面积的38.1%和25.2%)、而天麻素峰矮小(占总峰面积的5%左右);第Ⅲ类包括四川凉山天麻,这一类天麻的指纹图谱特征介于第Ⅰ类和第Ⅱ类之间,其2.4 min左右分离峰与Ⅱ类天麻的对应峰一样高,7.0 min左右分离峰比Ⅱ类天麻的对应峰矮小,但其天麻素峰比Ⅱ类天麻的对应峰高得多,接近Ⅰ类天麻对应峰。
2.7 天麻种群的天麻素定量分析与评价
2.7.1 定量分析
根据样本的天麻素峰面积,计算各种天麻样本的平均天麻素含量,见表3。

表3 9种天麻的平均天麻素含量和分离峰总面积比较
由表3可知,湖北宜昌和湖南石门天麻的天麻素含量最高,分别达到7.52 mg·g-1、7.26 mg·g-1,其它成分含量也很高(根据其峰面积推算);云南彝良天麻的天麻素含量最低,但其它成分含量很高。
统计和计算天麻各类群的平均天麻素含量和平均总峰面积,结果见表4。
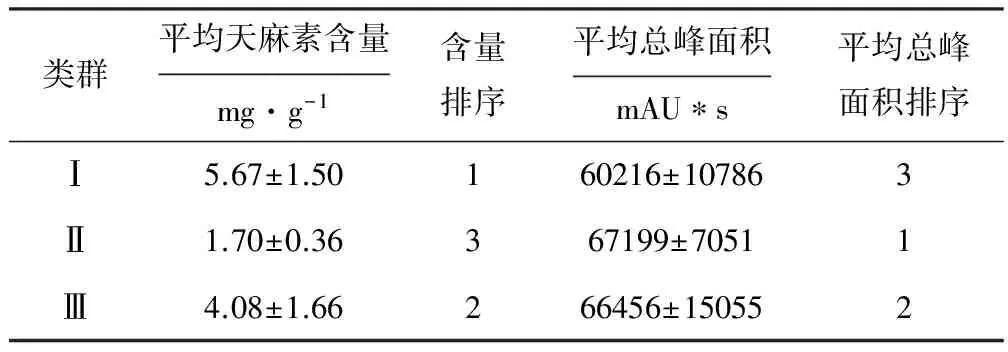
表4 3类天麻的平均天麻素含量和平均总峰面积的比较
由表4可知,第Ⅰ类天麻的天麻素含量最高,平均含量为(5.67±1.50)mg·g-1;第Ⅱ类天麻的天麻素含量最低,平均含量为(1.70±0.36)mg·g-1,但各种成分总峰面积最大,为(67199±7051) mAU*s;第Ⅲ类天麻的天麻素和其它成分含量与它的生化指纹图谱一样,介于第Ⅰ和第Ⅱ类之间。这说明生化指纹图谱与有效成分含量之间存在明显的相关性。
采用非配对试验两样本均数差异显著性t检验,分析天麻各类群天麻素含量的差异显著性。结果表明,第Ⅱ类天麻的天麻素含量与第Ⅰ类(t=3.621,df=22)和第Ⅲ类(t=2.630,df=5)相比具有显著差异性(t>t0.05,P<0.05),第Ⅰ类天麻的天麻素含量与第Ⅲ类相比没有显著差异(t=1.175,df=21,t
2.7.2 天麻综合质量评价
在第Ⅰ类天麻中,湖北宜昌和湖南石门天麻的平均天麻素含量最高,其它化学成分含量也很高,质量最好。这可能与湖南西北部和湖北西南部相邻山区的适宜气候和土壤有关,说明湖南石门至湖北宜昌之间的山区可能比较适宜种植天麻。尽管,吉林长白山天麻与湖北和湖南天麻具有相似的遗传特性(根据它们具有相似的生化指纹图谱推断),但各种成分含量成比例减少。这可能与东北长白山地区长时间气候寒冷有关。这种相关性在其它天然药物研究中也有报道[17,18]。
目前已知,天麻块茎含有天麻素、天麻苷元、香草醛、香草醇、倍半萜类、嘌呤类等多种生化成分,其中天麻素是其主要有效成分;天麻素含量高低是判断天麻质量的重要指标[13~15]。根据天麻素含量和其它成分峰面积进行综合评价:第Ⅰ类天麻质量最好,因为其天麻素含量最高,其它成分含量也较高;第Ⅱ类天麻的天麻素含量最低,就天麻素含量而言,其质量较差,但其它成分含量最高,有其特色;第Ⅲ类天麻质量介于第Ⅰ类和第Ⅱ类之间。综合比较分析发现,表现Ⅰ型生化指纹图谱的天麻种群含有更多的天麻素,是优良的天麻类群。
比较同种天麻不同大小样本的天麻素含量,发现天麻个体大小与天麻素含量没有必然联系。但是,一般说来,中等大小天麻含较多的天麻素和较多的其它成分。
2.8 方法评价
有几种方法可用于同种药用植物的分类。其中生化指纹图谱分类具有明显的优势:既能确定药用植物的遗传本质,又能反映其基因表达的调控水平,还能直接观察和确定其表型数量性状的优劣,具有重要理论意义和应用价值。
实际应用效果表明,作者建立的生化指纹图谱技术比以前报道的方法[15]要好,能有效地分离和检测到天麻更多的生化成分和更高的天麻素含量(高2倍),精密度高、重复性好、指纹图谱清晰,可在更短的时间内(1/6左右时间)完成检测过程。
本方法可用于天麻真伪鉴定。如果被测样本具有天麻的8个共有特征峰便是真正的天麻,否则,便是伪天麻。
3 结论
本研究建立的HPLC指纹图谱测定方法是测定天麻生化指纹图谱的优化方法。根据生化指纹图谱的相似性将9种天麻分成3类。表现Ⅰ型生化指纹图谱的天麻含有更高的天麻素,是优良的种类,其中来自湖北宜昌和湖南石门的天麻质量最好,湖北宜昌至湖南石门之间的山区可能比较适宜种植天麻。天麻的生化指纹图谱、有效成分含量和原产地三者之间存在明显的相关性。本项目研究成果可应用于天麻系统分类、质量评价和品种鉴定与选择。
参考文献:
[1]Alaerts G,Matthijs N,Smeyers J.Chromatographic fingerprint de-velopment for herbal extracts:A screening and optimization methodology on monolithic columns[J].Chroma A,2007,1172(1):1-8.
[2]Locatelli M,Tammaro F,Menghini L,et al.Anthraquinone profile and chemical fingerprint ofRhamnussaxatilisL.from Italy[J].Phytochem Lett,2009,2(4):223-226.
[3]Zheng Y Q,Xin Y W,Guo Y H.Study on the fingerprint profile ofMonascusproducts with HPLC-FD,PAD and MS[J].Food Chem,2009,113(2):705-711.
[4]Gu M,Ouyang F,Su Z G.Comparison of high-speed counter-current chromatography and high-performance liquid chromatography on fingerprinting of Chinese traditional medicine[J].Chroma A,2004,1022(1-2):139-144.
[5]Kong W J,Zhao Y L,Xiao X H,et al.Quantitative and chemical fingerprint analysis for quality control ofRhizomacoptidischinensisbased on UPLC-PAD combined with chemometrics methods[J].Phytomedicin,2009,16(10):950-959.
[6]Li H B,Chen F.Preparative isolation and purification of gastrodin from the Chinese medicinal plantGastrodiaelataby high-speed counter-current chromatography[J].Chromatogr A,2004,1052(1-2):229-232.
[7]肖小河,金城,赵中振,等.论中药质量控制与评价模式的创新与发展[J].中国中药杂志,2007,32(14):1377-1381.
[8]Hsiech M T,Wu C R,Chen C F.Gastrodin andp-hydroxybenzyl alcohol facilitate memory consolidation and retrieval,but not acquisition on the passive avoidance task in rats[J].Ethnopharm,1997,56(1):45-54.
[9]Jung T Y,Suh S I,Lee H,et al.Protective effects of several components ofGastrodiaelataon lipid peroxidation in gerbil brain homogenates[J].Phytothera Res,2007,21(10):960-964.
[10]Kim H J,Moon K D,Oh S Y.Ether fraction of methanol extracts ofGastrodiaelata,a traditional medicinal herb protects against kainie acid-induced neuronal damage in the mouse hippocampus[J].Neurosci Lett,2001,314(1-2):65-68.
[11]Liu Y,Tang X,Pei J,et al.Gastrodin interaction with human fibrinogen:Anticoagulant effects and binding studies[J].Chem European,2006,12(30):7807-7815.
[12]刘中华,胡海涛,冯改丰.天麻素对AB25-35 诱导的Alzhe imer 病细胞模型的保护作用[J].四川大学学报,2005,36(4):537-540.
[13]王莉,王龙星,肖红斌,等.天麻指纹图谱模式识别研究[J].中国中药杂志,2007,32(6):536-538.
[14]谢笑天,郑萍,徐树光,等.HPLC法测定天眩清注射液中天麻素的含量[J].中国新药杂志,2002,11(2):146-148.
[15]张炜,盛欣,张金兰,等.应用HPLC2DAD/MS技术评价中药天麻的质量[J].药学学报,2007,42(2):418-423.
[16]孙振球,徐勇勇.医学统计学[M].北京:人民卫生出版社,2003.
[17]白明生,李国旗,陈彦云.白刺药用有效成分含量的地域性研究[J].西北林业科技大学学报,2008,23(6):147-150.
[18]Zhou J H,Li Y,Zhao J,et al.Geographical traceability of propolis by high-performance liquid chromatography fingerprints[J].Food Chem,2008,108(2):749-759.
