酸浸及紫外诱变对氧化亚铁硫杆菌浸矿的影响
2012-05-07左东云吕早生刘建忠杨之帆
陈 俊,左东云,吕早生,刘建忠,杨之帆
(1.武汉科技大学化学工程与技术学院,湖北 武汉 430081;2.湖北大学生命科学学院,湖北 武汉 430062)
随着矿产的频繁开采,我国的高品位矿资源日渐枯竭,剩下的边缘矿开采成本高,若采用传统的矿物加工技术,不但在技术上有很多困难,而且在经济上也不尽人意,还存在严重的环境污染问题[1]。生物浸提是以湿法冶金和微生物学为基础的交叉学科,即生物湿法冶金(Biohydromentallurgy),其原理是利用微生物及其代谢产物对某些矿物(主要是硫化矿物)和元素(主要是硫元素)的氧化、还原、溶解、吸收等作用,从矿石中溶浸目的金属或从矿物废水中回收有价值金属[2]。与传统的冶炼技术相比,具有投资小、能耗低、污染轻、适合处理低品位和难处理矿石等诸多优点[3,4]。因此,发展生物浸提技术(Bioleaching)意义重大。
氧化亚铁硫杆菌(Thiobacillusferrooxidans,以下简称T.f菌)是矿物浸出体系的主要菌种之一,可用于铁矿、锌矿、铜矿等多种矿石中重要金属的浸出[5~7]。作者在此利用从湖北省大冶市铜山口矿区的酸性矿坑水中选育的T.f菌对该矿区的铁矿进行浸矿处理,考察了酸浸和紫外诱变对T.f菌浸矿的影响。
1 实验
1.1 菌种和矿样
T.f菌(30 ℃下的最适生长pH值为2.0),从湖北省大冶市铜山口矿区的酸性矿坑水中选育得到。
铁矿粉取自湖北省大冶市铜山口矿区。
1.2 培养基
9K液体培养基[8]:(NH4)2SO43.00 g,K2HPO40.50 g,KCl 0.10 g,MgSO4·7H2O 0.50 g,Ca(NO3)20.01 g,FeSO4·7H2O 44.3 g,蒸馏水1000 mL,用浓硫酸调pH值至2.0。
浸矿培养基:用不同量的矿样代替FeSO4·7H2O,其它成分与9K液体培养基相同。
1.3 矿样的处理[9]
1.3.1 酸浸
(1)取10 g矿粉于50 mL离心管中,用蒸馏水洗涤矿粉5次。每次均倒入40 mL蒸馏水,混匀,倒掉上层浊液。
(2)用HCl洗涤矿粉5次。每次均倒入40 mL 5 mol·L-1的HCl,混匀,待其反应完全,倒掉上层浊液。
(3)再用H2SO4洗涤矿粉3次。每次均倒入40 mL pH值2.0的H2SO4,混匀,静置,倒掉上层浊液,直至上层液体澄清为止。
(4)最后再用蒸馏水洗涤矿粉5次,将矿粉平铺于平皿中,于70 ℃的烘箱中烘干。
1.3.2 紫外诱变
参照文献[10]进行。
1.4 浸矿研究
每100 mL浸矿培养基中接入5 mL富集菌液,置于28 ℃的恒温生化培养箱中培养,定时测定菌液中Fe3+的浓度。
1.5 分析检测
Fe2+浓度采用重铬酸钾法测定[11];Fe3+浓度参照文献[11]测定;pH值采用pH计测定。
2 结果与讨论
2.1 T.f菌培养过程中pH值和Fe2+浓度的变化(以FeSO4为底物)(图1)

图1 9K培养液pH值和Fe2+浓度的变化

由图1还可看出,培养液的Fe2+浓度在刚开始时比较稳定,而后直线下降。这与pH值的变化是相似的:细菌在新的环境中生长,需要有一个适应期,消耗的能量较少,Fe2+浓度下降趋势较慢,一旦细菌适应环境后就进入迅速生长期,大量的Fe2+被氧化,Fe2+浓度直线下降。
2.2 浸矿实验
2.2.1 未经处理的矿样的浸出情况
在浸矿工业中,黄铁钒沉淀的生成不利于矿的浸出,而T.f菌是极度嗜酸的(最适生长pH值2.0),在较低pH值时,阻碍Fe3+或Fe2+的水解,进而抑制黄铁钒沉淀的生成,有利于矿的浸出;pH值过高不适宜T.f菌生长,更不利于T.f菌对矿粉的溶浸[13]。
T.f菌以FeSO4为底物时,生长过程中pH值在2~3之间变化(图1);当以未经处理的矿粉为底物时,浸矿过程中的pH值在5~8之间变化(图2)。

图2 未经处理矿粉浸出过程中体系pH值的变化
培养基中的Fe3+浸出率,是工业上评价浸矿工艺的重要指标。未经处理的矿粉浸出过程中体系的Fe3+浓度变化见图3。

图3 未经处理矿粉浸出过程中体系Fe3+浓度的变化
当以FeSO4为底物时,培养液的Fe2+浓度直线下降(图1);当以未经处理的矿粉为底物时,Fe3+浓度变化没有规律(图3)。这可能是由于,T.f菌浸矿后,铁元素以Fe3+的形式存在于溶液中,即与溶液中的其它离子结合生成沉淀,使之无法检测到;同时由于沉淀都有一定的解离常数,只有离子浓度超过一定的值时,才会结合生成沉淀。因此,Fe3+浓度不会超过一定的值,一旦超过这一界限,就会生成沉淀使得浓度降低,因而出现了上述的Fe3+浓度忽高忽低的现象。
2.2.2 酸浸处理的矿样的浸出情况
矿粉经过酸浸处理后,培养基的pH值降至2.5左右,为T.f菌的生长提供了保障,且培养基的pH值不再随着矿样量的变化而变化,而是呈现出整体上升的趋势,表现出一定的规律性(图4),其原因是:细菌氧化Fe2+需要耗酸,使pH值不断上升。

图4 酸浸处理后的矿粉浸出过程中体系pH值的变化
Fe3+的浓度变化仍然没有规律(图5),但是摇瓶培养液由澄清变成棕黄色(图6)。表明确实有Fe3+生成,但究竟是何原因导致溶浸后的Fe3+难以检测,有待进一步研究。
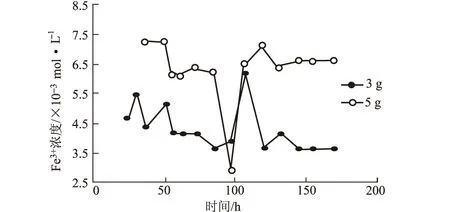
图5 酸浸处理后的矿粉浸出过程中体系Fe3+浓度的变化

酸浸处理的3 g矿粉 左:对照(未接种菌);右:接种T.f菌 酸浸处理的5 g矿粉
2.2.3 紫外诱变处理的矿样的浸出情况
T.f菌生长缓慢,严重制约了其在浸矿工业中的应用,因此必须选育优良菌种。紫外诱变是T.f菌诱变育种的首选方法[14]。王建伟等[10]对T.f菌和中度嗜热菌进行紫外诱变处理,发现两株菌的浸矿能力均有所提高。
由于混合菌浸矿能力一般较单一菌浸矿能力要强[15~18]。因此,对富集多轮后的混合菌液直接进行紫外诱变,获得具有高效浸矿能力的混合菌群,将其用于浸矿处理(为了消除误差,进行了3组平行实验),结果见图7。

图7 紫外诱变处理前后Fe2+浓度的变化
由图7可以看出,诱变前后,混合菌的浸矿能力并没有明显提高。这可能是由于,紫外诱变是随机的,即正突变和负突变的概率相等,当对混合菌群进行紫外诱变,特别是单次紫外诱变时,很难大幅度提高混合菌的浸矿能力。可以采取多次诱变、多次富集的育种程序,选育优良的混合菌群,或者将单菌株诱变后再进行复合,有待进一步深入研究。
3 结论
利用选育的氧化亚铁硫杆菌(30 ℃下的最适生长pH值为2.0)用于铁矿的浸矿研究。结果表明,在9K液体培养基中以FeSO4为底物时,体系pH值先逐渐升高后缓慢降低;矿粉未经酸浸处理时,对体系的pH值影响较大,从而影响T.f菌的生长,进而影响浸矿效果;矿粉经过酸浸处理后,在整个浸矿过程中,体系pH值相对恒定,细菌生长良好;对混合菌群进行单次紫外诱变,未能明显提高浸矿能力。因此,要获得具有实际应用价值的高活性混合浸矿菌种,需要对混合菌群进行多次诱变选育,或者单菌株诱变后再进行复合。
参考文献:
[1] 尹升华,吴爱祥,王洪江,等.微生物浸出低品位矿石技术现状与发展趋势[J].矿业研究与开发,2010,30(1):46-49.
[2] 田君.微生物湿法冶金研究与实践[J].现代矿业,2009,(11):29-34.
[3] Li S P,Guo N,Wu H Y,et al.High efficient mixed culture screening and selected microbial community shift for bioleaching process[J].Transactions of Nonferrous Metals Society of China,2011,21(6):1383-1387.
[4] Yin Sheng-hua,Wu Ai-xiang,Qiu Guan-zhou.Bioleaching of low-grade copper sulphides[J].Transactions of Nonferrous Metals Society of China,2008,18(3):707-713.
[5] Wang Hong-mei,Bigham Jerry M,Tuovinen Olli H.Oxidation of marcasite and pyrite by iron-oxidizing bacteria and archaea[J].Hydrometallurgy,2007,88(1-4):127-131.
[6] Yang Congren,Qin Wenqing,Lai Shaoshi,et al.Bioleaching of a low grade nickel-copper-cobalt sulfide ore[J].Hydrometallurgy,2011,106(1-2):32-37.
[7] Haghshenas D F,Alamdari E K,Torkmahalleh M A,et al.Adaptation ofAcidithiobacillusferrooxidansto high grade sphalerite concentrate[J].Minerals Engineering,2009,22(15):1299-1306.
[8] 龚文琪,陈伟,张晓峥,等.氧化亚铁硫杆菌的分离培养及其浸磷效果[J].过程工程学报,2007,7(3):584-588.
[9] 李邦梅.嗜酸氧化亚铁硫杆菌分离鉴定及其与硫化矿物相互作用研究[D].长沙:中南大学,2007.
[10] 王建伟,汪模辉,袁源.氧化亚铁硫杆菌及中度嗜热菌的紫外诱变对黄铜矿的浸出[J].有色金属,2008,(5):5-7.
[11] 陈红,陈新华.4株不同来源的嗜酸氧化亚铁硫杆菌某些生理特征的比较研究[J].台湾海峡,2007,26(4):562-568.
[12] 王艳锦,郑正,周培国,等.不同培养基中氧化亚铁硫杆菌生长及沉淀研究[J].生物技术,2006,16(4):70-73.
[13] 张在海,邱冠周,胡岳华,等.氧化亚铁硫杆菌的菌落分离研究[J].矿产综合利用,2001,(1):19-22.
[14] 张在海,王淀佐,邱冠周,等.氧化亚铁硫杆菌亚铁氧化活性诱变育种理论探讨[J].铜业工程,2001,(1):12-15.
[15] Qiu Mu-qing,Xiong Shui-ying,Zhang Wei-min.Efficacy of chalcopyrite bioleaching using a pure and mixed bacterium[J].Journal of University of Science and Technology Beijing,2006,13(1):7-10.
[16] Donati E,Curutchet G,Pogliani C,et al.Bioleaching of covellite using pure and mixed cultures ofThiobacillusferrooxidansandThiobacillusthiooxidans[J].Process Biochem,1996,31(2):129-134.
[17] Bevilaqua D,Leite A L L C,Garcia O,et al.Oxidation of chalcopyrite byAcidithiobacillusferrooxidansandAcidithiobacillusthiooxidansin shake flasks[J].Process Biochem,2002,38(4):587-592.
[18] d′Hugues P,Foucher S,Galle′-Cavalloni P,et al.Continuous bioleaching of chalcopyrite using a novel extremely thermophilic mixed culture[J].Int J Miner Process,2002,66(1):107-119.
