光谱法研究羟喜树碱与牛血清白蛋白的相互作用
2012-05-07苑莉莉张业中
苑莉莉,刘 雄,张业中,戴 捷
(长江大学化学与环境工程学院,湖北 荆州 434023)
喜树碱(Camptothecin,CPT)是从珙桐科植物喜树的树干、树皮和果实中提取的一种具有抗肿瘤作用的生物碱[1,2],羟喜树碱(10-Hydroxycamptothecin,HCPT)是将喜树碱基本环A环中9位的-H由-OH取代而成。体外实验和动物实验均显示HCPT比CPT有更强的抗肿瘤作用和更宽的抗瘤谱,且毒性较低,在同类抗肿瘤单体中活性最强[3,4]。HCPT的独特作用位点使其具有专一性强、对正常组织影响小、药性与其它常用抗癌药物无交叉耐药性的特点,临床上已经被广泛应用。
血清白蛋白是循环系统中含量最丰富的可溶性载体蛋白,它可以与许多内源及外源性物质结合起到存储与转运作用,是生物体内重要的药物小分子结合蛋白[5]。考虑到HCPT的活性与重要的医疗价值,研究其与血清白蛋白的相互作用,不仅有助于了解HCPT在生物体内的吸收、转运及代谢,而且有助于认识其药物作用的药效和药理,为新药研发及临床用药提供参考。
作者在此利用多种光谱技术,在模拟人体生理条件下,研究HCPT与牛血清白蛋白(BSA)的相互作用。利用荧光光谱法,计算其猝灭常数和结合常数,并从分子水平探讨其猝灭机制和结合模式;利用三维荧光光谱和圆二色谱(CD)探讨HCPT对BSA构象的影响。对进一步获取蛋白质的构象、结构,了解药物在人体内的储存、运输、吸收、分布等过程有着重大意义。
1 实验
1.1 试剂与仪器
HCPT溶液(1.0×10-3mol·L-1),中国药品生物制品检定所;BSA(2.0×10-6mol·L-1),Sigma公司;NaOH溶液;pH值为7.40的Tris-HCl缓冲溶液;所用试剂均为分析纯;实验用水为二次蒸馏水,经检验均无荧光杂质。
LS-55型荧光分光光度计,美国Perkin公司;J-810型圆二色谱仪,Jasco,Tokyo,Japan;AY-120M型电子分析天平,日本岛津公司;SYC-15型超级恒温水浴(控温精度±0.1 ℃),南京桑力电子设备厂。
1.2 方法
1.2.1 荧光猝灭光谱
设定激发波长λex为285 nm、激发狭缝宽度为15.0 nm、发射狭缝宽度为4.0 nm,在模拟人体生理条件下测定不同温度下(298 K、304 K和310 K)不同浓度的HCPT溶液与BSA相互作用的荧光猝灭光谱,记录波长300~450 nm范围内的荧光光谱。
1.2.2 圆二色谱(CD)
用圆二色谱仪测定室温时的CD光谱。参数如下:比色杯光路长为0.1 cm,扫描速度为200 nm·min-1,在pH值为7.40的持续氮流条件下测定200~260 nm波长范围内BSA与HCPT作用前后的CD光谱。圆二色谱由Jasco′s Spectra Manager MT软件控制。不改变实验条件,以缓冲溶液代替HCPT作为空白对照。
1.2.3 三维荧光光谱
用荧光分光光度计测量BSA和HCPT-BSA的三维荧光光谱。设置初始激发波长为200 nm,在200~350 nm之间每隔5 nm记录1次,共扫描31次,其它参数与荧光光谱相同。
2 结果与讨论
2.1 荧光光谱
蛋白质中因含有色氨酸、酪氨酸及苯丙氨酸残基而发射较强的内源荧光[6]。图1是不同浓度的HCPT对BSA的荧光猝灭光谱。

T=298 K;λex=285 nm;c(BSA)=2.0×10-6mol·L-1;c(HCPT),A~I(×10-6 mol·L-1):0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0;L为HCPT的激发光谱,c(HCPT)=1.0×10-6 mol·L-1
由图1可看出,当激发波长为285 nm时,BSA在350 nm处有一个强的荧光发射峰,而HCPT却没有任何内源荧光;随着 HCPT浓度的增大,BSA的内源荧光强度有规律地降低,表明HCPT能猝灭BSA的内源荧光。由图1还可以看出,最大发射波长有明显的蓝移现象,并且在415 nm处有一个等发射点,表明蛋白质的构象发生了改变,色氨酸残基周围环境的极性减弱,疏水作用力增强。
2.2 荧光猝灭机制
荧光猝灭过程可分为动态猝灭和静态猝灭,可以从温度对猝灭常数的影响、猝灭剂对荧光物质的吸收光谱的影响和荧光寿命等方面加以区分。研究表明,动态猝灭过程的猝灭常数随温度升高而增大;而静态猝灭过程的猝灭常数随温度升高而减小。
本实验利用温度对猝灭常数的影响来判断猝灭机制。
不同温度下,HCPT对BSA的荧光猝灭的Stern-Volmer关系见图2。

图2 不同温度下pH=7.40时,HCPT对BSA荧光猝灭的Stern-Volmer关系图
为了判断HCPT-BSA体系的猝灭机制,用经典Stern-Volmer方程[7]分析3个不同温度(298 K、304 K、310 K)下的荧光猝灭数据:
F0/F=1+KSVcq=1+Kqτ0cq
(1)
式中:F和F0分别为有无猝灭剂时体系中荧光物质的荧光强度;KSV为Stern-Volmer猝灭常数;cq为猝灭剂的浓度;Kq为生物大分子的猝灭速率常数;τ0为生物大分子内源性荧光寿命,其值为10-8s。应用式(1)计算3个温度下的猝灭常数,结果见表1。
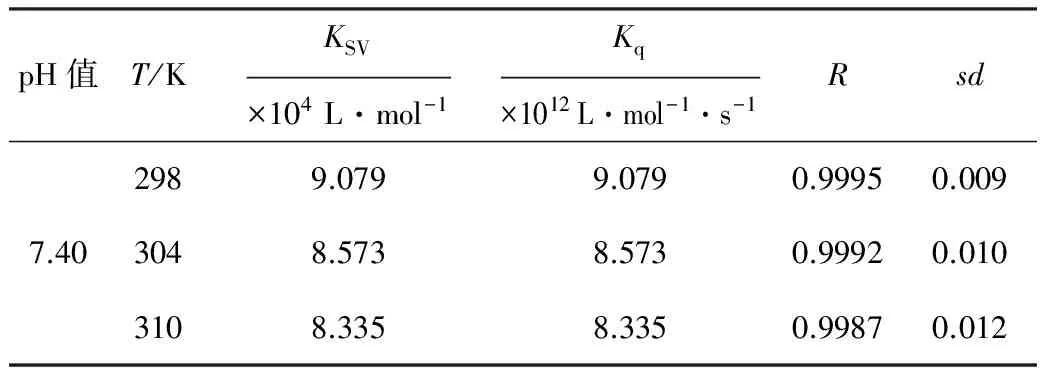
表1 不同温度下,HCPT与BSA相互作用的Stern-Volmer猝灭常数
由表1可知,猝灭常数KSV随温度的升高而减小,Kq值远大于生物大分子的最大分散碰撞猝灭常数(2.0×1010L·mol-1·s-1)。因此,初步判断其猝灭机制为静态猝灭。
为了进一步研究其猝灭机制,用修正的Stern-Volmer方程[8]来处理猝灭数据:
F0/(F0-F)=1/(faKacq)+1/fa
(2)
修正Stern-Volmer方程的表观结合常数Ka见表2。
由表2可以看出,Ka随温度的变化趋势与KSV一致,表明HCPT确实与BSA结合生成了HCPT-BSA复合物。

图3 不同温度下pH=7.40时,HCPT对BSA荧光猝灭的修正的Stern-Volmer关系图

表2 修正Stern-Volmer方程的表观结合常数Ka和HCPT-BSA体系的相关热力学参数
2.3 HCPT与BSA作用力类型的判断
活性小分子和生物大分子之间的相互作用力包括氢键、静电引力、范德华力、疏水作用力4种[9]。假设在测定温度范围内焓变(ΔHθ)变化不大,可视为常数,则它的值和熵变(ΔSθ)可以从 Van′t Hoff方程求得:
lnK=-ΔHθ/RT+ΔSθ/R
(3)
式中:K为相应温度下的结合常数;R为气体常数;ΔHθ和ΔSθ可以分别从图4的斜率和截距中得出。
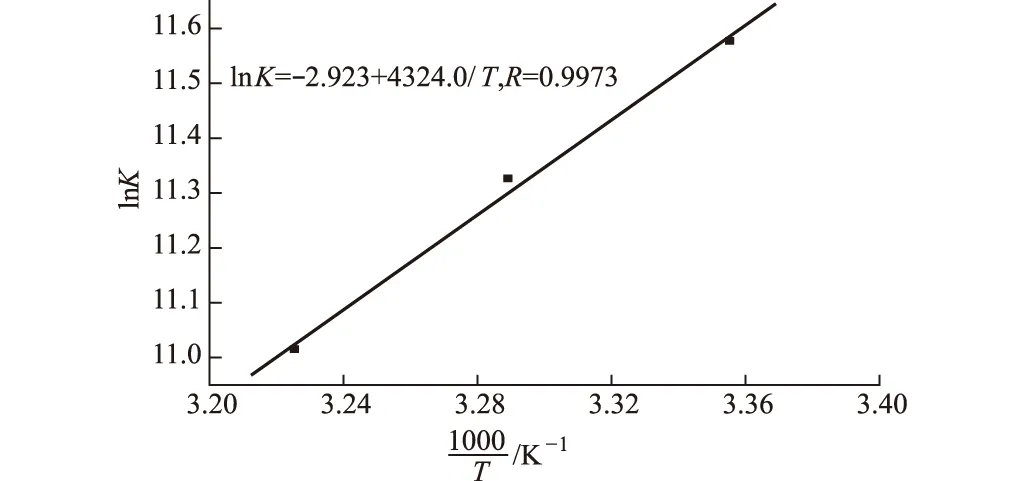
图4 HCPT和BSA相互作用的Van′t Hoff曲线(pH=7.40)
自由能变(ΔGθ)由下式计算:
ΔGθ=ΔHθ-TΔSθ
(4)
ΔGθ、ΔHθ、ΔSθ的计算结果见表2。
Ross等根据大量的实验结果,总结了判断生物大分子与小分子相互作用力类型的热力学规律,即疏水作用力使体系的ΔHθ和ΔSθ为正,氢键或范德华力使体系的ΔHθ和ΔSθ为负[10]。由表2中的ΔHθ(-35.91 kJ·mol-1)和ΔSθ(-24.30 J·mol-1·K-1)可知,结合过程的作用力类型主要为氢键和范德华力,同时疏水作用力也不能忽略。
2.4 HCPT对BSA构象的影响
2.4.1 CD光谱
CD光谱是研究稀溶液中蛋白质构象的一种快速、简单且较准确的方法。为了研究HCPT对BSA构象的影响,测定了室温条件下BSA和HCPT-BSA体系的CD光谱,结果见图5。

c(BSA)=2.0×10-6 mol·L-1;c(HCPT),A~C(×10-6 mol·L-1):0、4.0、12.0
由图5可以看出,BSA的α-螺旋结构在208 nm和222 nm的紫外区出现2个负的特征肩峰谱带,随着HCPT的加入,BSA峰强度明显减小,但是峰的形状和峰高没有发生改变。这表明,HCPT的存在对BSA二级结构有一定的影响,但α-螺旋结构依然占主导地位。
为了定量分析BSA中不同二级结构的含量,用SELCON3算法分析CD光谱,结果见表3[11]。
由表3可知,在游离态的BSA中,α-螺旋结构(规则的α-螺旋和不规则的α-螺旋)的含量为60.7%;但当BSA与HCPT的摩尔比达到1∶6时,BSA中α-螺旋结构的含量降至55.8%。这表明HCPT与BSA多肽链氨基酸残基的结合,破坏了BSA多肽链上的氢键,导致肽链变得疏松[12]。

表3 SELCON3计算的BSA中不同二级结构的含量/%
2.4.2 三维荧光光谱
三维荧光光谱是近20年发展起来的荧光分析新技术。此分析方法不仅可以提高测量灵敏度和对分子结构的选择性,而且能够更全面地展现待测样品的荧光信息和构型变化特征。图6和表4分别是BSA和HCPT-BSA体系的三维荧光光谱及数据分析。

c(BSA)=2.0×10-6 mol·L-1;c(HCPT),A~B(×10-6 mol·L-1):0,2.0

表4 BSA 和 HCPT-BSA体系的三维荧光光谱的特性参数
由图6和表4可以看出:峰a是瑞利散射峰(λex=λem)[13],随着HCPT的加入,峰强度减弱,可能是由于HCPT在BSA表面结合后,破坏了BSA表面的保护水层,使原来较为分散的BSA更加分散,引起BSA粒径减小,导致共振散射强度下降。峰b是二级散射峰(λem=2λex)[14]。峰1(λex=285.0 nm,λem=351.0 nm)显示了色氨酸和酪氨酸残基的光谱行为,其最大发射波长和荧光强度与微环境的极性密切相关,是研究荧光猝灭时的主荧光峰。此外,除了峰1,还有一个新的强荧光峰——峰2(λex=230.0 nm,λem=351.0 nm),该峰的激发波长为230.0 nm,在CD光谱图中,由于多肽链的α-螺旋的n→π*能量跃迁在208 nm和222 nm出现了2个负峰,所以推测峰2主要显示了多肽主链结构的荧光性质。分析加入HCPT前后峰1和峰2的强度变化,发现其荧光强度都明显猝灭但猝灭的程度不同,峰1的强度猝灭了26.8%,而峰2的强度猝灭了34.6%。
综合三维荧光光谱和CD光谱的结果,得出以下结论,HCPT与BSA的相互作用改变了蛋白质的有序结构和疏水腔内的微环境[15]。
3 结论
在模拟人体生理条件下,测定了不同温度下HCPT对BSA的荧光猝灭光谱,根据相关理论判断出该反应为形成复合物的静态猝灭过程。并由相关的热力学公式,求得不同温度下的热力学参数,由计算所得到的数据及相关的判别理论,推测出氢键和范德华力为维持复合物稳定的主要作用力类型,同时疏水作用力也不能忽略。通过室温条件下的圆二色谱和三维荧光光谱分析,发现在加入HCPT后,BSA的α-螺旋含量减少,进一步说明其二级结构和微环境发生了改变。
参考文献:
[1] Garcia-Carbonero R,Supko J G.Current perspectives on the clinical experience,pharmacology,and continued development of the camptothecins[J].Clinical Cancer Research,2002,8(3):641-661.
[2] Zhou Y Y,Du Y Z,Wang L,et al.Preparation and pharmacodynamics of stearic acid and poly(lactic-co-glycolic acid) grafted chitosan oligosaccharide micelles for 10-hydroxycamptothecin[J].International Journal of Pharmaceutics,2010,393(1-2):143-151.
[3] Liu K H,Ding X W,Deng B W,et al.10-Hydroxycamptothecin produced by a new endophyticXylariasp.,M20,fromCamptothecaacuminata[J].Biotechnology Letters,2010,32(5):689-693.
[4] Shweta S,Zuehlke S,Ramesha B T,et al.Endophytic fungal st-rains ofFusariumsolani,fromApodytesdimidiataE.Mey.ex Arn(Icacinaceae) produce camptothecin,10-hydroxycamptothecin and 9-methoxycamptothecin[J].Phytochemistry,2010,71(1):117-122.
[5] Hu Y J,Ou-Yang Y,Bai A M,et al.Investigation of the interaction between ofloxacin and bovine serum albumin:Spectroscopic approach[J].Journal of Solution Chemistry,2010,39(5):709-717.
[6] 张敏,彭毛,李小平,等.光谱法研究蛋白质与胆红素及铜的相互作用[J].化学与生物工程,2007,24(3):27-30.
[7] Wang T H,Zhao Z M,Wei B Z,et al.Spectroscopic investigations on the binding of dibazol to bovine serum albumin[J].Journal of Molecular Structure,2010,970(1-3):128-133.
[8] 朱铿,童沈阳.荧光黄与蛋白质相互作用的研究[J].高等学校化学学报,1996,17(4):539-542.
[9] 贾文志,孙绍发.光谱法研究一种喹唑啉酮衍生物与牛血清白蛋白的相互作用[J].化学世界,2009,50(1):4-14.
[10] 谢郢,李永成,杨立云,等.替加氟与牛血清白蛋白相互作用的研究[J].化学与生物工程,2010,27(9):48-52.
[11] Zhang Y Z,Zhou B,Zhang X P,et al.Interaction of malachite green with bovine serum albumin:Determination of the binding mechanism and binding site by spectroscopic methods[J].Journal of Hazardous Materials,2009,163(2-3):1345-1352.
[12] Xu X Y,Sun X J,Liu M,et al.Study on the thermodynamic behavior of betaxolol-bovine serum albumin interacting system[J].Thermochimica Acta,2010,501(1-2):46-49.
[13] Li X Y.Study on the interaction of metronidazole with bovine serum albumin by using fluorescence and resonance lalyeigh light scattering spectrum[J].Acta Physico-Chimica Sinica,2007,23(2):262-267.
[14] 李晓燕.用荧光光谱和共振光散射光谱研究甲硝唑与牛血清白蛋白的相互作用[J].物理化学学报,2007,23(2):262-267.
[15] He W Y,Li Y,Xue C X,et al.Effect of Chinese medicine alpinetin on the structure of human serum albumin[J].Bioorganic & Medicinal Chemistry,2005,13(5):1837-1845.
