高速逆流色谱分离纯化冻青中的黄酮类化合物
2012-05-07谢冠男吴洪发
高 冷,谢冠男,刘 达,吴洪发
(长春工业大学化学与生命科学学院,吉林 长春 130012)
冻青学名槲寄生[Viscumcoloratum(Kom.) Nakai],双子叶植物纲,常绿半寄生小灌木,其主产区在东北,常寄生在杨树、柳树、榆树上[1]。冻青的主要活性成分有黄酮类化合物[2]、槲寄生凝集素[3]、毒素、生物碱、有机酸及木脂素等[4,5]。其中黄酮类化合物具有抗菌、抗病毒、抗衰老、降压、降血脂、提高机体免疫力等药理活性[6,7]。目前,采用高效液相色谱法(HPLC)尚无法大量分离出冻青中一种或多种活性成分。
高速逆流色谱(High-speed counter-current chromatography,HSCCC)是一种高效快速的液-液分离技术,是将处于高速动态平衡且互不混溶的两相溶剂中的样品按不同的分配比将组分分离。由于不需要固相载体作固定相,避免了样品的不可逆吸附、损失和污染[8],同时该技术具备良好的重现性,可同步完成制备、分离、纯化过程,因此被广泛应用于天然产物有效成分的分离制备及中药的分析鉴定[9~11]。
作者以长白山区冻青为原料,采用超声波辅助浸提其中的黄酮类化合物,并首次采用HSCCC和大孔吸附树脂相结合对其进行分离纯化,可为中草药中活性成分的分离纯化和制备提供参考。
1 实验
1.1 材料、试剂与仪器
冻青,2009年11月采自长白山地区,经鉴定为Viscumcoloratum(Kom.) Nakai。
AB-8大孔吸附树脂,安徽三星树脂有限公司;乙醇、正己烷、乙酸乙酯、甲醇,分析纯,北京化工厂;甲醇,色谱纯,天津康科德科技有限公司;实验用水为超纯水。
LGJ-30型冷冻干燥机,北京松源华兴科技发展有限公司;GL-21LM型离心机,星科科学仪器有限公司;SCIENT2-HF2000型超声波循环提取机,宁波新芝生物科技股份有限公司;Agilent-1100型高效液相色谱仪,美国安捷伦公司;TBE-300型高速逆流色谱仪,上海同田生化技术有限公司;Mercury plus 400型核磁共振仪,美国Varian公司。
1.2 方法
1.2.1 预处理
取50 g干燥的冻青茎粉碎,过60目标准筛,用乙醚索氏提取去除油脂以及色素等脂溶性杂质,弃去溶液,回收原料,干燥挥发除去原料中的乙醚;再用60%乙醇溶液按料液比1∶15,超声提取20 min,将粗提液浓缩,冷冻干燥得冻青粗提物1.26 g。
1.2.2 大孔吸附树脂除杂
冻青粗提物用蒸馏水溶解,离心去除不溶物,上清液经AB-8大孔吸附树脂柱吸附,先用3 BV的蒸馏水洗脱,再用3 BV的60%乙醇溶液洗脱,收集洗脱液,浓缩,冷冻干燥,得冻青粗提黄酮,进行HPLC检测,选择其中主要组分作为HSCCC目标分离物。
1.2.3 溶剂体系的选择
依据文献[12]用HPLC测定样品在不同溶剂体系[正己烷-乙酸乙酯-甲醇-水(3∶4∶5∶3,体积比,下同)、乙酸乙酯-正丁醇-水(2∶1∶3)、氯仿-甲醇-水(4∶3∶2)、石油醚-乙酸乙酯-甲醇-水(1∶2∶2∶1)]中的分配系数。称取1 mg冻青粗提黄酮置于5 mL试管中,分别加入已经达到平衡的上、下相溶剂各1 mL,振荡使样品充分溶解,静置平衡,然后上下相各取0.2 mL,离心浓缩干燥,接着用甲醇溶解,进行HPLC检测,并计算分配系数,据此选择适宜的溶剂体系。分配系数依下式计算:
式中:A1、A2分别为上、下相中化合物的峰面积。
1.2.4 HSCCC分离纯化
按比例配制选定溶剂体系,放入分液漏斗中静置分层,分层时间为50 s,上相为固定相,下相为流动相,螺旋管柱正转800 r·min-1,流动相流速3 mL·min-1,进样量20 mL,进样浓度20 mg·mL-1,检测波长254 nm。手动收集流出液,旋转蒸发浓缩,冷冻干燥,得到淡黄色化合物Ⅰ和白色化合物Ⅱ。
1.3 分析测试
采用高效液相色谱分析冻青粗提物、冻青粗提黄酮、化合物Ⅰ和化合物Ⅱ。色谱条件为:Kromasil KR006-C18不锈钢色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-水(60∶40),流速为0.8 mL·min-1,进样量10 μL,柱温28 ℃,检测波长254 nm。
采用核磁共振(1HNMR、13CNMR)对化合物Ⅰ和化合物Ⅱ进行结构鉴定。样品以氖代二甲基亚砜(DMSO-d6)溶解。
2 结果与讨论
2.1 冻青粗提物的HPLC分析(图1)
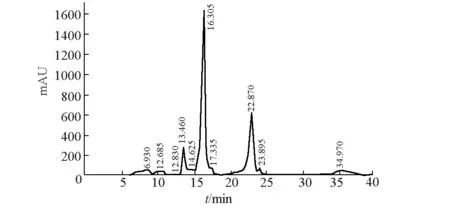
图1 冻青粗提物的HPLC图谱
由图1可知,冻青粗提物在10~25 min之间出峰较多,且16.305 min和22.870 min处的化合物的含量较高。另外,冻青粗提物含有大量的杂质,需要进一步分离纯化。
2.2 冻青粗提黄酮的HPLC分析(图2)

图2 冻青粗提黄酮的HPLC图谱
由图2可以看出,经大孔吸附树脂分离纯化后得到的冻青粗提黄酮杂质明显减少,主要存在两类化合物Ⅰ、Ⅱ,其出峰时间与冻青粗提物比较接近,分别为16.425 min、22.965 min。以化合物Ⅰ和Ⅱ为目标分离物选择溶剂体系进行下一步HSCCC分离。
2.3 溶剂体系的选择
冻青粗提黄酮在不同溶剂体系中的分配系数见表1。

表1 冻青粗提黄酮在不同溶剂体系中的分配系数
综合考虑分配系数(表1)、固定相保留率、分离度和峰形,选择正己烷-乙酸乙酯-甲醇-水(3∶4∶5∶3)作为适宜的溶剂体系用于HSCCC分离纯化。
2.4 HSCCC分离纯化结果
溶剂体系为正己烷-乙酸乙酯-甲醇-水(3∶4∶5∶3),HSCCC分离冻青粗提黄酮中的化合物Ⅰ、Ⅱ,结果见图3。
重复进样分离2次,分别收集图3所示两种化合物Ⅰ、Ⅱ流出液,进行后续纯度检测。

图3 冻青粗提黄酮的HSCCC分离图谱
2.5 产物纯度测定
将HSCCC分离所得的化合物Ⅰ和化合物Ⅱ,用甲醇溶解后进行HPLC测定,纯度分别为98.01%和96.10%,HPLC图谱见图4。
2.6 产物结构鉴定
化合物Ⅰ的核磁共振数据:1HNMR(DMSO-d6),δ,ppm:1.72(1H,s,-CO-CH3,C6″),5.42(1H,d,J=8 Hz,1 Hz,β-葡萄糖基C1-H),6.31(1H,d,J=2 Hz,C6-H), 6.70(1H,d,J=2 Hz,C8-H), 6.85(1H,d,J=8 Hz,C5′-H),7.51(1H,dd,J=8 Hz,1.5 Hz,C6′-H,C6,8-H), 7.78(1H, d,J=1.5 Hz,C2′-H),9.73(1H,s,C4′-OH),12.48(1H,s,C5′-OH)。13CNMR(DMSO-d6),δ,ppm:156.9(C2),133.8(C3),177.8(C4),160.8(C5),93.3(C6),165.5(C7),92.6(C8),156.6(C9),105.4(C10),121.5(C1′),113.8(C2′),149.8(C3′),147.3(C4′),115.6(C5′),122.6(C6′),56.5(OCH3),56.2(OCH3),101.3(C1″),74.6(C2″),77.5(C3″),70.2(C4″),76.6(C5″),60.8(C6″)。以上数据与已知鼠李秦素-3-O-β-D-葡萄糖苷的核磁共振数据一致[13]。

图4 化合物Ⅰ(a)和化合物Ⅱ(b)的HPLC图谱
化合物Ⅱ的核磁共振数据:1HNMR(DMSO-d6),δ,ppm:2.76(1H,dd,J=4 Hz,12 Hz,C3,cis-H),3.23~3.47(m,糖分子中H,OH峰及C3,trans-H),5.04(H,m,β-葡萄糖基C1-H),3.79(3H,s,C3′-OCH3),5.49(1H,dd,J=4 Hz,1 Hz,C2-H),6.17(2H,s,C6,8-H),6.90(1H,d,J=8.5 Hz,1 Hz,C5′-H),6.92(1H,dd,J=8.5 Hz,2 Hz,C6′-H),7.11(1H,d,J=2 Hz,C2′-H),9.18(1H,s,C4′-OH),12.07(1H,s,C5-OH)。13CNMR(DMSO-d6),δ,ppm:79.1(C2),42.3(C3),197.4(C4),163.1(C5),96.7(C6),165.5(C7),95.9(C8),162.9(C9),103.4(C10),129.3(C1′),111.4(C2′),147.7(C3′),147.2(C4′),115.6(C5′),120.1(C6′),56.0(OCH3),99.9(C1″),73.2(C2″),77.2(C3″),69.7(C4″),76.4(C5″),60.8(C6″)。以上数据与已知高圣草素-7-O-β-D-葡萄糖苷的核磁共振数据一致[14]。
3 结论
采用高速逆流色谱和大孔吸附树脂相结合的方法,从冻青中分离出两种高纯度黄酮类化合物,纯度分别为98.01%、96.10%,经HPLC和NMR鉴定为鼠李秦素-3-O-β-D-葡萄糖苷和高圣草素-7-O-β-D-葡萄糖苷。采用HSCCC技术分离中草药有效成分可以达到较高的纯度和产率,制备量大、效率高,优势独特,具有非常广阔的应用前景。
参考文献:
[1] 孙艳秋,刘珂,王守愚,等.槲寄生的研究进展[J].中草药,2000,23(6):471.
[2] Zhu Qin-yan,Huang Yu,Chen Zhen-yu.Interaction between flavonoids andα-tocopherol in human low density lipoprotein[J].J Nutr Biochem,2000,11(1):14-21.
[3] 周彬,杨文革,缪建,等.槲寄生凝集素粗品提取工艺研究[J].中成药,2007,29(5):762-764.
[4] 殷红妹.HPLC-ELSD法测定槲寄生中齐墩果酸的含量[J].浙江中医药大学学报,2011,35(2):244-245.
[5] 刘成梅,李莉,田建文,等.槲寄生中黄酮及生物碱的提取研究[J].食品科技,2007,32(5):129-131.
[6] 彭海燕,章永红,韩英,等.槲寄生碱抗肝癌作用实验研究[J].实用中医药杂志,2004,20(5):227.
[7] 李盈蕾,陈建华,陈亚洲.槲寄生总黄酮微波提取工艺及其抗氧化活性研究[J].食品科学,2010,31(12):62-66.
[8] 魏芸,张天佑,吴克友.高速逆流色谱法对刺五加有效成分刺五加苷E的分离制备[J].色谱,2002,20(6):543-545.
[9] 伍方勇,戴德舜,王义明.高速逆流色谱与质谱联用在中药分析中的应用[J].高等学校化学学报,2002,23(9):1698-1700.
[10] Sutherland I A.Recent progress on the industrial scale-up of counter-current chromatography[J].Journal of Chromatography A,2007,1151(1-2):6-13.
[11] Okunji C,Komarnytsky S,Fear G,et al.Preparative isolation and identification of tyrosinase inhibitors from the seeds ofGarciniakolaby high-speed counter-current chromatography[J].Journal of Chromatography A,2007,1151(1-2):45-50.
[12] Ito Y A,Conway W D.High-Speed Counter-Current Chromatography[M].New York:Wiely/Interscience,1996:36.
[13] 谢友良.南药青天葵的抗急性肺损伤作用机理及其质量标准研究[D].广州:广州中医药大学,2008.
[14] 赵云丽,马铭研,高晓霞,等.槲寄生中高圣草素-7-O-β-D-葡萄糖苷的分离及含量测定[J].色谱,2006,24(5):479-481.
